33.Принцип Ле-Шателье. При неизменных условиях химическое равновесие в системе может сохраняться сколь угодно долго. В случае же изменения условий (концентрация, температура, давление) одна из противоположно направленных реакций может ускориться. После этого равновесие сместится, и установится новое состояние равновесия. Принцип Ле-Шателье: если на систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия.1. Влияние температуры. Повышение температуры смещает равновесие в сторону процесса, идущего с поглощением тепла: 2SO2+O2 → 2SO3+Q
|
40.Скорость
химической реакции. Закон действующих
масс. Константа скорости. Скорость
гомогенной
(однофазной) реакции зависит от природы
реагирующих веществ, их концентрации
и температуры. Скорость гетерогенных
(многофазных) процессов зависит от
размеров и состояния поверхности
раздела фаз. Примечание.
Гетерогенные – процессы, происходящие
на поверхности раздела соприкасающихся
фаз. (горение топлива, окисление
металлов кислородом воздуха).Закон
действующих масс. Справедлив
для гомогенных реакций. Формулировка:
при
постоянной температуре скорость
химической реакции пропорциональна
произведению концентраций реагирующих
веществ. Константа скорости обозначается
как
|
41.Молекулярность
и порядок реакции. Реакции
с точки зрения частиц классифицируются
по признаку молекулярности
или по признаку порядка
молекулярности. Молекулярность
определяется по числу молекул,
одновременное соударение которых
приводит к химическому воздействию.
Одномолекулярная
реакция:
J2=2J
Трехмолекулярная
реакция:
Порядок
реакции = сумме показателей степеней
у концентраций в уравнении, выражающем
зависимость скорости реакции от
концентраций реагирующих веществ.
Реакция
A+B=AB, AB+B=AB2 |
42.Кинетическая
классификация по степени сложности.
Обратимые и необратимые реакции. По
степени сложности реакции подразделяются
на изолированные, параллельные,
сопряженные, последовательные
(многоступенчатые), обратимые и
необратимые. Изолированные
– при их протекании образуются продукты
только одного типа. Параллельные
– в ходе них взятые вещества одновременно
реагируют в двух или более направлениях
(образуются разные продукты).Пример.
Разложение бертолетовой соли
Различают
практически
необратимые
и совершенно
необратимые
реакции. Практически необратимые –
реакции, в результате которых образуется
осадок. Совершенно необратимые –
протекают только в одном направлении.
Пример.
v1 A+B↔C+D v2
|
эмпирическое ур-е Аррениуса.
|
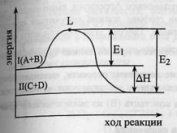
44.Энергия
активации химической реакции.
Аналитический и графический метод
расчета. С
ростом температуры происходит
перераспределение энергии между
молекулами так, что резко возрастает
число активных молекул, обладающих
некоторым избытком энергии (энергией
активации). Большая часть поступающей
в систему энергии тратится на ослабление
внутримолекулярных связей, что и
делает молекулы активными. С.
Аррениус
установил опытным путем зависимость:
где k
– константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
(энергия активации, постоянная –
8,31).Графический
расчет энергии активации. По
опытным данным строят график зависимости
|