
37. Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Ненасыщенные растворы с низким содержанием растворимого вещества – разбавленные; с высоким – концентрированные. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³).
Произведение концентраций ионов в насыщенном растворе труднорастворимого электролита при неизменной температуре является постоянной величиной, называемой произведением растворимости ПР
![]() ,
где
,
где
![]() молярные концентрации ионов
молярные концентрации ионов
Зная численное значение ПР, можно вычислить растворимость малорастворимого электролита в системе: раствор – осадок.
При растворении происходит три основных процесса:
разрушение хим. и межмолек. Связей в растворяющихся газах, жидкостях, или твердых телах (в т.ч. и связей в кристаллах), требующие затраты энергии. Энтальпия системы при этом растет:
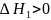 ;
;
хим. Взаимодействие растворителя с растворяющимся вещ-ом, вызванное образованием новых соединений – сольватов (или гидратов) – и сопровождающееся выделением энергии. Энтальпия системы при этом уменьшается:
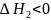 ;
;самопроизвольное перемешивание раствора или равномерное распределение сольватов(гидратов) в растворителе, связанное с диффузией и требующее затраты энергии. Энтальпия системы при этом растет:
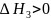
При растворении газов жнтропия уменьшается
При растворении твердых веществ увеличивается
Растворение жидкостей сопровождается также увеличением энтропии
Образование раствора происходит самопроизвольно, энергия Гиббса процесса растворения отрицательна.
38. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
Физические процессы: заключается в разрушении межмолекулярных и межионных химических связей кристаллической решетки, что сопровождается поглощением энергии – эндотермический процесс, а также идет распределение частиц растворенного вещества между молекулами растворителя (диффузия).
Химические процессы: заключается во взаимодействии частиц растворенного вещества с молекулами растворителя, что сопровождается выделением энергии – экзотермический процесс.
Растворимость твердых тел в жидкостях: определяется природой растворителя, растворенного вещества и температурой.
Растворимость – способность вещества образовывать с другими веществами однородные системы.


Растворимость жидкостей в жидкостях: в зависимости от природы жидкости могут смешиваться друг с другом в разных соотношениях:
1) смешиваются друг с другом в любых соотношениях с образованием совершенно однородного раствора. При взаимном растворении жидкостей силы притяжения между молекулами различных жидкостей одинаковы с силами притяжения между молекулами одной и той же жидкости. Для подобных растворов сохраняются общие свойства растворов и выполняются законы Рауля и Вант-Гоффа;
2) обладают ограниченной растворимостью друг в друге. Причем растворимость зависит от природы смешиваемых жидкостей, температуры, концентрации. В зависимости от концентрации могут образовываться три фазы: насыщенный раствор первой жидкости во второй; насыщенный раствор второй жидкости в первой и двухслойная система. Второй вариант наблюдается в том случае, когда силы сцепления между разнородными молекулами значительно меньше сил сцепления между однородными молекулами, т.е. когда положительные отклонения парциальных давлений пара раствора от закона Рауля велики и превосходят некоторую предельную величину;
3) практически не растворимы друг в друге.
Закон распределения Нернста-Шилова: при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями (фазами) является величиной постоянной, независимой от общего количества компонентов:
𝐾рас
=
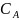 /
/ ,
где Крас – коэффициент распределения
(зависит от природы растворителей и
растворяемого вещества, температуры);
,
где Крас – коэффициент распределения
(зависит от природы растворителей и
растворяемого вещества, температуры);
и – молярные концентрации вещества в жидкостях (фазах) А и В.
39. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
Растворимость газов в жидкостях: газы при соприкосновении с жидкостями способны растворяться в ней. Растворимость газов зависит от их природы, характера жидкости, посторонних примесей, а также от давления и температуры. Растворимость одних и тех же газов в различных растворителях разная. Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных растворителях и, наоборот.
Посторонние электролиты, содержащиеся в воде, как правило, уменьшают растворимость газов; неэлектролиты, склонные к дегидратации, понижают растворимость газов в воде, а не склонные к дегидратации незначительно повышают растворимость газов в воде.
Дегидратация – реакция с отщеплением молекулы воды.
Зависимость растворимость газов от давления выражается Законом Генри: растворимость данного газа в жидкости при постоянной температуре прямо пропорциональна его давлению над жидкостью:
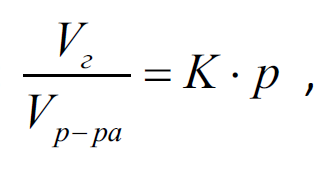
где К -константа Генри, р – общее давление.
З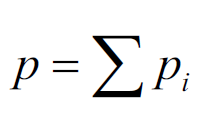 аконом
Генри-Дальтона:
аконом
Генри-Дальтона:
Закон Генри – частный случай закона Дальтона:
Выражение закона Генри-Дальтона.
![]()
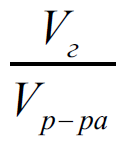

-![]() объемная доля растворенного газа,
которая для идеального равна мольной
доли
объемная доля растворенного газа,
которая для идеального равна мольной
доли ![]() следствие закона Авогадро
следствие закона Авогадро
В![]() реальных предельно разбавленных
растворах для растворителя
реальных предельно разбавленных
растворах для растворителя ![]() выполняется закон Рауля, а для
растворенного жидкого вещества –
закон Генри.
выполняется закон Рауля, а для
растворенного жидкого вещества –
закон Генри.
Закон распределения: растворимое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
Отношение
концентраций – коэффициент Распределения(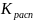 ).
).
40. Законы Рауля.




41. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.



