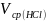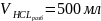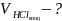лаб3 / LR3_9491
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра Физической химии
отчет
по лабораторной работе №3
по дисциплине «Химия»
Тема: Приготовление раствора электролита заданной концентрации
Студентка гр. 9491 |
|
Ярошук В.А. |
Преподаватель |
|
Завьялова А.Ю. |
Санкт-Петербург
2020
Цель работы: приготовление раствора соляной кислоты, нахождение его точной концентрации, определение общего содержания щёлочи в растворе, выданном преподавателем, и на основании известной концентрации выданного раствора расчёт его объёма.
Основные теоретические положения:
Раствор – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
Электролит – это вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Концентрация – количественное выражение его состава, т.е. содержание образующих раствор компонентов.
Способы выражения концентрации:
Массовая доля – отношение массы вещества к массе раствора. Как правило массовую долю вещества выражают в процентах и рассчитывают по формуле:
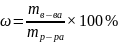 ,
[%]
,
[%]
Молярная концентрация (молярность) – величина, равная отношению количества растворённого вещества (моль) к объёму раствора, выраженному в литрах.
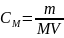 ,
[
,
[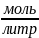 ]
]
М – молекулярная масса растворённого вещества.
Нормальная концентрация (нормальность) – количество эквивалентов данного вещества в 1 литре смеси.
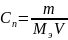 ,
[
,
[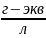 ]
]
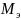 – эквивалентная
масса растворённого вещества.
– эквивалентная
масса растворённого вещества.
Моляльная концентрация (моляльность) – количество растворённого вещества (число моль) в 1000 г растворителя.
 ,
[
,
[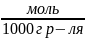 ]
]
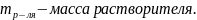
Титр – число граммов растворённого вещества в 1 мл раствора.
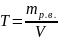 ,
[
,
[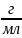 ]
]
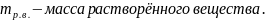
Молярная (мольная) доля – отношение числа молей вещества к сумме чисел молей в растворе
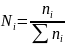 .
.
Протокол наблюдений
B - 23

№ пробы |
|
|
Объём
|
1 |
10 |
|
3,0 |
2 |
10 |
|
3,0 |
3 |
10 |
|
3,0 |
№ пробы |
|
|
Объём
HCl,
пошедший на титрование
|
1 |
10 |
|
5,3 |
2 |
10 |
|
5,3 |
3 |
10 |
|
5,3 |
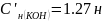
Обработка результатов эксперимента
Расчет объема концентрированного раствора соляной кислоты, необходимого для приготовления 0.1 н раствора соляной кислоты.
Необходимо
приготовить
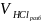 =
500 мл раствора 0,1 н HCl
из концентрированного раствора соляной
кислоты, массовая доля которой
=
500 мл раствора 0,1 н HCl
из концентрированного раствора соляной
кислоты, массовая доля которой
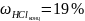 (
(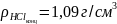 ).
).
Дано:
|
|
Решение:
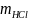 ,
содержащаяся в 100 мл разбавленного
раствора, находится из соотношений:
,
содержащаяся в 100 мл разбавленного
раствора, находится из соотношений:
1000 мл 1 н раствора — Mr(HCl)
1000 мл 1 н раствора — 36,46 г
1000 мл 0,1 н раствора — 3,646 г
500 мл 0,1 н раствора – 1,823 г
19 г HCl — 100 г концентрированного раствора
1,823 г HCl — m г концентрированного раствора
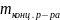 =
=
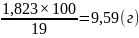
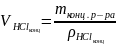 =
=
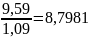 (мл)
(мл)
Ответ: 8,7981 мл
Определение концентрации приготовленного раствора HCl путем титрования раствором Na2CO3.
+
2HCl = 2NaCl +
 +
+
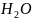
2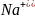 +
+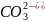 + 2
+ 2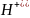 + 2
+ 2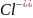 = 2
+ 2
+
+
= 2
+ 2
+
+
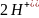 +
+
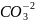 =
+
=
+
При титровании используется метилоранж. В ходе реакции наблюдается переход окраски из розового в оранжево-красный.
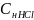 =
=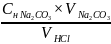 =
=
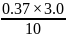 = 0.111 (н)
= 0.111 (н)
Расчет молярной концентрации и титра приготовленного раствора HCl:
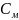 =
=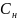 = 0,111 (
= 0,111 (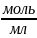 ),
так как
),
так как
 (HCl)
=
(HCl)
=
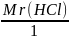 ,
где z=1,
а
=
,
где z=1,
а
= .
.
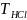 =
=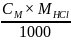 =
=
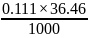 = 0.00405 (г/л)
= 0.00405 (г/л)
Расчёт
молярной концентрации и титра раствора

 =
0.37 (н)
=
0.37 (н)

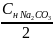 =
=
 = 0.185 (моль/л), z
= 2 так как
= 0.185 (моль/л), z
= 2 так как
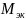 =
=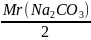
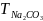 =
=
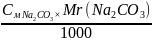 =
=
 = 0.0196 (г/л)
= 0.0196 (г/л)
Определение объема раствора KOH, выданного преподавателем
KOH + HCl = KCl +
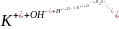

Индикатор – фенолфталеин. Окраска раствора изменяется от малинового до светло-розового цвета.
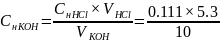 =
0.06 (н)
=
0.06 (н)
Расчет молярной концентрации и титра приготовленного раствора KOH:
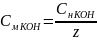 =
=
 = 0.06 (моль/мл), где z
= 1 так как
= 0.06 (моль/мл), где z
= 1 так как
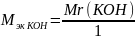
 =
0.003 (г/л)
=
0.003 (г/л)
Определение общего содержания щелочи, выданной преподавателем:
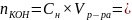 0.06
×
0.25=0,015 (моль)
0.06
×
0.25=0,015 (моль)
Вычисление объема раствора KOH, выданного преподавателем:
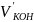 =
=
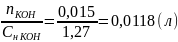
Расчет абсолютной и относительной погрешностей в определении концентрации HCl и объема раствора KOH:
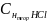 =
0.1 (н)
=
0.1 (н)
Абсолютная
погрешность:
-
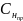 =
|0.1 – 0.111| = 0.011
=
|0.1 – 0.111| = 0.011
Относительная
погрешность:
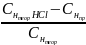 × 100% = 11%
× 100% = 11%
 =
[теоретическое
значение сообщается после предоставления
расчетов Сн HCl, Сн KOH, nKOH и VʹKOH] мл
=
[теоретическое
значение сообщается после предоставления
расчетов Сн HCl, Сн KOH, nKOH и VʹKOH] мл
Абсолютная погрешность:
Относительная погрешность:
Вывод: Для приготовления раствора с заданной концентрацией нужно правильно рассчитать объём концентрированного раствора и точно отмерить полученный объём. В условиях данной лабораторной работы надо внимательно проводить процесс титрования, а также, так как в работе используется сильная кислота и щелочь необходимо соблюдать все меры безопасности.

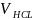 ,
взятый на титрование, мл
,
взятый на титрование, мл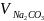 ,
пошедший на титрование, мл
,
пошедший на титрование, мл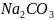 ,
пошедший на титрование
,
пошедший на титрование
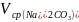
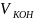 ,
взятый на титрование, мл
,
взятый на титрование, мл ,
пошедший на титрование, мл
,
пошедший на титрование, мл