
лаб2 / lab2_chem
.docxМинобрнауки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина)»
Факультет информационно-измерительных и биотехнических систем
Кафедра физической химии
Лабораторная работа №2
по курсу «Химия»
Определение молярной массы эквивалента металла
Выполнил студент группы № 5502: Кожуховская П.В.
Проверил: _______________
Санкт-Петербург
20
Оглавление
ВВЕДЕНИЕ
Цель работы 2
Теория 2
СОДЕРЖАНИЕ.
Ход работы 5 Расчёты 5 Вывод 6
ВВЕДЕНИЕ.
Цель работы.
Определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл.
Теория
Основными структурными единицами вещества являются атомы, молекулы, ионы, эквиваленты.
Эквивалент – реальная частица (атом, молекула, ион) или условная частица (доля атома, молекулы, иона), равноценная одному иону водорода Н+ в кислотно-основных реакциях или одному электрону ē в окислительно-восстановительных реакциях. Обозначается Э (вещество).
Молярная масса эквивалента вещества – масса 1 моль (6*1022 ) эквивалентов данного вещества. Обозначается Мэк (вещество). Выражается в граммах на моль [г/моль].
Для окислительно-восстановительной реакции, идущей в работе, закон эквивалентов можно записать как:
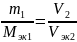
где m1 и Mэк1 - масса и молярная масса вещества 1; V2 и Vэк2 - объем и молярный объем эквивалентов газообразного вещ-ва 2.
Молярная масса эквивалента металла-восстановителя имеет вид:
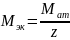
где Мат - молярная масса атомов металла, г/моль; z – число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции.
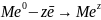
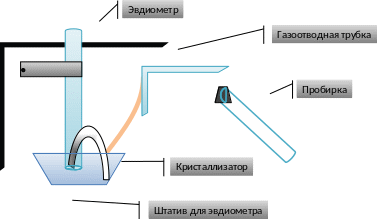
Установка.
СОДЕРЖАНИЕ.
Ход работы.
1. Заполнили кристаллизатор водой (≈ 3\4)
2. Заполнили эвдиометр водой, погрузили в кристаллизатор так, чтобы эвдиометр не касался дна, закрепили в штативе.
3. Закрыли пробирку пробкой с газоотводной трубкой; опустили конец трубки в воду в кристаллизаторе; согрели пробирку руками. Выделились пузырьки => установка герметична.
4. Налили в пробирку 5мл соляной кислоты (HCl)
5. Держа пробирку с кислотой в наклонном положении, поместили навеску металла в папиросной бумаге на сухую стенку пробирки так, чтобы она не касалась кислоты. Закрыли пробирку.
6. Перевели пробирку в вертикальное положение так, чтобы навеска
металла упала в кислоту. Слегка встряхнули пробирку.
7. Началось активное выделение водорода.
Расчёты.
Навеска Металла Г |
Объем выделившегося водорода м3 (л) |
Температура опыта K |
Атмосферное давление опыта |
Парц. Давление H2 Па |
Парц. Давление водяного пара Па |
0,082 |
0,032 |
293 |
760 мм рт. ст. |
98969,9 |
2338,1 |
1. Привести объем выделившегося водорода к н.у.:
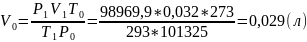
2. Рассчитать молярную массу эквивалента.
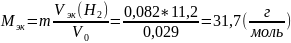
3. Определить молярную массу атомов металла.
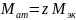
Me0 + 2HCl = Me+2Cl2 +H20
Me0 - 2ē = Me+2
Mат
=
2Mэк
=>
 => Zn
=> Zn
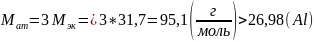
4. Вычислить абсолютную и относительную погрешности.


5. Уравнение окислительно-восстановительной реакции.
Zn0 + 2H+Cl- = Zn+2Cl- 2 + H02
Восстановитель Zn0 - 2ē = Zn+2 окисляется
Окислитель 2H+ + 2ē = H02 восстанавливается
Вывод.
Экспериментальным путём по реакции металла с соляной кислотой была определена молярная масса эквивалента металла. Установлено, что этим металлом является цинк. Произошла окислительно-восстановительная реакция.
