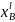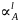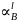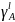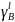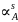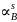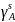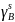- •Обработка результатов.
- •Построение т-х-проекции диаграмм состояния (экспериментальной и теоритически расчитанной) и нахождение параметров взаимодействия и .
- •Исследование влияния знака и абсолютного значения параметров wˢ и wˡ на положение линий ликвидуса и солидуса.
- •Расчет равновесных коэффициентов распределения компонентов а и в при
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра микро- и наноэлектроники
ОТЧЕТ
по лабораторной работе №1
«Моделирование диаграмм состояния полупроводниковых систем с неограниченной растворимостью компонентов в жидкой и твердой фазах»
Функции смешения (+)
Активности + коэффициенты (+)
Gm – доработать (+)
Выводы (+)
Студент гр. 8204 ___________________ Овсянников А. И.
Преподаватель ___________________ Максимов А. И.
Санкт-Петербург
2020
Цель работы.
Изучение фазовых равновесий в бинарных полупроводниковых системах с непрерывным твердым раствором методом компьютерного моделирования; расчет параметров межатомного взаимодействия; выбор моделей растворов, адекватно описывающих экспериментальную T-x-проекцию диаграммы состояния.
Исходные данные.
- T-x-проекция фазовой диаграммы состояния системы А-В;
- Температуры и энтальпии плавления исходных компонентов А и В;
- Программа «Неограниченные растворы», написанная в среде программирования LabVIEW.
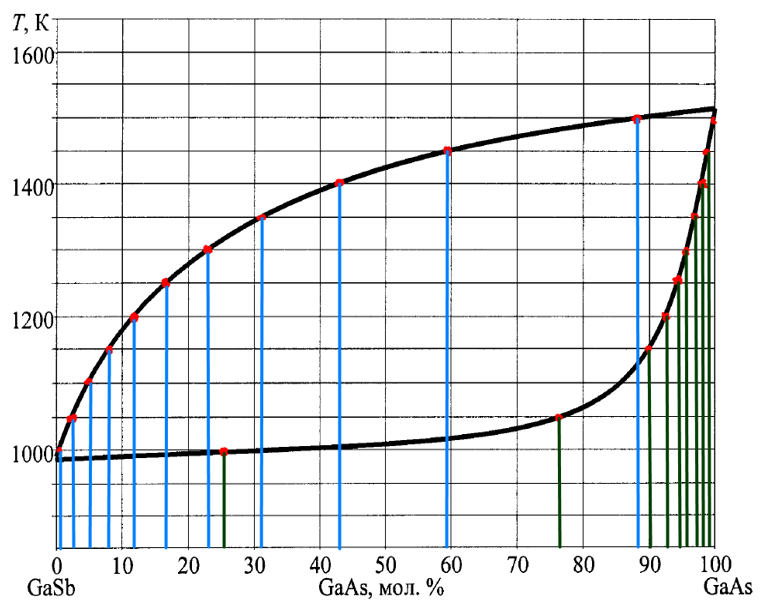
Рис. 1. Т-х-проекция диаграммы состояния системы GaSb – GaAs.
Т, С |
|
|
1000 |
0,02 |
0,03 |
1050 |
0,03 |
0,07 |
1100 |
0,05 |
0,11 |
1150 |
0,08 |
0,17 |
1200 |
0,12 |
0,25 |
1250 |
0,17 |
0,35 |
1300 |
0,25 |
0,49 |
1350 |
0,36 |
0,60 |
1400 |
0,50 |
0,74 |
1450 |
0,68 |
0,98 |
Компонент |
|
|
GaSb |
65,1 |
985 |
GaAs |
105,35 |
1511 |
Рис. 2. Исходные данные для системы А-В.
Обработка результатов.
Построение т-х-проекции диаграмм состояния (экспериментальной и теоритически расчитанной) и нахождение параметров взаимодействия и .
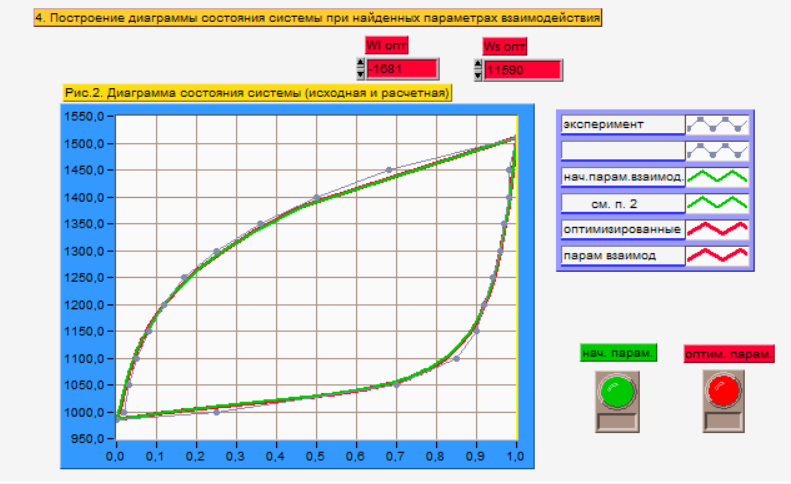 Рис.
3. Экспериментальная Т-х-проекция
диаграммы состояния системы GaSb
– GaAs.
Рис.
3. Экспериментальная Т-х-проекция
диаграммы состояния системы GaSb
– GaAs.
Начальные значения параметра взаимодействия: Wlнач = -1677 Дж, Wsнач = 11434 Дж.
Оптимальные значения параметра взаимодействия: Wlopt = -1681 Дж, Wsopt = 11590 Дж.
Исходя из полученных диаграмм состояния системы (рис. 3), можно сделать вывод, что исходная (теоретическая) диаграмма принадлежит нерегулярному раствору компонентов А-В, так как значения параметров взаимодействия в отдельно взятых точках на линиях ликвидуса и солидуса имеют различные значения. В регулярных растворах параметр взаимодействия не зависит от температуры и рассматривается как константа. Последнее и отражено на расчетной диаграмме состояния, которая строилась исходя из постоянных значений параметров взаимодействия (оптимальных, рис. 3. для линий солидуса и ликвидуса в отдельности.
Исследование влияния знака и абсолютного значения параметров wˢ и wˡ на положение линий ликвидуса и солидуса.
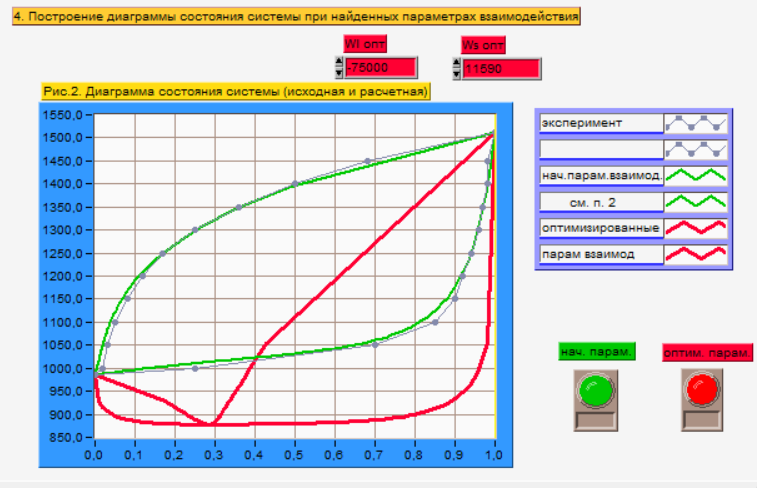
Рис. 4. Экспериментальная
Т-х-проекция диаграммы состояния системы
GaSb-GaAs,
соответствующая значениям
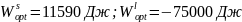 .
.
При изменении абсолютных значений и знака параметров взаимодействия мы можем наблюдать (рис. 4.), как меняется тип диаграммы состояния системы в диаграмму с минимумом (красная) из исходной диаграммы (серая). На диаграмме с минимумом появляется точка, которой соответствует смесь с равенством составов равновесных жидкой и твердой фаз. Подобная точка отсутствует на диаграмме c заданными начальными параметрами взаимодействия.
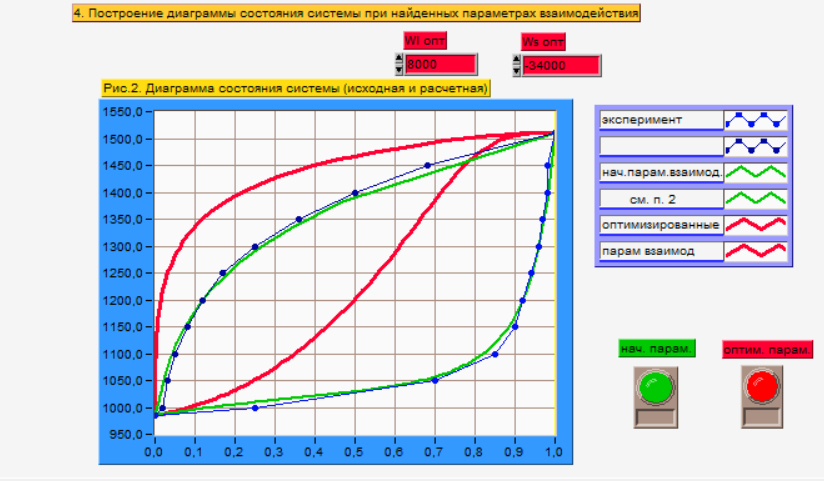
Рис. 5. Экспериментальная
Т-х-проекция диаграммы состояния системы
GaSb-GaAs,
соответствующая значениям
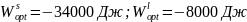 .
.
Расчет и построение концентрационных зависимостей термодинамических функций смешения
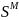 ,
,
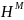 ,
,
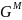 для
твердого и жидкого растворов при Т =
const.
для
твердого и жидкого растворов при Т =
const.
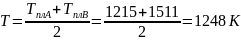
Расчетные формулы:
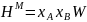
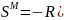
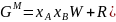
Результаты расчетов сведены в таблицу 1.
Таблица 1. Термодинамические функции смешения.
|
|
|
|
|
|
|
|
||||
0 |
0 |
0 |
0 |
0 |
0 |
0,1 |
2,70 |
1043,1 |
-151,29 |
-2328,3 |
-3522,69 |
0,2 |
4,16 |
1854,4 |
-268,96 |
-3335,2 |
-5458,57 |
0,3 |
5,08 |
2433,9 |
-353,01 |
-3901,3 |
-6688,21 |
0,4 |
5,59 |
2781,6 |
-403,44 |
-4198,1 |
-7383,16 |
0,5 |
5,76 |
2897,5 |
-420,25 |
-4291,1 |
-7608,79 |
0,6 |
5,59 |
2781,6 |
-403,44 |
-4198,1 |
-7383,16 |
0,7 |
5,08 |
2433,9 |
-353,01 |
-3901,3 |
-6688,21 |
0,8 |
4,16 |
1854,4 |
-268,96 |
-3335,2 |
-5458,57 |
0,9 |
2,70 |
1043,1 |
-151,29 |
-2328,3 |
-3522,69 |
1 |
0 |
0 |
0 |
0 |
0 |
Пример
расчёта для
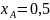 :
:
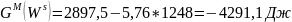
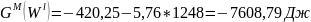

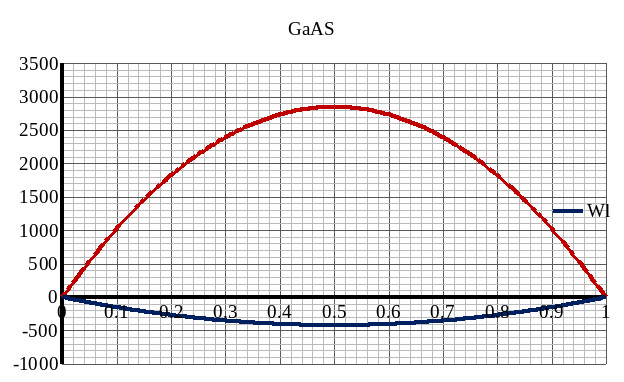
Рис. 6. Концентрационные зависимости для твердого и жидкого растворов.
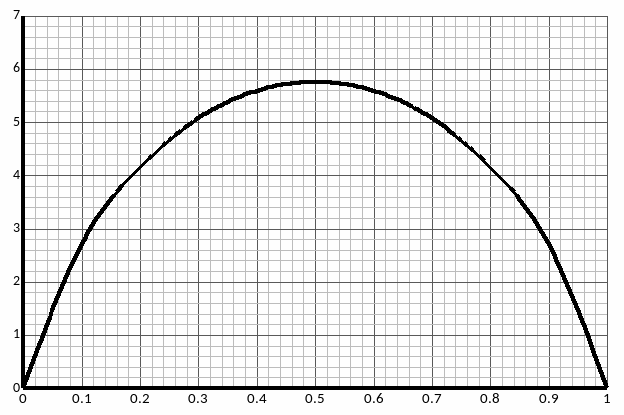
Рис. 7. Концентрационная зависимость .
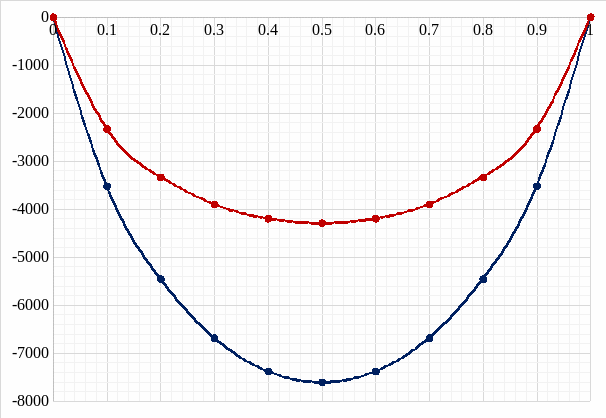
Рис. 8. Концентрационные зависимости для твердого и жидкого растворов.
Расчет мольной свободной энергии Гиббса (T = 1248 К):
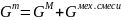 ;
;
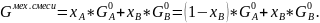
Свободная энергия одного моля чистых компонентов:
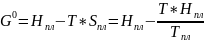 .
.
Для твердого раствора:
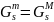 .
.
Для жидкого раствора:
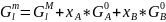 .
.
Пример расчёта
для
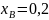
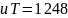 :
:
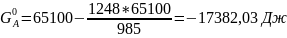 ;
;
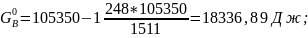
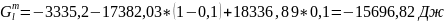 ;
;
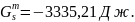
Таблица 2.
xB |
Gмех, Дж |
|
|
0 |
-17382,03 |
0,00 |
-17382,03 |
0,1 |
-13810,14 |
-2328,30 |
-17332,82 |
0,2 |
-10238,25 |
-3335,21 |
-15696,82 |
0,3 |
-6666,35 |
-3901,30 |
-13354,56 |
0,4 |
-3094,46 |
-4198,12 |
-10477,62 |
0,5 |
477,43 |
-4291,05 |
-7131,36 |
0,6 |
4049,33 |
-4198,12 |
-3333,84 |
0,7 |
7621,22 |
-3901,30 |
933,01 |
0,8 |
11193,11 |
-3335,21 |
5734,54 |
0,9 |
14765,00 |
-2328,30 |
11242,32 |
1 |
18336,90 |
0,00 |
18336,90 |
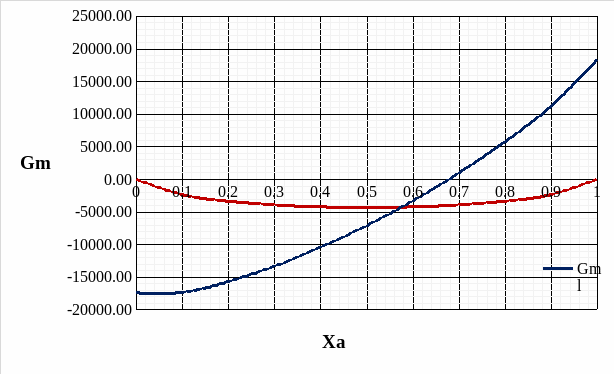
Рис. 9. Концентрационная зависимость мольной свободной энергии Гиббса Gm для твердого и жидкого растворов.
Расчет и построение концентрационных зависимостей термодинамических функций смешения , , для твердого и жидкого растворов при Т = const.
T = 1248 К.
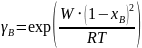 ;
;
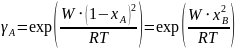 ;
;
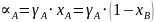 ;
;
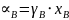 .
.
Для идеального раствора:
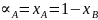 ;
;
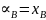 ;
;
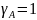 ;
;
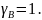
Жидкий раствор:
Таблица 3.
|
|
|
|
|
0 |
1,0000 |
0,0000 |
1,0000 |
0,8504 |
0,1 |
0,8985 |
0,0877 |
0,9984 |
0,8770 |
0,2 |
0,7948 |
0,1803 |
0,9935 |
0,9015 |
0,3 |
0,6899 |
0,2771 |
0,9855 |
0,9236 |
0,4 |
0,5846 |
0,3773 |
0,9744 |
0,9433 |
0,5 |
0,4801 |
0,4801 |
0,9603 |
0,9603 |
0,6 |
0,3773 |
0,5846 |
0,9433 |
0,9744 |
0,7 |
0,2771 |
0,6899 |
0,9236 |
0,9855 |
0,8 |
0,1803 |
0,7948 |
0,9015 |
0,9935 |
0,9 |
0,0877 |
0,8985 |
0,8770 |
0,9984 |
1 |
0,0000 |
1,0000 |
0,8504 |
1,0000 |
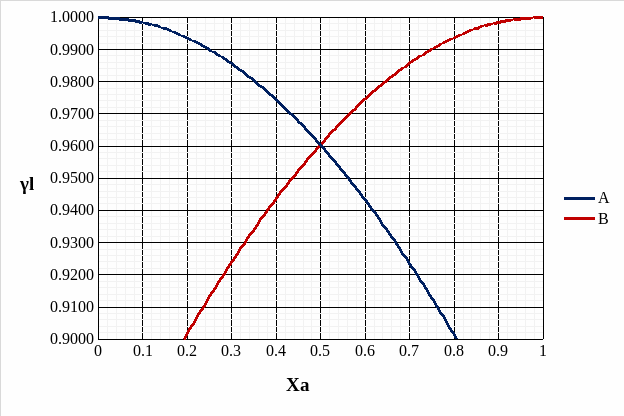
Рис. 10. Концентрационные зависимости коэффициентов активностей компонентов для жидкого и идеального растворов.
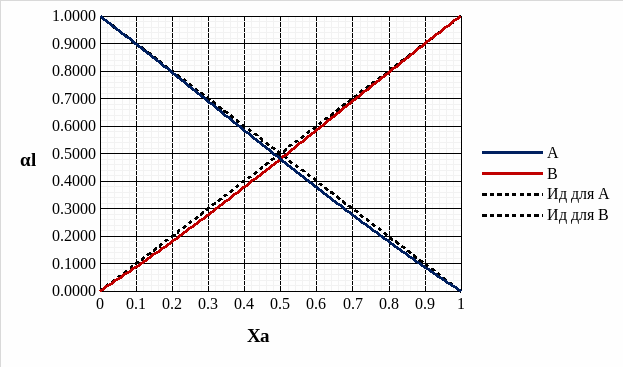
Рис. 11. Концентрационные зависимости активностей компонентов для жидкого и идеального растворов.
Для твердого раствора:
Таблица 4.
|
|
|
|
|
0 |
1,0000 |
0,0000 |
1,0000 |
3,0574 |
0,1 |
0,9101 |
0,2472 |
1,0112 |
2,4725 |
0,2 |
0,8366 |
0,4089 |
1,0457 |
2,0447 |
0,3 |
0,7741 |
0,5187 |
1,1058 |
1,7291 |
0,4 |
0,7175 |
0,5981 |
1,1958 |
1,4953 |
0,5 |
0,6612 |
0,6612 |
1,3223 |
1,3223 |
0,6 |
0,5981 |
0,7175 |
1,4953 |
1,1958 |
0,7 |
0,5187 |
0,7741 |
1,7291 |
1,1058 |
0,8 |
0,4089 |
0,8366 |
2,0447 |
1,0457 |
0,9 |
0,2472 |
0,9101 |
2,4725 |
1,0112 |
1 |
0,0000 |
1,0000 |
3,0574 |
1,0000 |
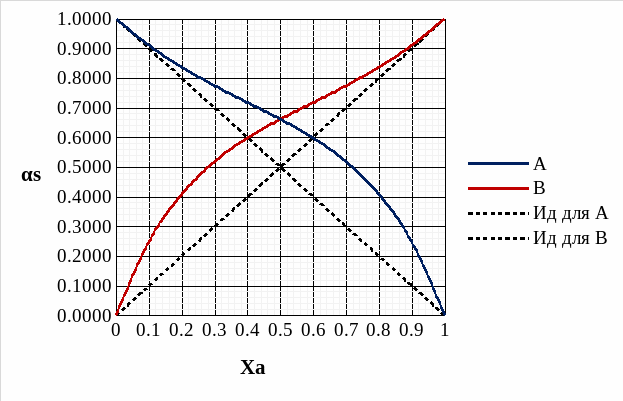
Рис. 12. Концентрационные зависимости активностей компонентов для твердого и идеального растворов.
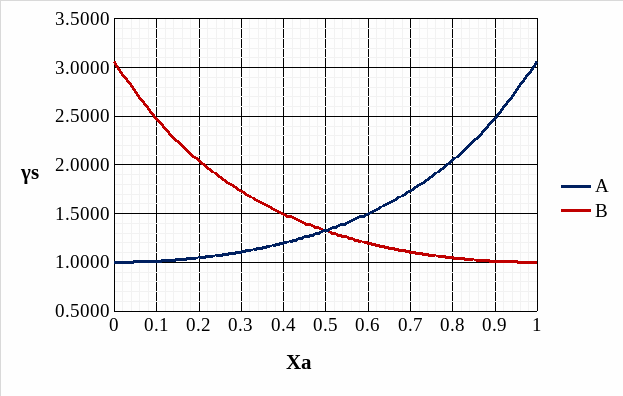
Рис. 13. Концентрационные зависимости коэффициентов активностей компонентов для твердого и идеального растворов.
Расчёт и построение температурной зависимости коэффициента активности компонентов А и В в твёрдом растворе для одного состава ХВ = 0,2.
|
|
A |
B |
1000/T |
T |
ln(γ) |
ln(γ) |
0,7855 |
1273 |
0,043 |
0,69 |
0,7465 |
1339,6 |
0,041 |
0,65 |
0,7111 |
1406,2 |
0,039 |
0,62 |
0,679 |
1472,8 |
0,037 |
0,60 |
0,6496 |
1539,4 |
0,036 |
0,57 |
0,6227 |
1606 |
0,034 |
0,55 |
0,5979 |
1672,6 |
0,033 |
0,52 |
0,575 |
1739,2 |
0,032 |
0,50 |
0,5538 |
1805,8 |
0,030 |
0,49 |
0,5341 |
1872,4 |
0,029 |
0,47 |
0,5157 |
1939 |
0,028 |
0,45 |
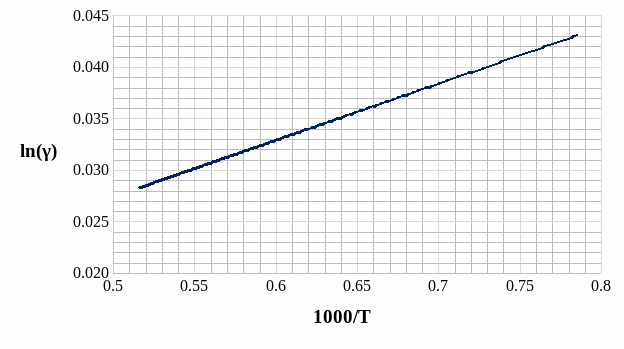
Рис. 14. Температурная зависимость коэффициента активности компонента А в твёрдом растворе для одного состава XB = 0,2.
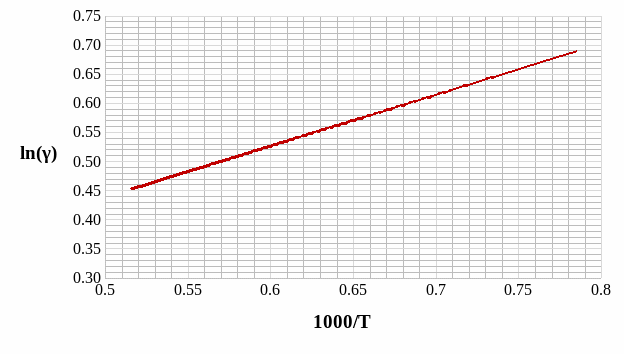
Рис. 15. Температурная зависимость коэффициента активности компонента B в твёрдом растворе для одного состава XB = 0,2.

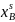
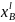
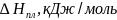
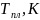
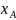
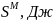 /К
/К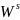
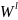
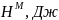
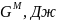
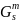 ,
Дж
,
Дж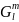 ,
Дж
,
Дж