
Лекции / Kurs_lektsiy_po_patofiziologii_Ch_2_2018
.pdf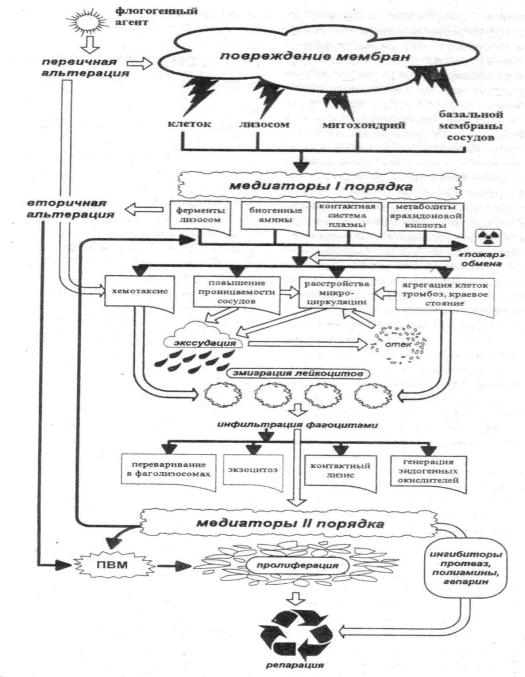
Рис.2. Последовательность событий при развитии острого воспаления (ПВМ – противовоспалительные медиаторы (цит. по: Зайчик А.Ш., Чурилов Л.П., 1999)
1.6.1. Альтерация и изменение обмена веществ в очаге воспаления
Термин «альтерация» означает раздражение и повреждение рецепторов, мембран, внутриклеточных органелл (особенно ядер, лизосом, митохондрий), целых клеток, межклеточного вещества, пери-
49
ферических (особенно терминальных), кровеносных и лимфатических сосудов. Альтерация – первое и непосредственное следствие действия флогогенного и патогенетических факторов. Она включает комплекс обменных, физико-химических, структурных и функциональных изменений в поврежденных и близлежащих тканях. Морфологически она проявляется различными формами и степенями дистрофии, паранекроза, некробиоза, некроза. Альтерация, как правило, становится пусковым звеном патогенеза развития различных патологических процессов, состояний и болезней.
Различают два вида альтерации: первичную и вторичную. Первичная альтерация возникает в ответ на прямое действие
воспалительного (флогогенного) фактора и пролонгирует его патогенное действие. Степень и характер альтерации зависит от интенсивности и качества флогогенного фактора, а также от локализации и площади повреждения, реактивности и резистентности поврежденных структур и организма в целом.
Вторичная альтерация возникает под влиянием различных патогенетических факторов: как местных изменений (физико-химических факторов, количества и активности медиаторов воспаления, сосудистых реакций и др.), так и системных (нервной и гуморальной, в том числе эндокринной и иммунной) реакций.
Соотношение выраженности первичной и вторичной альтерации может быть различным. Это соотношение обусловлено объемом и характером ткани, главным образом количеством вовлеченных в патологический процесс сосудов (кровеносных и лимфатических) и нервных структур. Обычно чем больше первичная альтерация, тем больше и вторичная. Но при чрезмерно выраженной первичной альтерации (глубокий некроз, обугливание, промерзание) вторичная альтерация может быть не большей, а такой же или даже значительно меньшей степени. Наиболее выражены процессы альтерации в паренхиматозных органах, а также в коже и слизистых (при вовлечении их в аллергические реакции). По мере развития воспаления в очаге первичного повреждения и прилегающих к нему участках ткани развиваются нарушения кровообращения, нервной трофики, гипоксия, ацидоз, появляются токсины. Эти изменения – важные патогенетические факторы, вызывающие новую волну альтерации (т.е. вторичную альтерацию).
Взаимосвязь основных процессов (компонентов) в динамике воспаления условно представлена на рис. 3.
50

Рис. 3. Взаимосвязь основных процессов в динамике воспаления:
ФА – флогогенный агент; А-1 – первичная альтерация; А-2 – вторичная альтерация; Э-1 – первичная экссудация; Э-2 – вторичная экссудация; П – пролиферация)
Особое значение в развитии альтерации придают соединительной ткани, состоящей из основного вещества и клеток. Воспаление характеризуется качественным изменением основного вещества, проявляющимся в повышении дисперсности коллоидов и способности их к набуханию. Краситель (например, тушь), в норме проникающий в соединительную ткань только под давлением, при воспалении легко распространяется по поврежденной ткани. Это связано с действием гидролитических ферментов и гиалуронидазы, которые значительно повышают проницаемость соединительной ткани.
Альтерация – пусковой механизм развития различных изменений
вочаге воспаления, развивающихся по типу цепной реакции.
Вответ на первичную и особенно вторичную, альтерацию возни-
кает комплекс разнообразных структурных, физико-химических, обменных и функциональных изменений, как в поврежденных структурах, так и вокруг них.
Комплекс структурных изменений разнообразен, проявляется на различном уровне организации организма и обычно включает деструкцию следующих структур: 1) микрососудов (капилляров, пре- и посткапилляров, сфинктеров, артериол, венул, артериоло-венульных шунтов); 2) соединительной ткани (волокон, межклеточного вещества, клеток), эндотелиоцитов нервных, эпителиальных, тучных кле-
51
ток и клеток крови; 3) протоплазмы, ядер, различных органелл (особенно лизосом, митохондрий, рибосом, эндоплазматического ретикулума); 4) клеточных мембран и мембран органелл; 4) транспортных каналов для ионов Na+, Ka+, Ca+2, Cl– и других; углеводов, липидов, белков, ФАВ и т.д.; 5) пиноцитозных пузырьков (везикул), ответственных за транспорт разных веществ.
Комплекс физико-химических изменений включает следующие, нарастающие в динамике воспалительного процесса, изменения: 1) ацидоз (снижение рН); 2) гиперионию (увеличение количества Na+, K+, Ca+2, Cl–, HPO4– и др.); 3) дисионию (увеличение внеклеточного K+ и внутриклеточного Na+); 4) гиперосмию (увеличение осмотического давления); 5) гиперонкию (увеличение онкотического давления); 6) увеличение дисперсности и гидрофильности белков паренхиматозных, нервных и, особенно, соединительнотканных структур и т.д. Физико-химические изменения в очаге воспаления играют важную роль в увеличении образования и изменения активности медиаторов воспаления.
Комплекс метаболических изменений возникает вследствие как структурных, так и физико-химических изменений ядра и органелл (главным образом, митохондрий и лизосом клеток). Он включает следующие процессы: 1) активацию катаболизма белков, липидов, углеводов и их соединений; 2) торможение анаболических процессов;
3) |
усиление |
аэробного и, особенно, анаэробного гликолиза; |
4) |
усиление |
тканевого дыхания, сменяющегося его снижением; |
5) |
активацию |
процесса окислительного фосфорилирования (сопро- |
вождающегося увеличением синтеза макроэргов), сменяющегося его снижением и разобщением (при этом нарастает дефицит АТФ); 6) усиление процесса теплопродукции, сменяющегося его ослаблением; 7) накопление разнообразных недоокисленных продуктов метаболизма (вследствие повышения содержания лактата, пирувата, кетоновых тел и др.).
Ацидоз и активизация протеаз, липаз, гликозидаз и др. гидролаз способствуют диссоциации органических кислот и слабых оснований (это приводит к увеличению в очаге воспаления осмотического давления). Одновременно наблюдают распад крупных белковых молекул на мелкие, выход белков из крови (в результате увеличения проницаемости стенок сосудов), изменение физико-химических свойств соединительной ткани и т.д. Все это увеличивает не только осмотиче-
52
ское, но и онкотическое давление гидрофильность тканевых структур.
Большинство из перечисленных выше метаболических изменений также способствует активизации образования медиаторов воспаления.
Комплекс функциональных изменений прямо зависит от степени и характера структурных, физико-химических и метаболических рас-
стройств. Он включает разнообразные защитно-компенсаторно- приспособительные и патологические изменения функций как поврежденных, так и неповрежденных структур (клеток и межклеточ-
ного вещества) практически всех (соединительной, эпителиальной, мышечной и нервной) тканей, особенно клеток крови, эндотелиоцитов, тучных и других клеток.
Следует отметить, что центр воспаления – это не центр повреждения (не участок некроза), а периферия поврежденного, но еще живущего и кровоснабжаемого участка ткани.
1.6.2. Расстройства периферического крово- и лимфообращения в очаге воспаления
Наиболее часто в очаге воспаления встречают следующую динамическую последовательность реакций кровеносных сосудов.
1.Спазм артериол, приводящий чаще к временной, иногда – к длительной ишемии (вплоть до прекращения кровотока, т.е. может завершиться ишемическим стазом). Спазм обусловлен увеличением тонуса вазоконстрикторов, имеющего рефлекторный генез. Он приводит к невозможности проникновения повреждающих факторов (микробов, токсинов и др.) в кровоток и распространения с ним по организму.
2.Артериальная гиперемия в динамике воспаления может иметь различный механизм развития: 1) рефлекторный; 2) нейротонический (в основе и того, и другого механизма лежит преобладание тонуса вазодилататоров над вазоконстрикторами); 3) гуморальнометаболический (увеличение образования недоокисленных продуктов
ивазодилататорных ФАВ); 4) нейропаралитический (паралич сосудосуживающих либо и сосудосуживающих, и сосудорасширяющих нервных волокон); 5) миопаралитический (паралич гладких мышц сосудов).
53
3.Венозная гиперемия в динамике воспаления возникает вслед-
ствие несоответствия между притоком и сниженным оттоком крови под влиянием следующих различных механизмов: 1) нарушение структуры вен; 2) паралич нервно-мышечного аппарата вен; 3) сдавление вен образующимся и нарастающим экссудатом, увеличение общей площади сосудистого русла; 4) активация процессов адгезии, агрегации и агглютинации тромбоцитов, лейкоцитов и эритроцитов, особенно в венозных микрососудах; 5) микротромбообразование (на внутренних стенках вен); 6) увеличение проницаемости сосудистой стенки микрососудов (для воды, солей, макро- и микроэлементов, ФАВ, витаминов, углеводов, липидов, белков); 7) сгущение и увеличение вязкости крови и т.д.
На фоне венозного застоя формируется престатическое состояние (сначала толчкообразное, потом маятникообразное движение крови),
азатем – стаз.
4.Венозный стаз завершает венозную гиперемию и характеризуется полной остановкой кровотока в венах.
5.Истинный стаз может развиваться на различных стадиях воспаления.
6.Лимфообразование и лимфоотток в динамике воспаления при артериальной гиперемии временно активизируются, а при венозной гиперемии – снижаются. Эти расстройства становятся максимальными при стазе (как венозном, так и истинном). Давление лимфы может увеличиваться до 120 мм вод.ст. Большое количество лимфатических сосудов закупоривается белками, хиломикронами, клетками и различными обломками тканей, в итоге развивается лимфостаз.
1.6.3. Экссудация в очаге воспаления
Экссудация – процесс выхода воспалительной жидкости (экссу-
дата) из крови в ткани. Если в норме капиллярная стенка удерживает в крови 95 % белков, то при воспалении проницаемость для белков сосудистых стенок (капилляров, прекапиллярных артериол и посткапиллярных венул) возрастает в 3-7 раз и более.
В динамике экссудации сначала увеличивается выход воды, потом – солей, затем – углеводов и, наконец, липидов и белков (альбуминов, глобулинов: α, β и даже γ) и их комплексных соединений.
Экссудат – воспалительная жидкость (основа воспалительного отека), содержащая более 3 % и более белков (главным образом вы-
54
сокомолекулярных), форменные элементы крови (в основном лейкоциты, а также тромбоциты и эритроциты), ферменты и соли.
Транссудат отличается от экссудата меньшим количеством (менее 2 %) и меньшей молекулярной массой белков, а также меньшим содержанием лейкоцитов, тромбоцитов, эритроцитов, ферментов и солей.
Виды экссудата определяются его составом. Различают серозный, фибринозный, геморрагический, гнойный, гнилостный и смешанный экссудаты.
Серозный экссудат содержит более 2-3 % белков, значительное количество различных клеток, рН составляет 6-7 и более, удельный вес – 1,108 и выше.
Фибринозный содержит большое количество белков, особенно фибриногена и фибрина.
Геморрагический – белки и различные клетки крови, особенно эритроциты.
Гнойный – огромное количество белков (до 6-8 %), погибших лейкоцитов (главным образом нейтрофилов) и клеток поврежденных тканей, а также микроорганизмы.
Гнилостный – большое количество белков, погибших клеток тканей и очень много анаэробных гнилостных микроорганизмов.
Смешанный предоставлен разным сочетанием перечисленных выше видов экссудатов.
Взависимости от вида экссудата различают соответствующие виды экссудативного воспаления.
1.6.3.1.Основные патогенетические факторы экссудации
Вобразовании воспалительной жидкости (экссудата) участвуют следующие основные патогенетические факторы.
Тканевой фактор – повышение коллоидно-осмотического давления тканей (т.е. увеличение онкотического и осмотического давления тканей, возникающее в результате распада крупных молекул белков на мелкие, диссоциации органических кислот и слабых оснований, увеличения дисперсности клеточно-тканевых структур, ацидоза, увеличения количества и активности протеаз и других гидролитических ферментов).
Мембранный (сосудистый) фактор – повышение проницаемости мембран микрососудов (обусловленное истончением и повреждением
55
базальной мембраны и клеток эндотелия, увеличением межэндотелиальных щелей и каналов эндотелиоцитов) за счет увеличения количества вазоактивных ФАВ (гистамина, серотонина, кининов, глобулинов проницаемости и др.). Проницаемость стенок микрососудов повышается в результате как пассивного, так и активного транспортирования различных веществ.
Гемодинамический фактор – повышение гидростатического давления сначала в артериальной, а затем в венозной части капилляров. Увеличение фильтрации начинается при артериальной гиперемии и нарастает при венозной.
Следует отметить, что снижение онкотического давления крови в генезе экссудации практического значения не имеет.
1.6.3.2. Основные пути экссудации
Выделяют следующие основные виды транспорта экссудата.
Межэндотелиальный пассивный (в связи с изменением формы и размеров эндотелиоцитов и увеличением межэндотелиальной щели).
Трансцеллюлярный пассивный (в связи с расширением клеточных пор).
Трансцеллюлярный активный (с участием как переносчиков без затраты энергии, так и насосов, работающих с затратой энергии АТФ, АДФ, КРФ).
1.6.3.3. Значение экссудации
Значение экссудации может быть адаптивным и патологическим.
Адаптивное значение экссудации заключается в: 1) разбавлении
(уменьшении концентрации) и ослаблении действия флогогенного агента на организм; 2) удалении из крови метаболитов и токсинов (а значит, снижении их повреждающего действия на организм) в результате исключения их из крово- и лимфообращения; 3) ферментативной и неферментативной нейтрализации микробов, детритов, токсинов вследствие увеличения их адсорбции поврежденными структурами; 4) бактерицидном и бактериостатическом действии ацидоза (кислых продуктов), а также ФАВ экссудата (например, лизоцима, α, β-лизинов, факторов системы комплемента); 5) переносе из крови в очаг воспаления различных иммунных тел (иммуноглобулинов), нейтрализующих соответствующие антитела; 6) транспорте из крови
56
вочаг воспаления медиаторов воспаления, обеспечивающих адаптивные изменения; 7) затруднении кровотока через сосуды, вовлеченные
ввоспалительный процесс (при ишемии, ишемическом стазе, венозной гиперемии, венозном стазе, истинном стазе), а значит, в прекращении распространения по организму токсических веществ, микроорганизмов и т.д.
Важно отметить, что противоотечного эффекта от применения различных противовоспалительных лекарственных средств в первые часы с момента повреждения и развития воспаления часто получить не удается. Это служит подтверждением положительного биологического значения воспалительного отека.
Патологическое значение экссудации определяется: 1) развитием и увеличением зоны вторичной альтерации; 2) сдавлением и смещением клеточно-тканевых структур, а значит, нарушением их функций; 3) попаданием при повреждении стенок сосудов и стенок полых органов из очага воспаления токсинов, продуктов распада тканей, недоокисленных веществ в просвет сосудов и полости тела с дальнейшим их распространением по всему организму; 4) развитием и увеличением флегмоны и т.д.
1.6.4. Эмиграция в очаге воспаления
Эмиграция – процесс выхода лейкоцитов из просветов сосудов в ткани в очаг воспаления. Первыми (в течение 4-6 час) выходят гранулоциты (нейтрофилы, эозинофилы, базофилы), позднее (через 5-12 час) – моноциты, еще позже (через 12-24 час) – лимфоциты. Гранулоциты и моноциты эмигрируют межэндотелиально, лимфоциты – трансцеллюлярно (через эндотелиоциты путем пиноцитоза).
Впроцессе эмиграции лейкоцитов выделяют следующие стадии:
1)краевое стояние (особенно в сосудах, прилегающих к зоне повреждения); 2) адгезия (прилипание лейкоцитов к внутренней поверхности эндотелиоцитов): сначала адгезия слабая (отмечают rolling – роллинг – прокатывание лейкоцитов по поверхности эндотелиоцитов),
затем прочная (лейкоцит не движется); 3) проникновение лейкоцита через стенку микрососуда; 4) направленное движение лейкоцитов в сторону очага воспаления.
Развитию первых двух стадий эмиграции лейкоцитов способ-
ствует образование на внутренней поверхности эндотелиоцитов бахромчатых образований в виде хлопьевидных нитей, сгущение и по-
57
вышение вязкости крови, снижение кровотока в микрососудах, образование и активизация молекул адгезии, селектинов, интегринов и других ФАВ.
Развитие третьей стадии эмиграции лейкоцитов, совершаю-
щейся за 3-6 мин, происходит под влиянием следующих хемоаттрактантов: 1) фактора комплемента С3а, особенно С5а; 2) фактора IV тромбоцитов; 3) метаболитов арахидоновой кислоты; 4) интерферонов и интерлейкинов; 5) интегринов и их взаимодействием с молекулами адгезии; 6) гидролитических ферментов, выделяемых лейкоцитами (коллагеназы, эластазы, гиалуронидазы и др.); 7) острой фазы воспаления; 8) различных иммуноглобулинов и др.
Эмиграции способствует также движение экссудата из сосудов в интерстиций в сторону поврежденных тканей, имеющих более высокое осмотическое и онкотическое давление.
Развитие четвертой стадии эмиграции лейкоцитов (микро-
фагов, макрофагов, лимфоцитов) в очаг повреждения клеточнотканевых структур обеспечивается активным (с затратой энергии) амебоидным движением лейкоцитов.
Эмиграция лейкоцитов в эту стадию осуществляется благодаря переходу гиалоплазмы лейкоцитов из состояния геля в золь, снижению поверхностного натяжения цитолеммы «головного» полюса клеток и сокращению актомиозина «хвостового» полюса лейкоцитов. Процесс эмиграции осуществляется с участием следующих хемоаттрактантов:
1)водородных ионов, избыточно образующихся в поврежденных клеточно-тканевых структурах и формирующих нарастающий ацидоз;
2)продуктов распада клеточно-тканевых структур (усиленно образующихся в результате активизации процессов гидролиза, особенно протеолиза);
3)продуктов жизнедеятельности, особенно распада лейкоцитов (гидролаз, катионных белков и др.);
4)продуктов жизнедеятельности, особенно распада микроорганизмов;
5)продуктов взаимодействия антигенов с антителами;
6)факторов комплемента (С3а, С5а);
7)адениннуклеотидов (главным образом АТФ);
8)гликогена;
9)жирных кислот и др.
58
