
екзамен / Продолжение разрезных шпор 31-59
.docx
 Твердые
вещества могут находиться в аморфном
или кристаллическом состояниях. Вещества
в аморфном состоянии не имеют четкой
структуры, их иногда называют
«переохлажденными жидкостями с аномально
высокой вязкостью».Кристаллические
структуры. Наименьшая
структурная единица – элементарная
ячейка. В зависимости от решеток и углов
между характеристическими осями
различают 7 основных видов (кубическая,
ромбоэдрическая и пр.).Тип кристаллической
системы определяется природой и
размерами частиц, видом химических
связей между ними, температурой и
другими факторами. Многие соединения
могут существовать в двух и более
кристаллических структурах. Это явление
– полиморфизм.
Все кристаллы можно разделить по видам
химической связи.
Стоит отметить, что существуют кристаллы
со смешанными связями.1.
Молекулярная связь. В
узлах кристаллических решеток находятся
молекулы, между которыми действуют
вандервальсовы силы, имеющие невысокую
энергию. Для кристаллов с молекулярными
связями характерны низкие температуры
плавления и высокая сжимаемость.2.
Ковалентная связь. В
узлах кристаллов располагаются атомы,
образующие прочные ковалентные связи.
Это обуславливает высокую энергию
решетки. Кристаллы с ковалентной связью
- диэлектрики или полупроводники.
Типичными примеры: алмаз и кремний.3.
Ионная связь. Структурные
единицы – положительно и отрицательно
заряженные ионы, между которыми
происходит электростатическое
взаимодействие, характеризуемое высокой
энергией. Кристаллы с ионной связью
при низких температурах являются
диэлектриками. При температурах близких
к температуре плавления они становятся
проводниками электричества.4.
Металлическая связь. Специфические
свойства металлов (высокая проводимость,
теплопроводность, ковкость, пластичность,
металлический блеск) можно объяснить
особым типом связи – металлическая.
Во всех узлах кристаллической решётки
расположены положительные ионы металла.
Между ними беспорядочно движутся
валентные электроны, отщепившиеся от
атомов при образовании ионов. Эти
электроны удерживают вместе положительные
ионы, в противном случае решётка
распалась бы под действием сил
отталкивания между ионами. 5.
Смешанная связь. Тот
или иной вид связи встречается редко,
обычно – наложение двух или более
связей.
З-н
постоянства межграневых углов: Кристаллы
одной и тойже модификации данного в-ва
могут иметь различную в-ну,форму и к-во
граней,но углы м/у соответствующ.гранями
остаются постоянными.
Твердые
вещества могут находиться в аморфном
или кристаллическом состояниях. Вещества
в аморфном состоянии не имеют четкой
структуры, их иногда называют
«переохлажденными жидкостями с аномально
высокой вязкостью».Кристаллические
структуры. Наименьшая
структурная единица – элементарная
ячейка. В зависимости от решеток и углов
между характеристическими осями
различают 7 основных видов (кубическая,
ромбоэдрическая и пр.).Тип кристаллической
системы определяется природой и
размерами частиц, видом химических
связей между ними, температурой и
другими факторами. Многие соединения
могут существовать в двух и более
кристаллических структурах. Это явление
– полиморфизм.
Все кристаллы можно разделить по видам
химической связи.
Стоит отметить, что существуют кристаллы
со смешанными связями.1.
Молекулярная связь. В
узлах кристаллических решеток находятся
молекулы, между которыми действуют
вандервальсовы силы, имеющие невысокую
энергию. Для кристаллов с молекулярными
связями характерны низкие температуры
плавления и высокая сжимаемость.2.
Ковалентная связь. В
узлах кристаллов располагаются атомы,
образующие прочные ковалентные связи.
Это обуславливает высокую энергию
решетки. Кристаллы с ковалентной связью
- диэлектрики или полупроводники.
Типичными примеры: алмаз и кремний.3.
Ионная связь. Структурные
единицы – положительно и отрицательно
заряженные ионы, между которыми
происходит электростатическое
взаимодействие, характеризуемое высокой
энергией. Кристаллы с ионной связью
при низких температурах являются
диэлектриками. При температурах близких
к температуре плавления они становятся
проводниками электричества.4.
Металлическая связь. Специфические
свойства металлов (высокая проводимость,
теплопроводность, ковкость, пластичность,
металлический блеск) можно объяснить
особым типом связи – металлическая.
Во всех узлах кристаллической решётки
расположены положительные ионы металла.
Между ними беспорядочно движутся
валентные электроны, отщепившиеся от
атомов при образовании ионов. Эти
электроны удерживают вместе положительные
ионы, в противном случае решётка
распалась бы под действием сил
отталкивания между ионами. 5.
Смешанная связь. Тот
или иной вид связи встречается редко,
обычно – наложение двух или более
связей.
З-н
постоянства межграневых углов: Кристаллы
одной и тойже модификации данного в-ва
могут иметь различную в-ну,форму и к-во
граней,но углы м/у соответствующ.гранями
остаются постоянными.
 55.
Составные
части системы и компоненты. Правило
фаз. Диаграмма воды.
Составные
части системы
– химически индивидуальные вещества,
составляющие данную систему и способные
к самостоятельному существованию. В
равновесной системе
55.
Составные
части системы и компоненты. Правило
фаз. Диаграмма воды.
Составные
части системы
– химически индивидуальные вещества,
составляющие данную систему и способные
к самостоятельному существованию. В
равновесной системе
 имеются 3 составных части. Константа
равновесия:
имеются 3 составных части. Константа
равновесия:
 Если известны парциальные давления
двух участников реакции, система
определена. Независимые компоненты –
индивидуальные вещества, наименьшее
число которых необходимо и достаточно
для образования всех фаз системы. Число
независимых
компонентов
– разница между числом составных частей
и числом связывающих уравнений. В данном
примере: 3-1=2. Степени
свободы –
независимые переменные, которые можно
произвольно менять, не нарушая состояния
системы (числа и характера фаз). Правило
фаз позволяет
определить число фаз в системе при
равновесии и изменение этого числа при
изменении какого-либо параметра.
Если известны парциальные давления
двух участников реакции, система
определена. Независимые компоненты –
индивидуальные вещества, наименьшее
число которых необходимо и достаточно
для образования всех фаз системы. Число
независимых
компонентов
– разница между числом составных частей
и числом связывающих уравнений. В данном
примере: 3-1=2. Степени
свободы –
независимые переменные, которые можно
произвольно менять, не нарушая состояния
системы (числа и характера фаз). Правило
фаз позволяет
определить число фаз в системе при
равновесии и изменение этого числа при
изменении какого-либо параметра.
 С – число степеней свободы, К –
компоненты, Ф – фазы. Если
С – число степеней свободы, К –
компоненты, Ф – фазы. Если
 и
и
 выражение
выражение
 Пример.
Определить кол-во фаз в системе
Пример.
Определить кол-во фаз в системе
 С=К-Ф+2=4-Ф. Максимальное число фаз=минимум
С.
С=К-Ф+2=4-Ф. Максимальное число фаз=минимум
С.
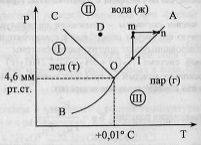
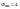 Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.В качестве системы
возьмем воду.
K=1
=> состав как переменная отпадает, и
фактически имеем Р-Т диаграмму.
Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.В качестве системы
возьмем воду.
K=1
=> состав как переменная отпадает, и
фактически имеем Р-Т диаграмму.
 С=К-Ф+2=3-Ф;
максимальное число фаз, находящихся в
равновесии, равно 3. 1 - поле СОВ-область
существования твердой фазы – льда. 2 –
СОА – жидкая фаза –вода. 3 – АОВ –
водяной пар. Если число ст.св.0,то 3 фазы.
Если число ст.0,то 2 фазы. Если число
ст.2,то 1 фаза. Двувариантная сист.-
Одновариант.сист.- ОС-повыш-е давл-я
вызывает пониж-е т-ры,т.к.вызывает обр-е
той фазы,к-ая обладает большей плотностью.
С=К-Ф+2=3-Ф;
максимальное число фаз, находящихся в
равновесии, равно 3. 1 - поле СОВ-область
существования твердой фазы – льда. 2 –
СОА – жидкая фаза –вода. 3 – АОВ –
водяной пар. Если число ст.св.0,то 3 фазы.
Если число ст.0,то 2 фазы. Если число
ст.2,то 1 фаза. Двувариантная сист.-
Одновариант.сист.- ОС-повыш-е давл-я
вызывает пониж-е т-ры,т.к.вызывает обр-е
той фазы,к-ая обладает большей плотностью.
56.
Сущность
термографического анализа. Кривые
нагревания и охлаждения. Т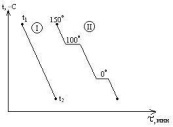 ермографический
анализ –
кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0 o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0 o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления. Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
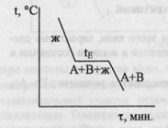
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления. Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения сплава
замедляется, и на кривой наблюдается
перелом. Выпадение кристаллов А
продолжается до тех пор, пока жидкая
фаза не достигнет так называемого
“эвтектического состава”. Основной
особенностью эвтектического сплава
является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при tЕ
(отрезок bc)
в равновесии
находятся жидкая и твердая фазы
одинакового состава. Отрезок
cd
отвечают охлаждению твердого сплава.
Остановки в падении температуры могут
наблюдаться и на кривой охлаждения уже
твердого металла, указываю на переходы
металла из одной аллотропной формы в
другую.
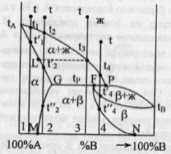
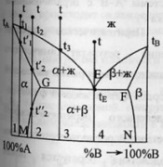
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная взаимная
растворимость компонентов в жидком
состоянии и ограниченная - в твердом.
Если твердые растворы образуют эвтектику,
то точка нонвариантного равновесия Е
лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия FN-снижение
растворимости А в В при понижении t
от tЕ
до
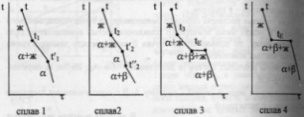
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения сплава
1 имееются
2 перегиба,отвечающих началу и концу
выделения кристаллов тв.р-ра α.На кривой
охлаждения сплава
2 дополнительно
наблюдается слабо выраженный перегиб
при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3: при t3
из жид.фазы выделяются кристаллы тв.р-ра
α,жид.фаза при понижении от t3
до tЕ
меняет
свой состав по линии t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси 2
тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается площадка.
Сплав 4 точно
отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
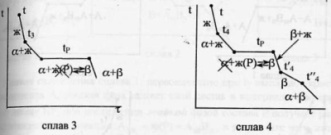
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α и
β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4 при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с выделением
кристаллов тв.р-ра α.
Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Курнаков
сформулировал 2 принципа, устанавливающих
связь геометрических образов диаграммы
с химическим состоянием системы.1.
Принцип непрерывности.При
непрерывном изменении температуры,
давления, концентрации свойства
отдельных фаз системы меняются также
непрерывно. Свойства системы в целом
изменяются непрерывно лишь до тех пор,
пока не изменится число или характер
ее фаз. При появлении новых или
исчезновении имеющихся фаз свойства
системы в целом меняются скачком.2.
Принцип соответствия.Каждой
совокупности фаз, находящихся в
равновесии в данной системе, отвечает
на диаграмме определенный геометрический
образ.В двухкомпонентной системе одной
фазе на диаграмме соответствует участок
плоскости, кристаллизации твердой
фазы- кривая начала кристаллизации,
равновесию между тремя фазами - точка
пересечения кривых, и т.д.
ермографический
анализ –
кривые нагревания или кривые охлаждения
системы. Диаграммы плавкости (частный
вид диагарамм состояния) строят исходя
из кривых охлаждения, которые изображаются
в координатах: температура(Оу), время(Ох).
Рассмотрим кривые
охлаждения
двух систем. Система I
в интервале t1-t2
не испытывает никаких фазовых превращений,
температура меняется монотонно. Кривая
II
отвечают охлаждению воды от 150
o
C
(пар при атмосферном давлении) до 0
o
C
и ниже. При 100
o
C
наблюдается горизонтальный участок,
отвечающий фазовому переходу – процессу
конденсации пара, температура
поддерживается низменной, пока не
исчезнет весь пар. Постоянство температуры
обеспечивается за счёт выделения в
процессе конденсации пара теплоты
испарения воды. От 100
o
C
до 0 o
C
наблюдается монотонный ход кривой
охлаждения – остывает жидкая вода. При
0 o
C
наблюдается второй горизонтальный
участок, отвечающий фазовому переходу
– процессу кристаллизации. Температура
поддерживается постоянной за счет
выделения теплоты плавления. Рассмотрим
кривые
охлаждения
чистого металла (I)
и сплава с так называемой эвтектикой
(II).
На кривой охлаждения (I)
чистого металла А наблюдается одна
площадка bc,
отвечающая процессу кристаллизации
металла. При
tпл
в
равновесии находятся жидкая и твердая
фазы одинакового состава. Образование
твердой фазы сопровождается выделением
теплоты плавления. Кривая II
отвечает охлаждению сплава А-В. От “а”
до “a’
“ температура меняется монотонно,
остывает жидкая фаза. При достижении
точки a’
из жидкой фазы начинают выпадать
кристаллы А – одного из компонентов
сплава, при этом жидкая фаза за счет
этого начнет обогащаться компонентом
В. Таким образом, в интервале a’-b
в равновесии находятся жидкая
и твердая фазы различного состава,
площадки на кривой охлаждения не
наблюдается. За счет выделения при
кристаллизации А теплоты плавления
этого компонента темп охлаждения сплава
замедляется, и на кривой наблюдается
перелом. Выпадение кристаллов А
продолжается до тех пор, пока жидкая
фаза не достигнет так называемого
“эвтектического состава”. Основной
особенностью эвтектического сплава
является то, что он кристаллизуется
подобно чистому компоненту – на кривой
охлаждения наблюдается площадка. Из
жидкой фазы одновременно выпадают
кристаллы А и В и, таким образом при tЕ
(отрезок bc)
в равновесии
находятся жидкая и твердая фазы
одинакового состава. Отрезок
cd
отвечают охлаждению твердого сплава.
Остановки в падении температуры могут
наблюдаться и на кривой охлаждения уже
твердого металла, указываю на переходы
металла из одной аллотропной формы в
другую.
Диаграмма плавкости бинарной системы
с ограниченными твердыми растворами.
Диаграмма состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
данных систем характерны полная взаимная
растворимость компонентов в жидком
состоянии и ограниченная - в твердом.
Если твердые растворы образуют эвтектику,
то точка нонвариантного равновесия Е
лежит ниже t
плавления чистых компонентов,если же
перитектику,то
нонвариантная точка P
лежит между t
плавления чистых компонентов.Пример.
Cu-Ag,Pb-Sn;
Hg-Cd.Рассмотрим
первый случай.Система А-В с
ограничен.тв.р-рами- с эвтектикой.
В системе имеется 2 твердых раствора:
α - р-р компонентов В в А и β- р-р компонента
А в В.Max
растворимость В в А при t
эвтектики tЕ
отвечает точке G,
а при комнат.t
– точке M.
Линия GM
характеризует уменьшение растворимости
В в А по мере понижения t
от эвтектич-й до комнат-й.Линия FN-снижение
растворимости А в В при понижении t
от tЕ
до
комнат-й.Кривые охлаждения 4
сплавов:1,2,3,4.На кривой охлаждения сплава
1 имееются
2 перегиба,отвечающих началу и концу
выделения кристаллов тв.р-ра α.На кривой
охлаждения сплава
2 дополнительно
наблюдается слабо выраженный перегиб
при t”2,отвечающий
частичному распаду в тв.состоянии
кристаллов α с выделением кристаллов
тв.р-ра β. Кривая охлаждения сплава
3: при t3
из жид.фазы выделяются кристаллы тв.р-ра
α,жид.фаза при понижении от t3
до tЕ
меняет
свой состав по линии t3Е,т.е.обогащается
компонентом В.Как только жид.фаза
достигнет состава Е,начинается
кристаллизация эвтектики-мех.смеси 2
тв.фаз-тв.р-ра α состава G
и тв.р-ра β состава F,на
кривой охлаждения наблюдается площадка.
Сплав 4 точно
отвечает эвтектич.составу,кривая
охлаждения его подобна кривой охлаждения
чистого компонента. Система А-В с
ограничен.тв.р-рами- с перитектикой(т.Р).
Перитектическое превращение-результат
химического взаимодействия ранее
выпавшей тв.фазы с жид.фазой определенного
(перитектического) состава.В результате
этого взаимодействия образуется новая
тв.фаза.Кривые охлаждения 4 сплавов-1,2,3,4.
Кривые охлаждения 1 и 2 полностью похожи
на эвтектические.Кривая
охлаждения 3:в
интервале t
от t
до t3
идет охлаждение жид.фазы,и t
изменяется монотонно.При t3
из жид.фазы выпадают кристаллы тв.р-ра
α, на кривой охлаждения-перегиб.В
интервале t3-tP
жид.фаза меняет свой состав по линии
t3Е,а
тв.фаза по линии LG.Как
только жид.фаза достигнет состава
P(перитектического),получает
развитие перитектическая реакция.В
результате этой реакции исчезает
жид.фаза и ниже tP
наблюдается смесь 2 тв.фаз-тв.р-ров α и
β.На кривой охлаждения наблюдается
площадка,т.к. имеет место нонвариантное
превращение:С=К-Ф+1=2-3+1=0.Для сплава
4 при tP
в результате перитектической реакции
исчезает тв.р-ра α.В интервале tP
–t’4
из жид.фазы выпадают кристаллы тв.р-ра
β. От t’4
до t”4
происходит охлпждение тв.фазы β, а при
t”4
тв.р-р β частично распадается-с выделением
кристаллов тв.р-ра α.
Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Курнаков
сформулировал 2 принципа, устанавливающих
связь геометрических образов диаграммы
с химическим состоянием системы.1.
Принцип непрерывности.При
непрерывном изменении температуры,
давления, концентрации свойства
отдельных фаз системы меняются также
непрерывно. Свойства системы в целом
изменяются непрерывно лишь до тех пор,
пока не изменится число или характер
ее фаз. При появлении новых или
исчезновении имеющихся фаз свойства
системы в целом меняются скачком.2.
Принцип соответствия.Каждой
совокупности фаз, находящихся в
равновесии в данной системе, отвечает
на диаграмме определенный геометрический
образ.В двухкомпонентной системе одной
фазе на диаграмме соответствует участок
плоскости, кристаллизации твердой
фазы- кривая начала кристаллизации,
равновесию между тремя фазами - точка
пересечения кривых, и т.д.
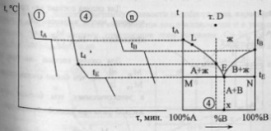
57.Эвтектическая
диаграмма плавкости (без образования
твердых растворов).Диаграмма состояния
системы -
диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.Диаграммы
плавкости
– частный вид диаграмм состояния.Для
систем, дающих диаграмму плавкости
такого типа, характерна
полная взаимная растворимость компонентов
в жидком состоянии и нерастворимость
– в твердом. Пример.
Системы Pb-Ag,
Cd-Bi,
Tl-Au,
KCl-LiCl
и т.д.Чтобы построить диаграмму плавкости
системы А-В, необходимо приготовить
несколько сплавов – от 100% А, через
каждые
![]() - до 100%В.Далее снимаются кривые охлаждения
и характерные точки переносятся на
диаграмму плавкости бинарной системы
А-В. Температуры плавления чистых
компонентов -tА
и tВ.
Температура
начала первичной кристаллизации сплава
4 – t4,
окончание – tE.
Подобным же образом переносят характерные
точки для всех сплавов и соединяют их
на диаграмме плавными линиями, получая
в итоге диаграмму плавкости системы
A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”,
выше нее возможно существование лишь
жидкой фазы.Линия MEN
– “линия солидуса”,
ниже нее – лишь твердая фаза.Между
солидусом и ликвидусом область
сосуществования двух фаз – твердой и
жидкой.Точка Е – точка
эвтектики,
сплав эвтектического состава
кристаллизуется подобно чистому
компоненту, давая кривую охлаждения с
площадкой: для сплавов, имеющих состав
100%А до т. х (состава эвтектики) – так
называемых доэвтектических – под
микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких кристалликов
А и В, выпадающая при достижении жидкой
фазы эвтектического состава – в конце
кристаллизации.В сплавах после точки
х - заэвтектического
состава –
наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А и
В. Правило
фаз в данном
случае записывается как С=К-Ф+1, посколько
при снятии диаграмм плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2,
в точке L
– C=2-2+1=1,
в точке Е – С=2-3+1=0.
- до 100%В.Далее снимаются кривые охлаждения
и характерные точки переносятся на
диаграмму плавкости бинарной системы
А-В. Температуры плавления чистых
компонентов -tА
и tВ.
Температура
начала первичной кристаллизации сплава
4 – t4,
окончание – tE.
Подобным же образом переносят характерные
точки для всех сплавов и соединяют их
на диаграмме плавными линиями, получая
в итоге диаграмму плавкости системы
A-B.Ломанная
линия tАЕtВ
- “линия ликвидуса”,
выше нее возможно существование лишь
жидкой фазы.Линия MEN
– “линия солидуса”,
ниже нее – лишь твердая фаза.Между
солидусом и ликвидусом область
сосуществования двух фаз – твердой и
жидкой.Точка Е – точка
эвтектики,
сплав эвтектического состава
кристаллизуется подобно чистому
компоненту, давая кривую охлаждения с
площадкой: для сплавов, имеющих состав
100%А до т. х (состава эвтектики) – так
называемых доэвтектических – под
микроскопом после затвердевания
наблюдаются сравнительно крупные
кристаллы компонента А, выпадающие
первоначально, и смесь мелких кристалликов
А и В, выпадающая при достижении жидкой
фазы эвтектического состава – в конце
кристаллизации.В сплавах после точки
х - заэвтектического
состава –
наблюдаются крупные кристаллы В и
эвтектическая смесь кристалликов А и
В. Правило
фаз в данном
случае записывается как С=К-Ф+1, посколько
при снятии диаграмм плавкости P=const.
Число степеней свободы: в точке D
– C=2-1+1=2,
в точке L
– C=2-2+1=1,
в точке Е – С=2-3+1=0.
58. Поверхностные явления. Понятие поверхностного натяжения. Поверхностное натяжение –
П![]() оверхностное
натяжение растворов. Изотерма адсорбции.
Поверхностное натяжение
– избыток свободной энергии в
поверхностном слое, отнесенный к
оверхностное
натяжение растворов. Изотерма адсорбции.
Поверхностное натяжение
– избыток свободной энергии в
поверхностном слое, отнесенный к
![]() поверхности поглощающего тела.
поверхности поглощающего тела.
![]() Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const
- изотерма
поверхностного натяжения.
Поверхностное
растяжение растворов зависит от природы
растворителя и растворенного вещества,
от концентрации последнего и от
температуры. Поверхностное натяжение
как функция концентрации растворенного
вещества при Т-const
- изотерма
поверхностного натяжения.
![]() 1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные
вещества (ПИАВ).Разность
с в поверхностном слое – поверхностный
избыток вещества Г (гамма).Для
ПАВ Г>0, для ПИАВ Г<0.Поверхность
твердых тел, как и жидкостей, обладает
избыточной свободной
энергией Гиббса.
Твердые тела не могут (в отличие от
жидкостей) самопроизвольно изменять
площадь поверхности.
1
и 2 – поверхностно-активные вещества
(ПАВ).3 – поверхностно-инактивные
вещества (ПИАВ).Разность
с в поверхностном слое – поверхностный
избыток вещества Г (гамма).Для
ПАВ Г>0, для ПИАВ Г<0.Поверхность
твердых тел, как и жидкостей, обладает
избыточной свободной
энергией Гиббса.
Твердые тела не могут (в отличие от
жидкостей) самопроизвольно изменять
площадь поверхности. 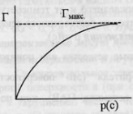 59.
Адсорбция и абсорбция Адсорбция-процесс
изменения концентрации у поверхности
раздела двух фаз, или- это повышение
концентрации одного вещества у
поверхности раздела двух фаз, из которых
одна обычно является твердым
телом.Поглощаемое вещество, ещё наход
в объёме фазы, называют адсорбтив,
поглощённое — адсорбат. под адсорбцией
часто понимают поглощение примеси из
газа или жидкости твёрдым веществом —
адсорбентом. При этом, как и в общем
случае адсорбции, происходит
концентрирование примеси на границе
раздела адсорбент-жидкость либо
адсорбент-газ. Процесс, обратный
адсорбции, то есть перенос вещества с
поверхности раздела фаз в объём фазы,
называется десорбция. Абсорбция-
поглощения сорбата всем объёмом
сорбента. Абсорбция — частный случай
сорбции.Абсорбция, означает поглощение
газов в объёме жидкости или реже твёрдого
тела. Поглощение твёрдым абсорбентом,
например, водорода палладием, называют
окклюзией. Для процесса поглощения
молекул газа или жидкости поверхностью
твёрдого тела используется термин
адсорбция. абсорбции подвергают не
отдельные газы, а газовые смеси, составные
части которых поглощаются жидкостью.
Эти сост части смеси называют
абсорбируемыми компонентами (абсорбат),
а непоглощаемые части — инертным
газом.Абсорбция - впитывание по всему
объему (т.е внутрь) Адсорбция - по
поверхности. Величина адсорбции зависит
от природы адсорбента и адсорбата, от
p, T.Зависимость адсорбируемого количества
газа от давления адсорбата при постоянной
температуре – изотерма адсорбции. С
ростом давления увеличивается количество
адсорбируемого вещества. Лэнгмюр при
выводе уравнения изотермы сделал
следующие допущения: 1. все места
адсорбента одинаковы. 2. взаимодействие
между частицами пренебрежимо мало. 3.
адсорбционный слой состоит из одного
слоя молекул, адсорбция локализованная
– нет перемещения адсорбционного
комплекса вдоль поверхности
адсорбента.Степень заполнения адсорбента
адсорбатом:
59.
Адсорбция и абсорбция Адсорбция-процесс
изменения концентрации у поверхности
раздела двух фаз, или- это повышение
концентрации одного вещества у
поверхности раздела двух фаз, из которых
одна обычно является твердым
телом.Поглощаемое вещество, ещё наход
в объёме фазы, называют адсорбтив,
поглощённое — адсорбат. под адсорбцией
часто понимают поглощение примеси из
газа или жидкости твёрдым веществом —
адсорбентом. При этом, как и в общем
случае адсорбции, происходит
концентрирование примеси на границе
раздела адсорбент-жидкость либо
адсорбент-газ. Процесс, обратный
адсорбции, то есть перенос вещества с
поверхности раздела фаз в объём фазы,
называется десорбция. Абсорбция-
поглощения сорбата всем объёмом
сорбента. Абсорбция — частный случай
сорбции.Абсорбция, означает поглощение
газов в объёме жидкости или реже твёрдого
тела. Поглощение твёрдым абсорбентом,
например, водорода палладием, называют
окклюзией. Для процесса поглощения
молекул газа или жидкости поверхностью
твёрдого тела используется термин
адсорбция. абсорбции подвергают не
отдельные газы, а газовые смеси, составные
части которых поглощаются жидкостью.
Эти сост части смеси называют
абсорбируемыми компонентами (абсорбат),
а непоглощаемые части — инертным
газом.Абсорбция - впитывание по всему
объему (т.е внутрь) Адсорбция - по
поверхности. Величина адсорбции зависит
от природы адсорбента и адсорбата, от
p, T.Зависимость адсорбируемого количества
газа от давления адсорбата при постоянной
температуре – изотерма адсорбции. С
ростом давления увеличивается количество
адсорбируемого вещества. Лэнгмюр при
выводе уравнения изотермы сделал
следующие допущения: 1. все места
адсорбента одинаковы. 2. взаимодействие
между частицами пренебрежимо мало. 3.
адсорбционный слой состоит из одного
слоя молекул, адсорбция локализованная
– нет перемещения адсорбционного
комплекса вдоль поверхности
адсорбента.Степень заполнения адсорбента
адсорбатом:
![]() Скорость
адсорбции:
Скорость
адсорбции:
![]()
![]() константа скорости адсорбции.Скорость
десорбции:
константа скорости адсорбции.Скорость
десорбции:
![]()
![]() константа скорости десорбции.Адсорбционное
равновесие наступает при
константа скорости десорбции.Адсорбционное
равновесие наступает при
![]() Уравнение
изотермы хорошо передает зависимости
в области низких и области высоких
давлений, но не всегда оправдывается
в промежуточной области.Процесс
адсорбции экзотермичен: поглощение
вещества протекает с выделением теплоты,
десорбция – с поглощением теплоты.Если
адсорбируются несколько
газов:
Уравнение
изотермы хорошо передает зависимости
в области низких и области высоких
давлений, но не всегда оправдывается
в промежуточной области.Процесс
адсорбции экзотермичен: поглощение
вещества протекает с выделением теплоты,
десорбция – с поглощением теплоты.Если
адсорбируются несколько
газов:
![]() Для
адсорбции на неоднородной поверхностибыло
предложено эмпирическое уравнение
Фрейндлиха.
Для
адсорбции на неоднородной поверхностибыло
предложено эмпирическое уравнение
Фрейндлиха.![]()
![]() к
и n
– коэффициенты, постоянные для данного
адсорбента и газа при данной
температуре.Уравнение Фрейндлиха,
наоборот, не отражает особенностей
изотермы в области высоких и низких
давлений, но для области промежуточных
давлений согласуются с опытными данными.
к
и n
– коэффициенты, постоянные для данного
адсорбента и газа при данной
температуре.Уравнение Фрейндлиха,
наоборот, не отражает особенностей
изотермы в области высоких и низких
давлений, но для области промежуточных
давлений согласуются с опытными данными.
