
- •3. Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Представление о методе молекулярных орбиталей.
- •14. Полярная связь. Полярность молекул и их дипольный момент.
- •15. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •16. Межмолекулярное взаимодействие. Водородная связь.
- •17. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •18. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •19. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •20. Зависимость теплового эффекта реакции от температуры.
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •22. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Изотерма химической реакции. Стандартное изменение свободной энергии.
- •25. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •26. Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •27. Принцип подвижного равновесия (принцип Ле-Шателье).
- •28. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •29. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •30. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •31. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •32. Скорость гетерогенной химической реакции.
- •33.Иницирование химической реакции. Катализ. Сущность гомогенного и гетерогенного катализа.
- •34.Дисперсные системы. Коллоидные растворы.
- •36. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •37. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •38. Законы Рауля.
- •39.Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40. Константы диссоциации. Закон разведения.
- •41. Сильные электролиты. Понятие активности и коэффициента активности.
- •42. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •43. Гидролиз солей.
- •44. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •45. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •46. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •47. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •48. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •49. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •50. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51. Законы Фарадея. Выход по току.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •55. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •56.Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ. Кривая нагревания и охлаждения.
- •57.Диаграмма плавкости однокомпонентной системы на примере воды.
- •58. Поверхностные явления. Понятие поверхностного натяжения.
- •59. Адсорбция и абсорбция
- •60. Поверхностное натяжение растворов. Изотерма адсорбции.
- •Описание
- •61. Полимеры. Методы получения.
- •62. Материалы, получаемые на основе полимеров
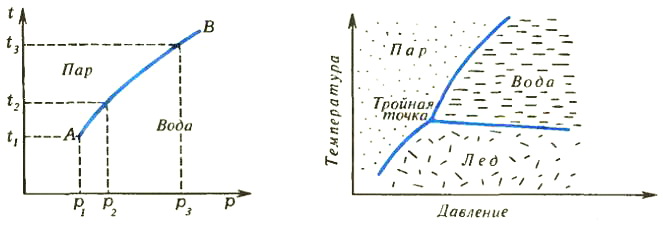
57.Диаграмма плавкости однокомпонентной системы на примере воды.
Начнем изучение фазовых превращений все с той же чистой воды. Для этого заключим ее в герметичный сосуд с поршнем, где ее состоянием легко управлять, меняя внешнее давление на поршень и нагревая или охлаждая сосуд. Важно понять, что никаких других способов воздействовать на фазовое состояние воды в сосуде, его при этом не открывая, у нас нет[1]. Поэтому все «события», связанные с фазовыми превращениями в замкнутом сосуде, должны быть функцией только р и Т.
Обратим внимание на одно обстоятельство: если во внешней среде поддерживается постоянная температура Т, то через некоторое время такая же температура установится во всех фазах системы. Это положение подтверждается нашим каждодневным опытом — при наличии контакта температуры разных тел выравниваются.
То же самое справедливо и в отношении давления, но с одной оговоркой: давление в разных фазах одинаково и равно внешнему, если все поверхности раздела между фазами плоские[2]. Тогда равенство давлений сразу следует из механического равновесия поверхности раздела. Если же поверхности раздела имеют конечный радиус закругления, то приходится принимать во внимание и силы поверхностного натяжения. Однако в дальнейшем мы будем предполагать, что границы фаз всегда плоские. С учетом этих замечаний состояние системы характеризуется общими для всех фаз значениями давления и температуры.
Прежде всего желательно выяснить, при каких внешних условиях происходит фазовое превращение. Для определенности остановимся на испарении воды. Если зафиксировать нормальное атмосферное давление, то вода в нашем сосуде начнет испаряться при 100 °С. При более низких температурах поршень в сосуде будет «лежать» на воде, и пара в системе не будет.
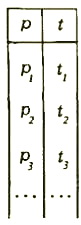
Рис. 1
Изменив давление, мы изменим и температуру начала испарения. Можно свести все данные о фазовом превращении в таблицу из двух колонок: в одной указывать давление, а в другой — температуру начала испарения. Но еще удобнее изобразить данные таблицы графически в виде зависимости температуры от давления (рис. 1). Точно так же можно в виде графиков представить данные и о двух других фазовых превращениях, которые могут происходить в системе,— превращениях вода ⇔ лед и лед ⇔ пар. В результате получим такую диаграмму, как на рисунке 2.
58. Поверхностные явления. Понятие поверхностного натяжения.
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией.
Поверхностное натяжение, стремление вещества (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади поверхности раздела фаз (размерность Дж/м2). Согласно другому определению, поверхностное натяжение – сила, отнесенная к единице длины контура, ограничивающего поверхность раздела фаз (размерность Н/м); эта сила действует тангенциально к поверхности и препятствует ее самопроизвольному увеличению.
Поверхностное натяжение – основная термодинамическая характеристика поверхностного слоя жидкости на границе с газовой фазой или другой жидкостью. Поверхностное натяжение различных жидкостей на границе с собственным паром изменяется в широких пределах: от единиц для сжиженных низкокипящих газов до нескольких тысяч мН/м для расплавленных тугоплавких веществ. Поверхностное натяжение зависит от температуры. Для многих однокомпонентных неассоциированных жидкостей (вода, расплавы солей, жидкие металлы) вдали от критической температуры хорошо выполняется линейная зависимость:
![]()
