- •3. Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Представление о методе молекулярных орбиталей.
- •14. Полярная связь. Полярность молекул и их дипольный момент.
- •15. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •16. Межмолекулярное взаимодействие. Водородная связь.
- •17. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •18. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •19. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •20. Зависимость теплового эффекта реакции от температуры.
- •21. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •22. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •23. Условия самопроизвольного протекания химических реакций.
- •24. Изотерма химической реакции. Стандартное изменение свободной энергии.
- •25. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •26. Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
- •27. Принцип подвижного равновесия (принцип Ле-Шателье).
- •28. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •29. Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
- •30. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •31. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •32. Скорость гетерогенной химической реакции.
- •33.Иницирование химической реакции. Катализ. Сущность гомогенного и гетерогенного катализа.
- •34.Дисперсные системы. Коллоидные растворы.
- •36. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •37. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •38. Законы Рауля.
- •39.Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •40. Константы диссоциации. Закон разведения.
- •41. Сильные электролиты. Понятие активности и коэффициента активности.
- •42. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •43. Гидролиз солей.
- •44. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •45. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •46. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •47. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •48. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •49. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •50. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •51. Законы Фарадея. Выход по току.
- •52. Коррозия металлов. Химическая и электрохимическая коррозия.
- •53. Основные методы борьбы с коррозией.
- •54. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •55. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •56.Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ. Кривая нагревания и охлаждения.
- •57.Диаграмма плавкости однокомпонентной системы на примере воды.
- •58. Поверхностные явления. Понятие поверхностного натяжения.
- •59. Адсорбция и абсорбция
- •60. Поверхностное натяжение растворов. Изотерма адсорбции.
- •Описание
- •61. Полимеры. Методы получения.
- •62. Материалы, получаемые на основе полимеров
1.Основные газовые законы. Определение молекулярных масс газообразных веществ.
Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
Четыре
первых закона вытекают из общего
уравнения Менделеева-Клайперона
![]() .
Необходимо помнить и об уравнении
Ван-дер-Ваальса, описывающем реальные
газы. Закон Авогадро - закон идеальных
газов, согласно которому в равных объемах
различных газов при одинаковой температуре
и давлении содержится одинаковое число
молекул. Закон Бойля-Мариотта - закон
идеальных газов, согласно которому для
данной массы данного газа при постоянной
температуре произведение давления на
объем есть величина постоянная. Закон
Бойля-Мариотта описывает изотермический
процесс. Закон Гей-Люссака - закон
идеальных газов, согласно которому
объем данного количества газа при
постоянном давлении прямо пропорционален
абсолютной температуре. Закон Шарля -
закон идеальных газов, согласно которому
давление данной массы идеального газа
при постоянном объеме прямо пропорционально
абсолютной температуре. Закон Дальтона
- физический закон, согласно которому
давление смеси химически не взаимодействующих
идеальных газов равно сумме парциальных
давлений этих газов. При постоянной
температуре растворимость в данной
жидкости каждого из компонентов газовой
смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
.
Необходимо помнить и об уравнении
Ван-дер-Ваальса, описывающем реальные
газы. Закон Авогадро - закон идеальных
газов, согласно которому в равных объемах
различных газов при одинаковой температуре
и давлении содержится одинаковое число
молекул. Закон Бойля-Мариотта - закон
идеальных газов, согласно которому для
данной массы данного газа при постоянной
температуре произведение давления на
объем есть величина постоянная. Закон
Бойля-Мариотта описывает изотермический
процесс. Закон Гей-Люссака - закон
идеальных газов, согласно которому
объем данного количества газа при
постоянном давлении прямо пропорционален
абсолютной температуре. Закон Шарля -
закон идеальных газов, согласно которому
давление данной массы идеального газа
при постоянном объеме прямо пропорционально
абсолютной температуре. Закон Дальтона
- физический закон, согласно которому
давление смеси химически не взаимодействующих
идеальных газов равно сумме парциальных
давлений этих газов. При постоянной
температуре растворимость в данной
жидкости каждого из компонентов газовой
смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.
2. Основные стехиометрические законы.
1. Закон постоянства состава: в-во имеет постоянный состав независимо от способа его получения:
2H2+O2=2H2O и 4NH3+3O2=6H2O+2N. (состав H2O = const)
2.Закон эквивалентов: в-ва вступают в химическое взаимодействие и замещают друг друга в соединениях в весовых количествах пропорциональным химическим эквивалентам этих веществ.. Хим.эквивалент - это такое весовое кол-во в-ва, которое реагирует с 1.008 вес.част. H2 или 8 в.ч. О2.
3. Закон простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва др. Элемента, которые относятся между собой, как простые целые числа. Например, H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
Если в-во имеет молекулярную структуру (пар\газ\молек.крист.реш.) то все стехиометрические законы полностью выполняются, иначе - нет. Состав соединения зависит от условий получения.
3. Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Эквивалентом называют условную или реальную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в ОВР. Эквивалентная масса элемента (вещества) определяется формулой Э=А/n, где А – масса одного моля элемента (вещества), n – его валентность. Закон химических эквивалентов – моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества.

где М - мольная масса соединений;
4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
О наличии волновых свойств электрона первым высказался французский учёный Л. де Бройль. Уравнение де Бройля: l=h/mV. (выводится из равенства импульсов mv=h/l, было доказано через дифракционные кольца) Если электрон обладает волновыми свойствами, то пучок электронов должен испытывать действие явлений дифракции и интерференции. Волновая природа электронов подтвердилась при наблюдении дифракции электронного пучка в структуре кристаллической решётки. Поскольку электрон обладает волновыми свойствами, положение его внутри объёма атома не определено. Положение электрона в атомном объёме описывается вероятностной функцией, если её изобразить в трёхмерном пространстве, то получим тела вращения.
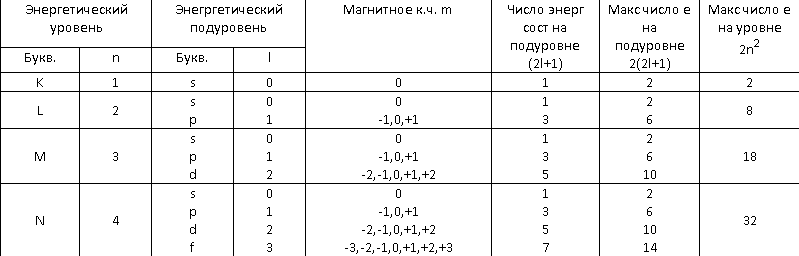
Состояние любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел. n – главное квантовое число, l – побочное, m – магнитное, s – спиновое. Главное к.ч. характеризует собой общий запас энергии системы, если уподобить электрон облаку, то главное к.ч. характеризует собой размеры этого облака. Электроны одного и того же энергетического уровня образуют электронную оболочку. Г.к.ч принимает целочисленные значения от 1 до 7 (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). Электроны одного и того же уровня могут различаться по энергетическому состоянию. Электронные уровни подразделяются на подуровни. Электроны одного и того же подуровня различны по величине момента количества движения mvr (m – масса, v - скорость на орбите, r – радиус орбиты). Электроны различных подуровней имеют различную форму облака. Энергетическое состояние электрона на подуровне характеризуется с помощью побочного к.ч. (l=n-1). Max число подуровней-4 (K – s; L – s, p; M – s, p, d; N – s, p, d, f). m – магнитное к.ч. – ориентация электронного облака в пространстве ( –l,0,+l; summa=2l+1 ). Спиновое к.ч. – характеризует направление вращения электрона. Принимает два значения – _0h/2pi) и –_ов-h/2pi).
5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч. Могут быть попарно параллельны все, кроме хотя бы s. Число электронов на подуровне – 2(2l+1). Максимальное число электронов на уровне – 2n2. Максимальное число электронов на уровне - 32.
Распределение электронов по уровням и подуровням изображается с помощью электронных формул или ячеек.
Ограничение принципе Паули: внешний электронные слой элемента (за исключением эл-та 46 Pd) может состоять только из двух (s и p) подуровней, то есть его максимальная конфигурация s2p6, т.е. 8 электронов.