
б.ф.Л.6 Сокращение
.docx
Лекция 6. БИОФИЗИКА СОКРАЩЕНИЯ
❶. Введение
В основе подвижности и перемещения организмов в пространстве лежат взаимодействия сходных по своей структуре и функции сократительных белков актина и миозина, которые входят в состав мышечных волокон. Мышечная ткань подразделяется на поперечно-полосатую (скелетную и сердечную) мускулатуру и гладкие мышцы. Отличаются мышцы по своей структуре, функциям и эмбриогенезу. Виды мышечного сокращения делят на группы в зависимости от характеристик: изометрическое – при неизменных размерах; изотоническое – при неизменной силе; ауксотоническое – при изменении длины и силы.
❷. Скелетные мышцы. Каждая мышца состоит из пучка мышечных волокон, связанных в единое целое соединительной тканью. Пучок из 20-40 мышечных волокон покрыт рыхлой волокнистой соединительнотканной оболочкой перимизием, под ним располагается базальная мембрана, под которой располагаются ретикулиновые и тонкие коллагеновые волокна. Далее каждое мышечное волокно окружено эндомизием и покрыто двухслойной мембраной - сарколеммой, под корой располагается саркоплазма. В перимизии и эндомизии проходят сосуды и нервы. Мышечное волокно – симпласт – состоит из миофибрилл. Каждая миофибрилла состоит из миофиламентов - нитей актина и миозина. Симпласт является структурно-функциональной единицей скелетной мышцы и представляет собой многоядерную клетку, образовавшуюся из мезодермы слиянием нескольких сотен, а иногда и тысяч клеток. Непосредственно к цитоплазме прилежит плазмалемма – обычная плазматическая мембрана. Основное внутриклеточное пространство мышечного волокна заполнено саркоплазмой с миофибриллами. Их около 2000 и они тянутся вдоль всего мышечного волокна и сформированы в саркомеры.
Саркомер скелетных мышц. Особенностью всех поперечно-полосатых мышц, является поперечная исчерченность внутреннего содержимого цитоплазмы характерными структурами саркомерами. На рисунке 1 представлен симпласт с саркомером
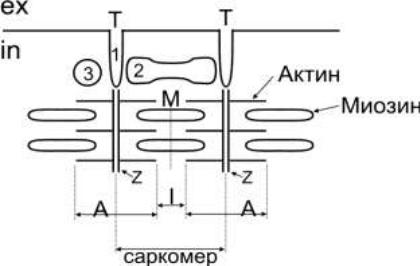
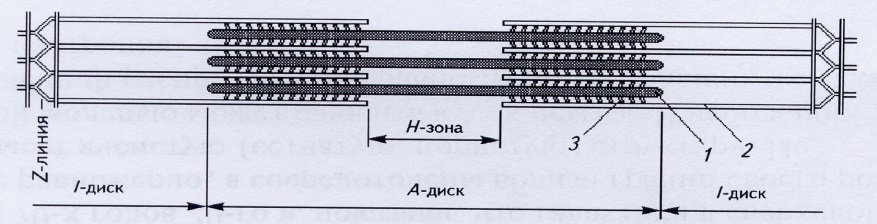
В саркомерах располагаются основные сократительные белки актин и миозин. Строгая их упорядоченность приводит с чередованию оптически более плотных и менее плотных участков. Нити актина симметрично прикрепляются к Z-пластинам саркомера по обе стороны. Между ними в оптически менее плотной (изотропной) зоне I-дисков расположены нити миозина. Посредине каждого I-диска имеется М-полоса – особая мембрана, на которой фиксируются нити миозина. Частично нити актина и миозина перекрываются, образуя оптически более плотную (анизотропную) зону или А-диск. Светлую часть А-диска Н-полосу, содержащую только нити актина, посредине пересекает Z-пластина. Кроме миофибрилл в симпласте имеется большое количество митохондрий и ядер, саркоплазматический ретикулум (хранитель ионов Са2+) и другие органоиды Структура саркомера представлена на рисунке 2.
Триада скелетных мышц представляет собой совокупность структур, обеспечивающих запуск сокращения в ответ на раздражение сарколеммы. Она образована тремя структурами:
1. Т-системой – впячивания плазматической мембраны внутрь мышечного волокна диаметром около 0,03 мкм (Т на рис.1).
2. Концевыми цистернами саркоплазматического ретикулума (2 на рис. 1).
3. Продольными каналами СПР.
Обычно триада располагаются вблизи Z-пластин саркомера.
Структура и функция сократительных белков. Основную сократительную функцию во всех видах мышц осуществляют тонкие и толстые нити-миофиламенты - актин и миозин. Вспомогательную – регуляторную осуществляют тропомиозин и комплекс тропонина, который состоит из субъединиц.
Рис. 3. Структура сократительных белков
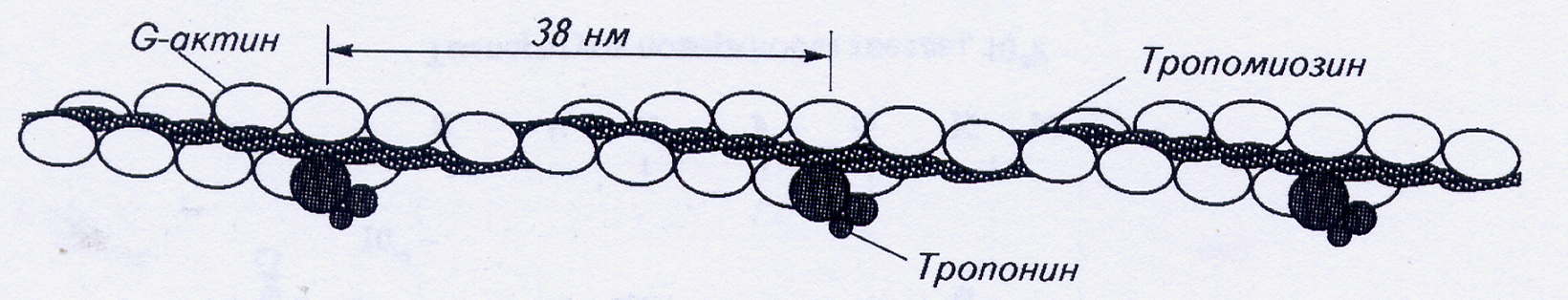
Молекула актина встречается в двух формах: глобулярной (G) и фибриллярной (F). Переход из G- в F-форму происходит в присутствии АТФ и ионов кальция непосредственно перед сокращением. G-форма представляет собой глобулу.
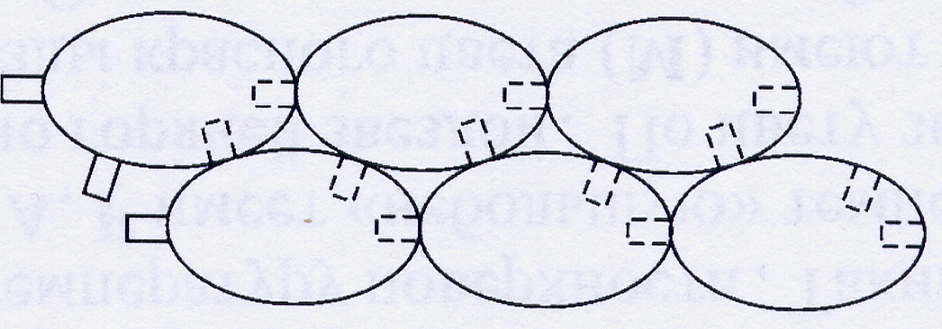
Рис.4. Объединение отдельных глобул G-актина в F-актин
Полимеризованная F-форма собирается на тропомиозине. Тропомиозин представляет собой две нити скрученных в спираль. И в окончательном варианте две таких структуры закручиваются относительно друг друга, образуя суперспираль – миофибриллу актина, непосредственного участника сокращения. В клетках поперечнополосатых мышц в состав тонких нитей входит ещё и белок тропонин. Этот глобулярный белок имеет сложное строение. Он состоит из трех субъединиц, каждая из которых выполняет свою функцию в процессе сокращения.
Молекула миозина состоит из 2-х тяжелых и 4-х легких цепей. Легкие цепи формируют головку молекулы миозина, обладающей способностью к АТФ-азной активности и изменению конформации под воздействием ионов кальция. Толстая миофибрилла содержит около сотни молекул миозина. Структура миозина представлена на рисунке 5.
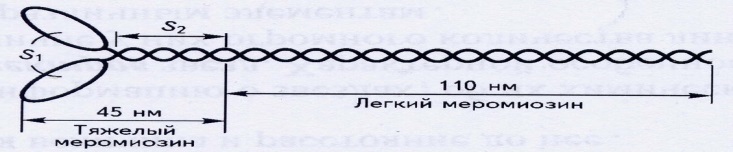
►Молекулярные механизмы мышечного сокращения
Для осуществления сокращения мышечного волокна требуется ряд условий:
1. Развитие потенциала действия на сарколемме.
2. Повышение внутриклеточной концентрации ионов кальция выше 0,1мкМ.
3. Наличие в цитозоле молекул АТФ.
Потенциал действия (ПД) скелетного волокна имеет Na+,K+-ю природу.
►Электрическая и сократительная активность мышечного волокна.
Амплитуда мышечного волокна достигает 120-130 мВ, овершут +30 - +50 мВ, продолжительность 3-5 мс. Особенностью является длительная следовая деполяризация. Ионы кальция пополняются в результате высвобождения из концевых цистерн саркоплазматического ретикулума после развития ПД. Взаимодействие электрических процессов на сарколемме (ПД) и непосредственно сократительных белков осуществляется с помощью процесса электромеханического сопряжения (ЭМС). В настоящее время существует несколько гипотез развития ЭМС:
1. Морфологическая, которая предполагает наличие структур, связывающих Т-систему и саркоплазматический ретикулум.
2. Электрическая, которая предполагает перераспределение электрического поля с Т-системы на саркоплазматический ретикулум.
3. Химическая, которая предполагает, что в процессе развития ПД внутрь волокна выделяется вещество-посредник запуска сокращения. Эта гипотеза называется «теорией скользящих нитей» (Хилл) или «гребковой» теорией. Суть гипотезы: в покоящейся мышце тонкие и толстые нити находятся в разъединенном состоянии. Под воздействием нервного импульса ионы кальция выходят из цистерн саркоплазматической сети и присоединяются к белку тонких нитей – тропонину. Этот белок меняет свою конфигурацию и меняет конфигурацию актина. В результате образуется поперечный мостик между актином тонких нитей и миозином толстых нитей. При этом повышается АТФазная активность миозина. Миозин расщепляет АТФ и за счет выделившейся при этом энергии миозиновая головка подобно шарниру или веслу лодки поворачивается, что приводит к скольжению мышечных нитей навстречу друг другу. Совершив поворот, мостики между нитями разрываются. АТФазная активность миозина резко снижается, прекращается гидролиз АТФ. Однако при дальнейшем поступлении нервного импульса поперечные мостики вновь образуются, так как процесс, описанный выше, повторяется вновь. В каждом цикле сокращения расходуется 1 молекула АТФ.
Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са2+переходит в цистерны саркоплазматического ретикулума, закрываются активные центры актина, прекращается их взаимодействие с миозином. Концентрация Са2+ в области сократительных белков становится ниже пороговой, и мышечные волокна теряют способность образовывать актомиозиновый комплекс. В результате мышца расслабляется, возвращаясь в исходное состояние. При этом тонкие нити извлекаются из пространства между толстыми нитями диска А, зона Н и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние (см.рисунок 2). Мышца становится тоньше и длиннее. Если в клетке отсутствует АТФ, то актомиозиновый комплекс не может разорваться. Нити остаются жестко сцепленными между собой. Это явление наблюдается при трупном окоченении.
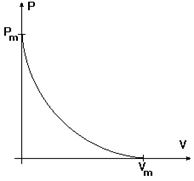
►Биомеханика скелетной мышцы. Согласно основным принципам Хилла мышца состоит из сократительного элемента и упругого элемента. В состоянии покоя и сократительный и упругий элемент растяжимы и не создают напряжения покоя. В состоянии сокращения сократительный элемент укорачивается, в итоге либо развивается напряжение, либо укорочение. Основным параметром биомеханических свойств мышцы является соотношение между скоростью укорочения и нагрузкой. Взаимосвязь между силой и скоростью укорочения описывает уравнение Хилла:
(Р + а)(V + b) = b (Pm + a) = const
Где Р - сила, V - скорость, которые развивает мышца, a, b, Pm - постоянные величины. Из этого равенства следует, что между силой и скоростью существует обратно пропорциональная зависимость. Если скорость V = 0, то P = Pm, т.е. в этом случае мышца развивает максимальную силу, равную Pm. Если сила сокращения равна нулю, скорость достигает максимальной величины Vm = bPm/a. При других значениях сил и скоростей взаимосвязь между ними описывается гиперболической зависимостью приведенной на рисунке 6. Детальное исследование уравнения Хилла позволяет выявить три режима деятельности мышц: изометрический, изотонический и ауксотонический.
Рис.6. Гиперболическая зависимость между силой и скоростью сокращения
❸. Миокард
Миокард по своей структуре более гетерогенен, чем скелетная мускулатура. Кроме клеток рабочего миокарда, которые относятся к поперечно-полосатой мускулатуре, имеются проводящая система, состоящая из атипичных Т-клеток (клетки Пуркинье или клетки водители ритма). Их отличает наличие отростков, кластерная форма, отсутствие вставочных дисков и саркомера.
Структурно-функциональной единицей рабочего миокарда является кардиомиоцит–одноядерная клетка цилиндрической формы. Кардиомиоцит покрыт двухслойной мембраной – сарколеммой. Саркомер кардиомиоцита короче, чем у скелетной мышцы. Но у кардиомиоцита существуют свои особенности:
1. Наличие вставочных дисков, на которых обрывается саркомер, общих для нескольких кардиомиоцитов.
2. Т-система контактирует только с продольными трубочками саркоплазматического ретикулума, образуя диаду.
► Потенциал покоя и потенциал действия кардиомиоцитов. В естественных условиях кардиомиоциты постоянно находятся в состоянии ритмической активности. В период диастолы мембранный потенциал покоя кардиомиоцитов стабилен: - 80,-90 мВ.
Потенциал действия в клетках миокарда возникает под влиянием возбуждения клеток водителей ритма. Это возбуждение вызывает деполяризацию их мембран. Потенциал действия клеток рабочего миокарда состоит из фазы быстрой деполяризации (0 фаза), начальной быстрой реполяризации (1 фаза), переходящей в фазу медленной реполяризации (фаза плато, или 2 фаза), фазы быстрой конечной реполяризации (3 фаза) и фазы покоя - (4фаза).
☻Фаза быстрой деполяризации создается активацией быстрых потенциал зависимых натриевых каналов, что приводит к возникновению быстрого входящего натриевого тока. В результате МП уменьшается от -90 мВ до +30 мВ и быстрые натриевые каналы инактивируются.
☻Сформированная деполяризация мембраны вызывает активацию медленных натрий-кальциевых каналов, по которым ионы Са2+ потоком устремляются внутрь клетки, что приводит к развитию фазы медленной реполяризации ПД (плато или фаза 2). В период плато клетка переходит в состояние абсолютной рефрактерности.
☻Затем происходит активация калиевых каналов. Выходящий из клетки поток ионов К+ обеспечивает быструю конечную реполяризацию мембраны (фаза 3), во время которой медленные натрий-кальциевые каналы закрываются, что ускоряет процесс реполяризации. Реполяризация мембраны вызывает постепенное закрывание калиевых и реактивацию натриевых каналов. В результате возбудимость кардиомиоцита восстанавливается - период относительной рефрактерности. Конечная реполяризация в кардиомиоцитах обусловлена постепенным уменьшением проницаемости мембраны для кальция и повышением проницаемости для калия.
☻В результате входящий ток кальция уменьшается, а выходящий ток калия возрастает, что обеспечивает быстрое восстановление мембранного потенциала покоя (фаза 4). Потенциал действия и сокращение миокарда совпадают во времени.
Роль кальция. Поступление кальция в клетку регулирует силы сокращения миокарда. Удаление кальция приводит к разобщению процессов возбуждения и сокращения миокарда. Потенциалы действия при этом регистрируются, но сокращения миокарда не происходит. Вещества, блокирующие вход кальция во время генерации потенциала действия, вызывают аналогичный эффект. Вещества, угнетающие кальциевый ток, уменьшают длительность фазы плато и потенциала действия и понижают способность миокарда к сокращению. При повышении содержания кальция в межклеточной среде и при введении веществ, увеличивающих вход ионов кальция в клетку, сила сердечных сокращений увеличивается.
Продолжительность фаз: деполяризация - период абсолютной рефрактерности мембраны кардиомиоцита - 0,27 с; длительность ПД миокарда желудочков - 0,3 с; длительность ПД предсердий - 0,1 с. Период относительной рефрактерности, во время которого сердечная мышца может ответить сокращением лишь на очень сильные раздражения продолжается 0,03 с. После периода относительной рефрактерности наступает короткий период супернормальной возбудимости, когда сердечная мышца может отвечать сокращением на подпороговые раздражения.
►Автоматию сердца обеспечивают Т-клетки (клетки Пуркинье) – пейсмекеры, которые подразделяют на истинные и латентные. Они располагаются в синоатриальном узле, атриовентрикулярном узле, пучках Бахмана, Гисса.
►Электрофизиологические параметры клеток-пейсмекеров: 1. плавный переход межимпульсного периода в фазу быстрой деполяризации; 2. нет периода стабилизации фазы 4, т.е. нет как такового ПП; 3. медленная скорость протекания ионного тока в фазу быстрой деполяризации; 4. закругленная вершина; 5. отсутствие плато; 6. отсутствие овершута или он низкий; 7. ПД угнетается блокаторами кальциевых каналов
►Механизмы автоматии основаны на том, что в состоянии покоя сумма входящих и выходящих ионных токов равна. Механизмы автоматии описываются законом хроноинотропии (сила сокращения зависит от частоты стимуляции).
►Особенности биомеханики миокарда заключается в том, что он не способен к тетанусу и обладает большим напряжением покоя. Сокращение зависит от длины мышцы и частоты стимуляции. Скорость сокращения сердечной мышцы меньше, чем скелетной мышцы. В миокарде резко выражена зависимость силы сокращения от длины мышцы.
❹. Гладкая мускулатура.
►Особенности структуры. Гладкая мускулатура представлена практически во всех тканях и органах: сосуды, воздухоносные пути, желудочно-кишечный тракт, мочеполовая система. Основной структурной единицей гладких мышц является гладкомышечная клетка, имеющая обычно удлиненную веретенообразную форму. Гладкомышечные клетки располагаются параллельно и последовательно, образуя мышечные пучки или тяжи, и мышечные слои. Их размеры зависят от вида и функционального состояния гладкой мышцы: 20-500 мкм в длину и 5 – 20 мкм в толщину в средней части клетки. Снаружи гладкомышечная клетка покрыта сарколеммой, состоящей из плазматической и базальной мембраны. Большая часть поверхности одной мышечной клетки отделена от соседних мышечных клеток межклеточным пространством, которое заполнено коллагеновыми и эластиновыми волокнами, фибробластами, капиллярами. Существуют следующие виды взаимодействия гладкомышечных клеток:
Взаимодействие 1. Между контактирующими мембранами соседних клеток имеется щель шириной 2 – 3 нм, которая называется нексусом. В мембранах контактирующих клеток, образующих нексусы, обнаруживаются кластерные образования и внутримембранные частицы размером 9 нм, которые представляют собой межклеточные ионные каналы.
Взаимодействие 2 - десмосомоподобная связь. В областях этой связи имеются участки электронно-плотного вещества. Ширина щели между контактирующими мембранами при этом типе контактов может достигать 20 – 60 нм. Этот вид контактов служит для механического соединения клеток.
Взаимодействие 3 - связь с помощью отростков, которыми одна клетка входит в соответствующее углубление другой. Ширина щели между мембранами соседних клеток в этом случае 10 – 20 нм. Эти связи важны для передачи механической силы между клетками.
►Пассивные электрические свойства гладких мышц. Гладкомышечная ткань является функциональным синцитием, в котором плазматические мембраны многих мышечных клеток представляют собой единую непрерывную мембрану одной большой мышечной клетки. Поэтому, основные показатели гладкомышечных клеток сравнимы с таковыми аксона.
►Потенциал покоя различных гладкомышечных клеток находится в пределах от –50 до –60 мВ. В его образовании участвуют главным образом ионы K+, Na+ и Cl-. Особенностью ионного состава гладкомышечных клеток является большая внутриклеточная концентрация ионов хлора и натрия. Ионы кальция обладают низкой проницаемостью через мембрану этих клеток, но существенно влияют на проницаемость мембраны к другим ионам и, в частности к ионам Na+. Удаление ионов кальция из омывающего раствора сопровождается деполяризацией клеток и существенным уменьшением сопротивления мембраны.
►Потенциал действия гладких мышц позволяет разделить их по способности его генерировать в ответ на пороговую и сверхпороговую стимуляцию:
1. Фазные – быстро сокращающиеся мышцы, способны генерировать ПД, имеют относительно высокую скорость укорочения и часто обладают спонтанной электрической и сократительной активностью. Их ответ на деполяризацию мембраны является относительно быстрым, но носит транзиторный характер. Примером является: гладкомышечные клетки пищеварительного тракта, матки, мочевыводящих путей, воротной вены.
2. Тонические гладкие мышцы не генерируют ПД и спонтанную сократительную активности, имеют низкую скорость укорочения, но могут эффективно поддерживать сокращенное (тоническое) состояние в течение продолжительного времени.
Особенностью электрогенеза гладкомышечных клеток является то, что главную роль в генерации ПД играют ионы Ca2+, которые ответственны за генерацию деполяризующего входящего тока. Ионы калия ответственны за генерацию выходящего гиперполяризующего тока.
Гладкомышечные клетки обладают спонтанной активностью.
►Особенности сократительного аппарата гладкомышечных клеток:
1. Отсутствие Т-системы;
2. Незначительный объем саркоплазматического ретикулума - 2 – 7 % объема цитоплазмы.
Сократительный аппарат гладкомышечных клеток представлен миозиновыми и актиновыми протофибриллами, а так же рядом регуляторных белков: киназой легких цепей миозина, фосфатазой легких цепей миозина, тропомиозином, кальдесмоном, кальпонином. Соотношение актиновых и миозиновых нитей в гладкомышечных клетках больше, чем в скелетных.
Молекула гладкомышечного миозина состоит из двух тяжелых цепей и двух пар легких цепей. Миозин гладкомышечной клетки отличается от миозина скелетных мышц размером, формой, аминокислотным составом, растворимостью, чувствительностью к ферментам, солям и денатурации, низкой АТФ-азной активностью.
Актиновые протофибриллы имеют простую удлиненную форму. В состав актиновых протофибрилл входят актин, тропомиозин и кальдесмон. Из тропомиозина гладкомышечных клеток выделен белок леотонин, который выполняет функции аналогичные тропонину скелетных мышц. Актиновые протофибриллы содержат так же ряд дополнительных модулирующих белков: филамин и винкулин, которые участвуют в прикреплении тонких протофибрилл к плотным тельцам мембраны и в активации актомиозиновой АТФазы. В гладкомышечных клетках, помимо миозиновых и актиновых протофибрилл имеются так называемые промежуточные протофибриллы, которые образуют своеобразную внутриклеточную сеть и связывают между собой плотные тельца плазматической мембраны и миоплазмы.
►Основные пути поступления ионов кальция в гладкомышечную клетку:
☻Кальциевые каналы плазматической мембраны: а) потенциал-зависимые инактивирующиеся кальциевые каналы, ответственные за генерацию потенциалов действия; б) потенциал-зависимые неинактивирующиеся кальциевые каналы, обеспечивающие станционарный ток ионов кальция через деполяризованную мембрану; в) хемочувствительные (рецептор-управляемые) кальциевые каналы, открывающиеся при активации мембранных рецепторов.
☻Немитохондриальное депо: а) саркоплазматических ретикулум; б) примембранные слои; в) внутриклеточные везикулы-кальцисомы.
►Основные пути удаления ионов кальция из гладкомышечных клеток: кальциевые насосы плазматической мембраны и саркоплазматического ретикулума и натрий-кальциевый обмен.
►Молекулярные механизмы сокращения гладкомышечных клеток. Основным акцептором Са2+ в цитоплазме гладкомышечной клетки является кальмодулин. Для развития сокращения гладких мышц требуется одновременная активация миозина (путем его прямого фосфорилирования) и актина (путем устранения ингибирующего действия кальдесмона).
Расслабление гладкомышечной клетки осуществляется дефосфорилированием легких цепей миозина специфичной, кальций-независимой фосфатазой и переход тонких филаментов в неактивное состояние.
►Особенности биомеханики сокращения гладкомышечных клеток. Потребление АТФ гладкомышечными клетками (у теплокровных) животных в сокращенном состоянии почти в 1000 раз меньше чем в скелетных мышцах. Сила, развиваемая гладкой мышцей, определяется следующими факторами: 1. агентом, вызывающим активность; 2. концентрацией этого агента; 3. начальной длиной мышцы.
В отличие от скелетной мышцы, при длине меньшей, чем оптимальная длина гладкая мышца генерирует большую силу, чем скелетная, а при длине большей, чем оптимальная, активная сила гладкой мышцы уменьшается медленнее, чем скелетной.
