
Kurs_lektsiy_po_Biokhimii_-20200516 / 8. Лекция. Перекисное окисление липидов
.pdf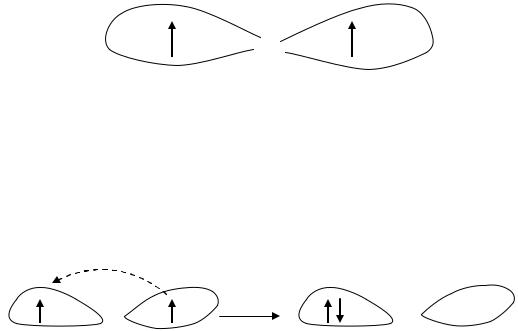
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ (ПОЛ)
ПОЛ – это сложный многоступенчатый процесс, протекающий через образование короткоживущих свободных радикалов.
Свободный радикал – это молекула или её часть, имеющая один неспаренный электрон на внешней атомной или молекулярной орбитали. Свободные радикалы могут быть нейтральными или заряженными (например, ион-радикалы). Свободные радикалы не накапливаются в организме вследствие высокой активности, поэтому их очень тяжело регистрировать.
Химизм ПОЛ: это цепной свободно-радикальный механизм. ПОЛ может начаться лишь в том случае, если в системе появляется свободный радикал. Чаще всего - это активные формы кислорода (АФК).
Участники ПОЛ:
1.Ненасыщенные высшие жирные кислоты, входящие в состав биологических мембран. Чем выше содержание ненасыщенных жирных кислот, тем активнее идёт ПОЛ.
2.Кислород, т.е. его активнее формы.О2.
Триплетный кислород
Молекулярный кислород (О2) в основном (невозбуждённом) состоянии является стабильным бирадикалом. У него на внешних разрыхляющих π- орбиталях содержится по одному неспаренному электрону с параллельными однонаправленными спинами.
О2
Такая электронная конфигурация является причиной чрезвычайно низкой реакционной способности молекулярного кислорода по отношению к стабильным органическим соединениям, имеющим на внешних орбиталях спаренные электроны.
Синглетный кислород (О21)
Изменение спина одного из электронов, находящихся на внешних π- орбиталях в молекуле кислорода приводит к образованию возбуждённого синглетного состояния.
О2 |
О2 |
разрыхляющие орбитали |
идет перескок электрона с одной |
|
орбитали на другую с |
|
изменением направления спина |
Энергия синглетного состояния больше энергии основного триплетного состояния. Синглетный кислород метастабилен. Он очень высоко реакционноспособен, поэтому легко вступает в окислительные реакции с органическими соединениями и принимает участие в инициации ПОЛ.
Механизм образования АФК
Различают неферментативный и ферментативный пути образования АФК.
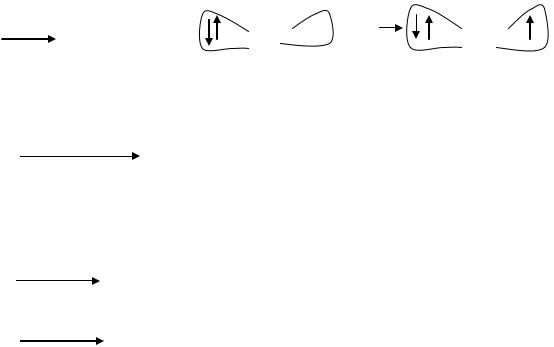
I. Неферментативный путь образования АФК
Синглетный кислород подвергается одноэлектронному восстановлению:
|
Fe2+ |
|
|
|
|
О 1 |
+ ē |
О • ; |
О 1 |
+ ē |
О ● |
2 |
Fe3+ |
2 |
2 |
|
2 |
|
супероксид- |
|
|
|
|
|
|
анионрадикал |
|
|
|
|
Н+ берутся из среды |
|
|
|
|
О2• + Н+ |
НО2• |
|
|
|
|
легко |
перекисный радикал |
|
|
||
протонируется
Затем идёт дальнейшее восстановление НО2˙:
Fe2+
НО2• + ē |
НО2- |
Fe3+ |
перекисный ион |
НО2-+ Н+ |
Н2О2 |
|
Перекись водорода усиливает образование АФК. |
Источником |
электронов являются ионы металлов переменной |
валентности (Fe2+).
Сами по себе эти АФК не опасны, но они могут взаимодействовать между собой с образованием более агрессивной АФК - НО˙, являющейся самым мощным индуктором ПОЛ (например, пероксид водорода повышает интенсивность ПОЛ).
Пути образования НО˙
1. Реакция Фентона:
Fe2+/Fe3+
Н2О2 + ē  НО˙ + НО- (гидроксильный ион) (НО-ОН)
НО˙ + НО- (гидроксильный ион) (НО-ОН)
2. Реакция Хабера-Вейса:
Н2О2 + О2• → НО• + НО- + О21 (НО-ОН)
3. Радиолиз (ионизация) воды:
Н2О радиация |
НО˙ + Н+ + ē |
Протонирование пероксинитрита (ONOO-): в организме человека в условиях достаточного количества аргинина НАДФ-зависимый фермент NO˙-синтаза при участии О2 синтезирует нитроксильный радикал (NO˙):
|
НАДФ |
НАДФ+ |
аргинин |
NO˙-синтаза |
цитруллин |
|
О2 |
NO˙ |
При недостатке аргинина NO˙-синтаза действует как НАДФ-оксидаза и вырабатывает Н2О2. NO˙ взаимодействует с супероксидным анионрадикалом с образованием пероксинитрита:
NO˙ + О2• → ONOO-
ONOO- окисляет железосерные центры белков, тиольные соединения и нитрирует белки по остаткам тирозина. В нейтральной среде ONOO- нестабилен и после протонирования быстро разлагается (период полураспада менее 1 с) с образованием НО˙:
ONOO- + Н+ → НО˙ + NO2- (нитрит-ион).
НО˙ (гидроксильный радикал) – самый активный, самый агрессивный инициатор ПОЛ. Его окислительно-восстановительный потенциал равен +2,33 В, тогда как у кислорода +0,82 В. Время его жизни составляет 10-9 секунд, радиус миграции – 10-9 м. Гидроксильный радикал легко разрывает любую С—Н связь.
II.Ферментативный путь образования АФК
Образование АФК катализируют ферменты, относящиеся к подклассу оксидазы.
1.Ксантиноксидаза (КО) – главный фермент катаболизма пуриновых оснований. Использует в качестве акцептора электронов молекулярный кислород. В активном центре фермента содержатся ионы Mo и Fe3+. Активность фермента наиболее высока в кишечнике и печени. В физиологических условиях КО находится преимущественно в ксантиндегидрогеназной форме (использует в качестве акцептора электронов НАД+), но при закислении среды может переходить в ксандиноксидазную форму путём частичного протеолиза.
|
|
О |
|
|
|
|
патологические условия |
║ |
физиологические условия |
||||
(гипоксия) |
HN |
|
|
N |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
NH |
гипоксантин |
||
|
Н2О, О2 |
НАД+, Н2О |
|||
|
КО ē |
КД |
|
|
|
Н2О2 |
Н+ НО2- ē НО2• Н+ О2• |
НАДН+Н+ |
|||
|
ОН |
|
|
|
|
|
|
|
|
|
|
|
HN |
N |
|
ксантин |
|
|
|
|
|||
|
|
|
|
|
|
НO
N NН
Н2О, О2 НАД+, Н2О
КО КД
Н2О2 НАДН+Н+
HN |
ОН |
N |
|
|
|
|
|
|
|||
|
|
|
|
|
мочевая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
OH |
|
|
N |
NH |
|
||
|
частичный протеолиз |
|
|||
КД |
при закислении среды |
КО |
|||
в присутствии Са2+-зависимых протеиназ

2. L-оксидаза аминокислот – осуществляет прямое окислительное дезаминирование аминокислот. Фермент содержится в почках и печени.
Реакция осуществляется в две стадии: на первой стадии происходит дегидрирование аминокислоты с образованием иминокислоты, на второй стадии происходит спонтанный гидролиз иминокислоты с выделением свободного аммиака и кетокислоты. Кофактором фермента является ФМН. Этот процесс малоактивен, так как оптимум рН для фермента равен 10.
|
|
|
L-оксидаза |
+H2O |
|
R–CH – COOH |
R–C–COOH |
|
R–C–COOH |
||
|
|
|
║ |
|
║ |
|
|
|
|
||
N-H |
ФМН |
ФМНН2 NH |
NH3 |
O |
|
|
|
|
иминокислота |
|
кетокислота |
Н |
|
|
|||
|
|
|
|
||
|
|
Н2О2 |
О2 |
|
|
АФК
3. Моноаминооксидаза (МАО) – катализирует процесс окислительного дезаминирования аминов с образованием альдегидов и выделением аммиака. Кофактором фермента является ФАД.
+H2O, E-MAO
R-CH2-NH2 |
R-C=O |
|
H |
ФАД |
ФАДН2 NH3 (анаэробная стадия) |
Н2О2 О2
4 Миелопероксидаза (МПО) – внутриклеточный фермент фагоцитирующих клеток. Катализирует образование гипогалоидов (активных форм галогенов). Вследствие того, что гипогалоиды содержат в своей структуре атом кислорода, их причисляют к АФК.
МПО хлорноватистая к-та
Н2О2 + Cl- + H+  HOCl + H2O
HOCl + H2O
OCl- H+
гипохлорид-ион вызывает хлорирование амино- и иминогрупп.
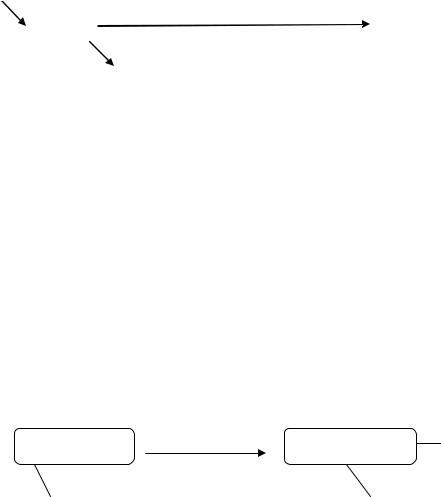
5. НАДФ-оксидаза фагоцитирующих клеток
ПФП
ē, О21, НАДФ-оксидаза фагоцитов
НАДФН2 |
О2• + 2Н+ → Н2О2 → НО• |
НАДФ+
НАДФ-оксидаза активируется при высоких концентрациях О21
6. Митохондриальные оксидазы. НАДН-оксидаза (митохондриальная оксидаза) и убихинон – компонент сукцинатоксидазного участка цепи транспорта электронов – являются системой, продуцирующей О2•. В физиологических условиях около 5% кислорода в дыхательной цепи преобразуется в АФК (супероксидный анион-радикал).
CoQH2 + O2 → CoQH• + H+ + О2•
CoQH• + O2 → CoQ + H+ + О2•
7. Микросомальная монооксигеназа. Катализирует реакцию гидроксилирования в процессе детоксикации ксенобиотиков в печени. Реакция протекает с участием кислорода. 75% кислорода, поглощаемого печенью преобразуется в супероксидный анион-радикал.
-SH |
+ ē |
Е-цит Р-450 |
SH |
Е-цит Р-450 |
|
|
|
Fe2+ - O2 |
|
Fe2+ - O2• |
|
активный тройной комплекс
Этапы ПОЛ
1. Инициация цепи.
Свободные радикалы жирных кислот (ЖК) образуются при отрыве гидроксильным радикалом (НО˙) атома водорода от α-углеродного атома (атом углерода, находящийся рядом с двойной связью). Связь между атомом водорода и α-углеродным атомом ослаблена вследствие смещения электронной плотности в сторону двойной связи, что делает эту связь удобным местом для атаки с наименьшей затратой энергии. Олеиновая, линолевая, линоленовая и арахидоновая кислоты содержат соответственно 2,3,4,5 α-углеродных атомов.
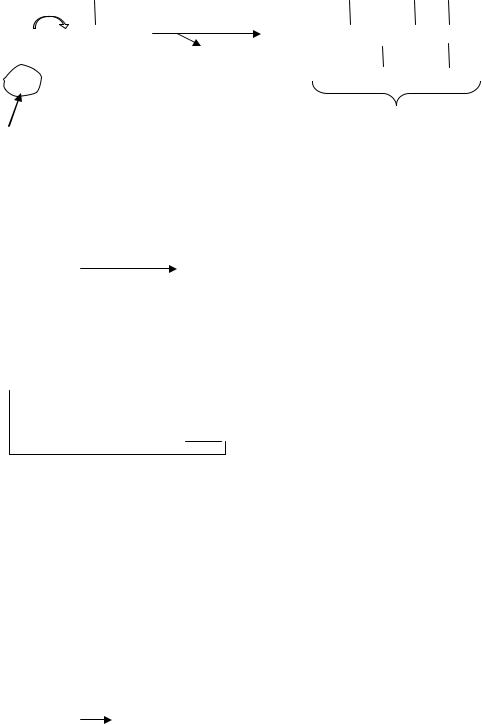
Схема инициации ПОЛ:
СН3–(СН2)3–*СН2–СН=СН–*СН2–СН=СН–*СН2–(СН2)6–СООН
|
|
|
|
линолевая кислота |
|
|
H |
|
H H |
H |
H H |
||
|
|
|
R – C – C = C – C – |
|||
R – C* - C = C – C - |
||||||
|
|
|
|
H2O |
|
|
H |
H |
H |
H |
H |
||
|
|
|
|
|
ацильный радикал жирной кислоты (R•) |
|
HO• |
|
|
|
|
|
|
В |
итоге |
появляется |
ацильный радикал |
жирной кислоты (R˙) с |
||
неспаренной валентностью, которая делокализуется и принадлежит как бы всей системе в целом. Такая система неустойчива и легко окисляется молекулярным кислородом с образованием перекисного радикала жирной кислоты:
R˙ + O2 ROO˙ перекисный радикал жирной кислоты
2. Развитие цепи
Перекисный радикал жирной кислоты действует подобно НО˙ и атакует новую интактную жирную кислоту:
 RO2• + ′RH→ ROOH + ′R• (ацильная форма новой жирной кислоты)
RO2• + ′RH→ ROOH + ′R• (ацильная форма новой жирной кислоты)
гидроперекись жирной кислоты
′R• + O2 → ′RO2•
легко окисляется
Продуктом реакции является гидроперекись ЖК (диеновые коньюгаты или первичный продукт ПОЛ). Реакцией, лимитирующей скорость процесса, является реакция взаимодействия перекисного радикала ЖК с новой окисляющейся молекулой – реакция продолжения цепи. В результате такого взаимодействия свободно-радикальные формы постоянно возобновляются и, в принципе, процесс мог бы идти безостановочно до полного исчерпания субстратов окисления, однако длина цепи не превышает 10 звеньев вследствие рекомбинации свободных радикалов и обрыва цепи.
3. Обрыв цепи (рекомбинация свободных радикалов)
Радикалы взаимодействуют друг с другом в различных комбинациях:
1). R˙ + R˙ R — R нерадикальный димер
2). R˙ + RОО˙  RООR нерадикальный перекисный продукт
RООR нерадикальный перекисный продукт
3). RОО˙ + RОО˙ RООR + О2 + hη энергия, выделяющаяся в виде кванта света – хемилюминесценция (регистрируется с помощью специальных приборов – хемилюминометров
RООR + О2 + hη энергия, выделяющаяся в виде кванта света – хемилюминесценция (регистрируется с помощью специальных приборов – хемилюминометров
Рекомбинация свободных радикалов приводит к обрыву цепи, однако ПОЛ не прекращается.
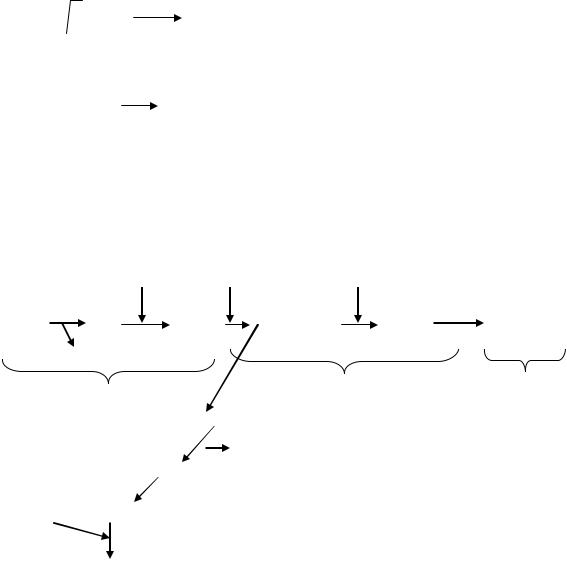
4. Разветвление цепи.
Перекисный продукт неустойчив и легко распадается в присутствие ионов Fe2+
Fe2+
ROOH + ē RO• + HO- (гидроксильный анион)
|
|
|
окисный радикал, |
гидроперекись |
|||
жирной к-ты |
способен вести новые цепи |
||
RO• + *RН |
ROН + *R• |
||
|
|
|
оксикислота, конечный продукт |
*R• + О2  *RO2• перекисный радикал жирной кислоты
*RO2• перекисный радикал жирной кислоты
Процесс идёт безостановочно.
Суммарная схема развития ПОЛ: |
|
|
||
|
O2 |
‘RH |
O2 |
|
|
HO• |
|
RO2 |
|
RH |
R• |
RO2• ROOH + ‘R• ‘RO•2 … |
‘ROOR |
|
|
H2O |
|
|
|
|
I этап |
|
II этап |
III этап |
RO•+ OH-
‘RH  ROH O2
ROH O2  ′′R•
′′R•
′′′RH RO2•
ROOR
