
- •Вопрос 81 Непрямое дезаминирование аминокислот.
- •Вопрос 82 Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •Роль глутамина и аспарагина в обезвреживании аммиака.
- •1. Основная реакция связывания аммиака – синтез глутамина:
- •2. Еще одна реакция обезвреживания аммиака – синтез аспарагина
- •Реакция декарбоксилирования ак
- •4. Путресцинн
- •Функции биогенных аминов:
- •Инактивация биогенных аминов:
- •1. Метилирование с участием sam под действием метилтрансфераз
Вопрос 80
Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминирования. Окислительное дезаминироавние. Оксидазы L-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
Дезаминирование аминокислот –
реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Прямое дезаминирование – отщепление аминогруппы в виде аммиака.
Происходит в 1 стадию с участием одного фермента (подвергаются глу, гис, сер, тре, цис).
Непрямое дезаминирование – дезаминирование в 2 стадии с участием нескольких ферментов. Характерно для многих АК, т.к. не способны к прямому дезаминированию (нет ферментов).
Виды прямого дезаминирования АК:
1. Окислительное (самый активный)
2. Неокислительное
3. Внутримолекулярное
4. Восстановительное
5. Гидролитическое
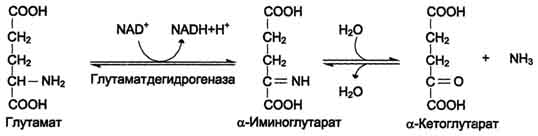
Окислительное дезаминирование – наиболее активно в тканях происходит
дезаминирование глутаминовой кислоты.
Фермент: глутаматдегидрогеназа –олигомер, состоит из 6 субъединиц
Кофермент – NAD+
Активна почти во всех тканях, кроме мышц
Механизм реакции: она протекает в 2 этапа
Ферментативное дегидрирование глутамата и образование α-иминоглутарата.
Неферментативное гидролитическое отщепление иминогруппы в виде NH3
Окислительное дезаминирование глутамата – обратимая реакция и при повышении
концентрации NH3 может протекать как восстановительное аминирование α-КГ
Аллостерические ингибиторы ГДГ- АТФ, Г ТФ, НАДН.
Вызывают диссоциацию фермента и его инактивацию
Аллостерические активаторы ГДГ- АДФ +может индуцироваться кортизолом
Биологический смысл активности ГДГ: сбор аминогрупп распадающихся АК в
составе глутамата с последующим его дезаминированием в митохондриях для протекания процесса синтеза мочевины.
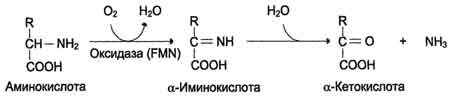
Оксидазы также способны дезаминировать АК, но их вклад незначителен, т.к. оптимум действия лежит в щелочной среде (а для Д-оксидазы просто мало сусбтрата)
L-оксидаза |
D-оксидаза |
действует на L-аминокислоты
|
действует на D -аминокислоты
Способствует превращению D-изомеров в L-изомеры (хотя и Д-изомеров мало в организме) |
Вопрос 81 Непрямое дезаминирование аминокислот.
Схема процесса, субстраты, ферменты, кофакторы.
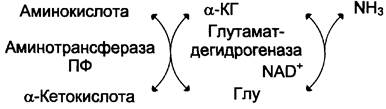
Непрямое дезаминирование – трансдезаминирование, т.е дезаминирование через
переаминирование в 2 стадии с участием нескольких ферментов. Основной способ дезаминирования большинства аминокислот
1 стадия – р. переаминирования с участвием аминотрансфераз – аминогрупаа АК
переходит на кетосоединение (α-КГ, ИМФ).
Фермент – аминотрансфераза
Кофермент – ПФ
2 стадия – р. дезаминирования аминосоединений (глу, АМФ) – образование NH3
Фермент – глутаматдегидрогеназа
Кофермент – NAD+
Биологическая роль непрямого дезаминирования
1. При катаболизме почти все природные аминокислоты сначала передают
аминогруппу на α-кетоглутарат в реакции трансаминирования с образованием глутамата и кетокислоты. Глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы и получаются α-кетоглутарат и аммиак;
2. Обе стадии непрямого дезаминирования протекают в обратном направлении.
В р-те восстановительного аминирования α-кетоглутарата образуется глутамат, который вступает в трансаминирование с α-кетокислотой – синтез новой аминокислоты.
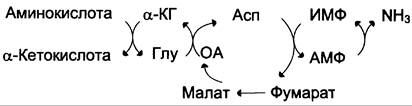
В мышечной ткани и мозге активность ГДГ не очень велика и функционирует
другой путь непрямого дезаминирования участием цикла ИМФ-АМФ
4 стадии процесса:
Трансаминирование с α-кетоглутаратом, образование глутамата;
Трансаминирование глутамата с оксалоацетатом (фермент ACT),
образование аспартата;
Реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
Гидролитическое дезаминирование АМФ.
Вопрос 82 Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
Основные источники аммиака:
Дезаминирование аминокислот
Окислительное дезаминирование биогенных аминов
Гидролитическое дезаминирование АМФ (в мышцах)
Аммиак – токсичное соединение, даже небольшое повышение его конц. вызывает
ухудшение самочувствие, а в тяжелых случаях – кому и летальный исход
Механизм токсического действия аммиака:
Аммиак легко проникает через мембраны клеток и в митохондриях сдвигает
реакцию в сторону образования глутамата (фермент – глутамат-ДГ)
α-кетоглутарат + НАДН2 + NH3 → глутамат + НАД+
Уменьшение концентрации α-КГК вызывает: угнетение обмена аминокислот,
гипоэнергетическиое состояние в результате снижения скорости ЦТК
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону
Высокие концентрации аммиака увеличивают синтез глутамина в нервной ткани.
Глутамат + NH3 + АТФ → Глутамин + АДФ +Н3РО4
↑конц. глутамина приводит к повышению осмот. давления в клетках нейроглии, набуханию астроцитов = отек мозга
↓конц. глутамина нарушает обмен АК и нейромедиаторов,
снижается синтез ГАМК = судороги
Ион NH4+ способен нарушать трансмембранный перенос катионов К+ и Na+, что также влияет на проведение нервных импульсов.
Обезвреживание аммиака:
Из мышц и кишечника избыток аммиака выводится в виде аланина.
Мышцы выделяют много аланина в силу их большей массы и интенсивного метаболизма при физической работе.
Образовавшийся аланин поступает в печень и дезаминируется. Выделившийся аммиак обезвреживается, пируват включается в глюконеогенез с образованием глюкозы (глюкозо-аланиновый цикл).
