
Методы окисления – восстановления.
Окислением называют реакцию, связанную с потерей частицей (атомом, ионом или молекулой) электронов, а восстановлением — приобретение электронов.
Вещество, получающее электроны от окисляющегося вещества, называют окислителем, а отдающее электроны другому веществу, — восстановителем.
Реакции окисления и восстановления взаимно обусловлены, неразрывно связаны между собой и не могут рассматриваться изолированно друг от друга. Именно поэтому их называют реакциями окисления — восстановления (редокс-реакциями).
Реакции окисления — восстановления всегда связаны с переходом (отдачей или присоединением) электронов и сопровождаются изменением (увеличением или уменьшением) степени окисления элементов:
![]()
Окислители. В качестве окислителей в аналитических лабораториях чаще всего применяют: хлорную и бромную воду, H2O2, Na2O2, KClO3, Na2S2O8, HNO3, NaClO, MnO2, NaBiO3, Pb3O4, PbO2, Na2CrO4, K2Cr2O7, KMnO4, KIO3, NaBrO3, царскую водку.
Кроме того, следует иметь в виду, что окислителями также являются ионы Ag+, Hg2+, Fe3+, Cu2+ и некоторые другие.
Мерой окислительной способности данного окислителя (атома или иона) является сродство к электрону, представляющее собой энергию (работу, выражаемую в электрон-вольтах), которая высвобождается при присоединении к нему электрона.
Восстановители. В качестве восстановителей применяет: металлические цинк, железо и алюминий, H2O2, SnCl2, H2S, H2SO3, HI и т. п., восстановителями являются также ионы Fe2+, Ti3+, Cr2+ и др.
Мерой восстановительной способности данного восстановителя (атома или иона) является ионизационный потенциал (потенциал ионизации), численно равный энергии (работе, выражаемой в электрон-вольтах), которую нужно затратить для того, чтобы удалить от него электрон на бесконечно далекое расстояние.
Реакции диспропорционирования (самоокисление — самовосстановление). Одно и то же вещество в зависимости, от условий реакции может быть и окислителем, и восстановителем (H2O2, H2SO3, HNO2, S и др.). Например:
![]()
В реакции (а) азотистая кислота является окислителем, в реакции (б) — восстановителем.
Вещества, проявляющие и окислительные, и восстановительные свойства, способны к реакциям самоокисления — самовосстановления. Такие реакции называют реакциями диспропорционирования. К реакциям диспропорционирования способны многие соединения.
Рассмотрим подробно окислительно-восстановительные свойства перекиси водорода, широко применяемой в аналитической практике.
Перекись водорода в силу специфического характера строения ее молекул
Н—О—О—Н (H2+[O2]2- проявляет себя и как окислитель, и как восстановитель:

В реакциях с восстановителями она играет роль окислителя; а) в кислой среде

Под действием сильных окислителей она проявляет восстановительные свойства:
б) в кислой среде

Перекись водорода может проявлять восстановительные свойства не только в кислой (см. выше), но и в нейтральной, и в щелочной средах:

Известны также реакции, протекающие как в кислой, так щелочной и нейтральной средах, в которых перекись водорода является окислителем. Например: а) в кислой среде:

б) в нейтральной среде

в) в щелочной среде

Но, кроме того, известны такие реакции, в которых перекись водорода при сравнительно незначительном изменении pH среды играет роль то окислителя, например:
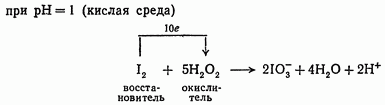
то восстановителя, например:

Вследствие двойственности окислительно-восстановительного характера перекиси водорода, она склонна вступать в реакции диспропорционирования:
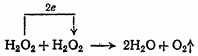
Окислительно-восстановительные свойства металлов, неметаллов и образуемых ими ионов.
Металлы являются восстановителями. Теряя свои электроны, атомы металлов превращаются в электроположительные ионы. Например:
![]()
Ионы металлов проявляют либо окислительные, либо восстановительные свойства. Приобретая электроны, ионы металлов переходят либо в ионы низшей зарядности (а), либо в нейтральное состояние (б):
![]()
Теряя электроны, ионы металлов превращаются либо в ионы высшей зарядности (а), либо в сложные ионы (б):
![]()
Неметаллы также могут проявлять и восстановительные, и окислительные свойства. Теряя электроны, атомы неметаллов превращаются в электроположительные ионы, образующие в водной среде окислы или сложные кислородсодержащие ионы. Например:
![]()
Приобретая электроны, атомы неметаллов превращаются в электроотрицательные ионы. Например:
![]()
Отрицательные ионы неметаллов являются восстановителями. Теряя электроны, отрицательные ионы неметаллов переходят либо в нейтральное состояние (а), либо в сложные ионы (б):
![]()
Подавляющее большинство сложных кислородсодержащих ионов несет отрицательные заряды, например SnO32-, SiO32-, VO3-, WO42-, некоторые ионы заряжены положительно: H3O+, BiO+, SbO+, +, SbO2+, VO3+VO2+.
Сложные кислородсодержащие ионы, в состав которых входят электроположительные элементы, теряя свои электроны, превращаются в другие сложные ионы, содержащие те же элементы, но более электроположительной степени окисления. Например:
![]()
Приобретая электроны, сложные ионы превращаются в другие сложные ионы, в состав которых входят ионы элементов низшей валентности (а), в нейтральные молекулы (б) или в отрицательно заряженные ионы неметаллов (в):
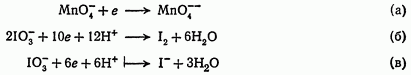
Составление уравнений окислительно-восстановительных реакций.
Существуют различные способы составления уравнений реакций окисления — восстановления. Ниже рассматривается ионно-электронный метод, основанный на составлении двух полуреакций: 1) полуреакции окисления и 2) полуреакции восстановления. Балансирование полуреакций проводят с таким расчетом, чтобы общее число электронов, перешедших к окислителю, равнялось числу электронов, потерянных восстановителем.
Если представить себе все вещества, написанные в левой части 1-й полуреакции и 2-й полуреакции подсобного уравнения, как израсходованные на реакцию ("расход"), а написанные в правой части, как полученные в результате реакции ("приход"), то составление уравнения реакций в окончательном виде не составляет никаких трудностей. Для этого нужно лишь подвести итог (составить баланс).
Перед составлением уравнения нужно решить основной вопрос пойдет ли данная реакция или не пойдет.
Это необходимо делать потому, что многие реакции, уравнения которых можно сбалансировать, т. е. написать на бумаге, на самом деле при данных условиях практически не идут.
Например, не идет реакция
![]()
но идет обратная реакция
![]()
Идут реакции:
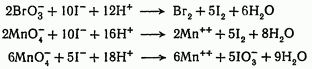
а обратные им реакции в тех же условиях практически не протекают.
Рассмотрим следующую реакцию окисления — восстановления:
![]()
Подсобное уравнение
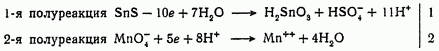
Нетрудно заметить, что уравнение реакции окисления — восстановления в полной форме является результатом суммирования двух полуреакций.
В этом примере ионы высшей степени окисления (SnIV и SnVI) с освобождающимися ионами кислорода (O2-) образуют в кислой среде соответственно нерастворимую в воде метаоловянную кислоту H2SnO3 и бисульфат-ион HSO4-, а ионы водорода с ионами кислорода в кислой среде образуют молекулы воды.
В молекулярной форме приведенная выше реакция может быть представлена так:
![]()
В общем виде при составлении правой части ионно-электронного уравнения реакции окисления — восстановления необходимо руководствоваться следующими правилами
В отношении ионов водорода
1) с освобождающимися (а) или образующимися (б) ионами кислорода или ионами гидроксила (в) ионы водорода образуют нейтральные молекулы боды:
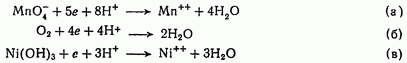
2) с ионами фтора, серы, селена, теллура, азота и других элементов, находящихся в состоянии низших степеней окисления, ионы водорода образуют соответствующие слабые электролиты:
![]()
3) с нейтральными молекулами воды и аммиака ионы водорода образуют ионы гидроксония и аммония.
В отношении ионов гидроксила
1) в процессе окисления соединений элементов низших степеней окисления в высшие степени окисления, в присутствии ионов гидроксила образуются кислородные соединения элементов высших степеней окисления и вода:
![]()
2) с элементами, склонными к образованию нерастворимых в воде гидроокисей, ионы гидроксила образуют осадки гидроокисей:
![]()
3) при окислении элементов, склонных к комплексообразованию, ионы гидроксила образуют с ними гидроксокомплексные ионы:
![]()
4) с ионами водорода и ионами аммония ионы гидроксила соответственно образуют молекулы воды (а) и аммиака (б):
![]()
В отношении молекул воды
1) с освобождающимися (а) или образующимися (б) ионами кислорода молекулы воды образуют гидроксильные ионы:
![]()
2) в процессе окисления ионов элементов низших степеней окисления в высшие молекулы воды образуют комплексные кислородсодержащие ионы (а) и нерастворимые в воде соединения (б), а также ионы водорода:
![]()
3) в процессе восстановления соединений элементов высшей степени окисления в низшие степени окисления в присутствии воды образуются соединения элементов низших степеней окисления (а), нерастворимые в воде соединения (б) и ионы гидроксила:
![]()
В отношении остальных ионов
1) одно-, двух- и трехзарядные ионы металлов, склонные давать нерастворимые соединения, в нейтральной или кислой среде образуют с кислотными остатками нерастворимые соли, например:
![]()
2) все ионы металлов, образующие нерастворимые в воде гидроокиси, дают в щелочной среде гидроокиси, например Fe(OH)2, Fe(OH)3 и др.;
3) двух-, трех- и четырехзарядные ионы металлов, склонные давать амфотерные гидроокиси, образуют в сильнощелочной среде сложные кислородсодержащие ионы типа ZnO22-, AlO2-, AlO33-, CrO33-, SnO32-, PbO22- и т.п.
4) ионы неметаллов положительной степени окисления и ионы металлов высокой степени окисления образуют с кислородом нейтральные молекулы окислов: NO, СО, CO2, SO2, SnO2, TiO2, MnO2; сложные кислородсодержащие ионы: NO3-, SO42-, PO43-, CrO42-, MnO4-, HSO4-, HPO42-, H2PO4-; слабые кислоты: H2SiO3, H2SnO3, H3BO3, H3AlO3 и др.
Следует иметь в виду, что свободные (или гидратированные) катионы, несущие свыше трехположительных зарядов, как правило, в водных растворах не существуют. Высокозарядные ионы в процессе разнообразных реакций окисления — восстановления, реагируя с водой, моментально соединяются с ионами кислорода воды, образуя сложные кислородсодержащие ионы типа VO3-, CrO42-, MnO4-:
Методы окислительно-восстановительного титрования классифицируются по характеру основного титранта:
перманганатометрия (основан на реакциях окисления восстановителей перманганатом калия KMnO4),
хроматометрия (основан на реакциях окисления восстановителей дихроматом калия K2Cr2O7),
йодометрия (основан на реакциях окисления восстановителей свободным йодом или на восстановлении окислителей йодидом калия KI) и др.
Достоинства метода окислительно-восстановительного титрования
1. Методы отличаются большой точностью и хорошей воспроизводимостью результатов.
2. Многие методы характеризуются быстротой выполнения и могут быть использованы для автоматического контроля.
3. Методы отличаются большим разнообразием, с их помощью можно определять не только окислители и восстановители, но и вещества, не проявляющие окислительно-восстановительных свойств.
4. Точку эквивалентности можно фиксировать с помощью индикаторов, а
также безиндикаторными и инструментальными методами.
5. Определения можно проводить прямым или обратным титрованием, а также методами замещения.
6. Многие окислители и восстановители легко получить в химически чистом виде, поэтому их титрованные растворы готовят по точной навеске. Приготовленные растворы можно использовать как для титрования, так и для стандартизации других растворов.
7. Титрование окислителями и восстановителями можно осуществлять во всех средах.
