
- •Растворы
- •100 г раствора – 4 г NaBr 1000г раствора – 40 г
- •Молярная концентрация эквивалента.
- •Количество вещества эквивалента равно отношению массы вещества Х к молярной массе эквивалента этого
- •Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы
- •.Расcчитать молярность и моляльность 15-% раствора серной кислоты (плотность 1,1 г/см3)
- •Задание
- •Растворы электролитов и неэлектролитов
- •Вещества
- •Почему растворы электролитов проводят электрический ток?
- •Строение молекулы воды
- •Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде
- •Последовательность процессов, происходящих при электролитической диссоциации:
- •Уравнения диссоциации
- •Электролиты
- •Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд),
- •Водородный показатель, рН среды, кислотность среды
- •Индикаторы
- •Принцип
- •Среди физиологических жидкостей организма наиболее кислым является желудочный сок, фактически он представляет собой

Растворы
ΔG = - RTlnC |
Если С →0, то ΔG →∞ |
Любой исследуемый вещественный объект представляет собой многокомпонентную систему
Гомогенная многокомпонентная система называется раствором.
В растворах присутствуют:
1 - растворитель и 2 - растворенные вещества




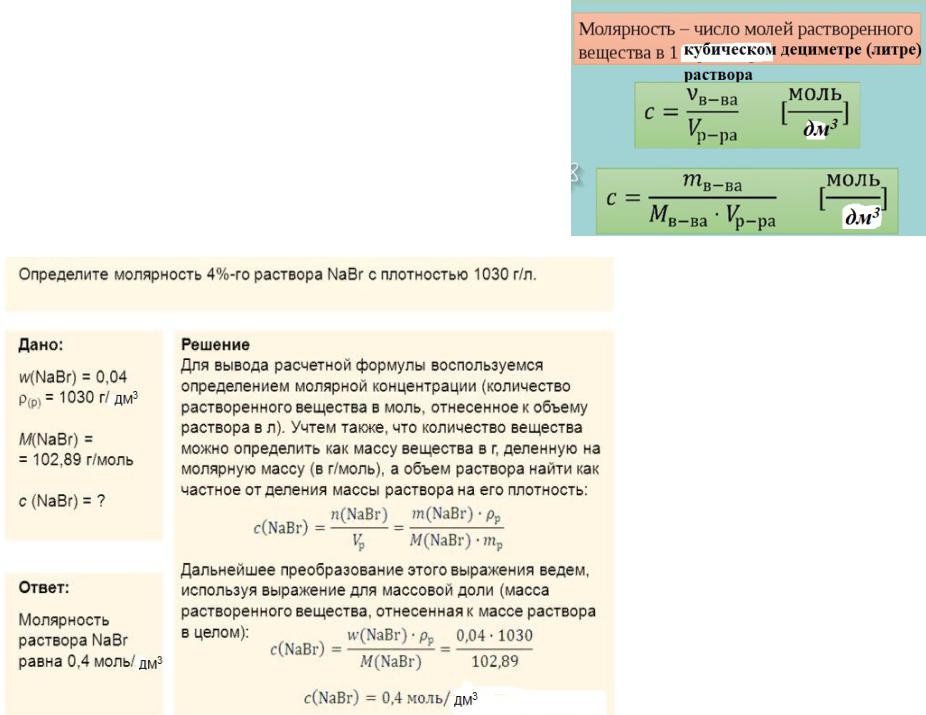
100 г раствора – 4 г NaBr 1000г раствора – 40 г
d раствора – 1,03 г/см3
1000 г этого раствора занимает объем V = m/d = 1000/1,03 = 970,9 мл = 0,9709 л
С = 40/102,89*0,9709 = 0,4 моль/дм3 (л)
Молярная концентрация эквивалента.
Эквивалентом называется реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или одному электрону в окислительно-восстановительной реакции.
HCl +NaOH = NaCl+H2O
f экв – фактор эквивалентности
Для этой реакции fэкв NaOH =1 Эквивалент NaOH = 1 2HCl +Сa(OH)2 = CaCl2 + H2O
f экв Сa(OH)2 = 1/2, эквивалент Сa(OH)2 = ½ 3HCl +Al(OH)3 = AlCl3 + H2O
f экв Al(OH)3 = 1/3, эквивалент Al(OH)3 = 1/3
Молярная масса эквивалента вещества Х
Мэкв (Х)= М(х)*fэкв(х)
Мэкв (NaOH) = 40 г/моль*1 = 40 г/моль-экв M экв Al(OH)3 = 1/3*78 г/моль = 26 г/моль-экв
Количество вещества эквивалента равно отношению массы вещества Х к молярной массе эквивалента этого вещества
νэквСa(OH)2 = mСa(OH)2/Мэкв Сa(OH)2
Молярная концентрация эквивалента раствора, иначе нормальность раствора
Это количество вещества эквивалента в 1 дм3 (литре) раствора.
Сэкв(Х) = νэкв(Х)/V
V – объем раствора, дм3. Пример.
В 1 дм3 воды растворили 150 г серной кислоты. Плотность полученного раствора (d) = 1,1 г/см3
Найти молярную концентрацию эквивалента этого раствора Решение
Масса полученного раствора – 1000 г воды + 150 г серной кислоты = 1150 г. Объем раствора – М = V/d = 1150/1,1 = 1045 см3 = 1,045 дм3
νэквH2SO4 = m (H2SO4)/M(H2SO4)*f = 150/98*1/2 = 3,06 моль-экв Сэкв(H2SO4) = ν(H2SO4)/V = 3,04/1,045 = 2,93 моль-экв/дм3
Иначе говорят - 2,93 н раствор.

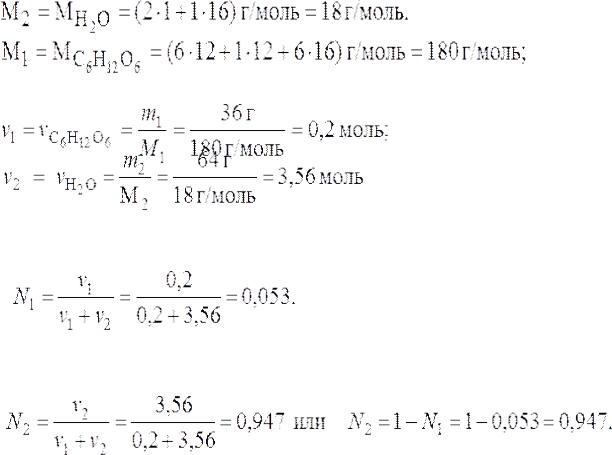
Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение.
Пусть масса раствора m = 100 г. Тогда масса глюкозы в растворе m1 = 36 г, масса воды m2 = 64 г. Определим молярные массы глюкозы и воды:
Определим количество глюкозы и воды в растворе:
Определим мольную долю растворенного вещества – глюкозы:
χ
Определим мольную долю растворителя – воды:
χ |
χ |
χ |

