
новая папка 1 / новая папка / занятие 2
.docx2.Классификация химических реакций. Реакции обратимые и необратимые, гомогенные и гетерогенные, экзотермические и эндотермические, простые и сложные, последовательные, цепные, сопряженные: определение, примеры.
Химические реакции, или химические явления, —это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки.
1.По направлению
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Необратимых реакций не так много. Большинство реакций являются обратимыми, т.е.одновременно протекающими в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
![]() ,
,
2.По фазовому составу
Гомогенными называются реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NO2(г) + CO(г) = NO(г) + CO2(г);
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O
Реакции, происходящие на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами называются гетерогенными. Типичным примером гетерогенной реакции является лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Zn(тв) + H2SO4(р-р) = H2(г) + ZnSO4(р-р)
3.По тепловому эффекту реакции делят на экзотермические и эндотермические.
Реакции, в которых энергия выделяется, называются экзотермическими. Реакции, идущие с поглощением энергии – эндотермические. Значение теплового эффекта соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции. Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. Разрыв химических связей в эндотермических процессах требует большей энергии, чем может выделиться при образовании новых химических связей в молекулах. Для эндотермических реакций ΔH >0. Примером экзотермической реакци является внутримолекулярное окисление-восстановление дихромата аммония (NH4)2Cr2O7:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4 H2O - ΔH.
Примером эндотермической реакции является разложение карбоната кальция:
СаСО3=СаО+СО2 + ΔH
4. По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов:
I2= 2I.
Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2 = 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1)Н2О2 =Н2О+О 2) О + О = О2.
Сложные реакции в свою очередь делят на последовательные, сопряженные,цепные.Последовательные - реакции с промежуточными стадиями типа А → В → С. Последовательные реакции распространены в природе и особенно часто они наблюдаются в биохимических процессах, протекающих в живых организмах, растениях. В качестве примера таких реакций можно привести фотосинтез и биологическое окисление глюкозы, гидролиз олиго- и полисахаридов и т.д.
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2 легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2 в этом случае окисляет и бензол:
Fe2+ + H2O2 = Fe3+ + OH- OH- + OH- + C6H6 = C6H5OH + H2O.
Цепная реакция — химическая или ядерная реакция, в которой появление активной частицы (свободного радикала или атома в химическом, нейтрона в ядерном процессе) вызывает большое число (цепь) последовательных превращений неактивных молекул или ядер. Свободные радикалы и многие атомы, в отличие от молекул, обладают свободными ненасыщенными валентностями (непарным электроном), что приводит к их взаимодействию с исходными молекулами. При столкновении свободного радикала (R•) с молекулой происходит разрыв одной из валентных связей последней и, таким образом, в результате реакции образуется новый свободный радикал, который, в свою очередь, реагирует с другой молекулой — происходит цепная реакция. К цепным реакциям в химии относятся процессы окисления (горение, взрыв), полимеризации и другие.


4.Закон действующих масс отражает зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
![]()
закон действующих масс может быть записан в виде кинетического уравнения вида:
![]() (1)
(1)
где ![]() —
скорость химической реакции,
—
скорость химической реакции, ![]() —
константа скорости реакции.
—
константа скорости реакции.
Константа скорости k численно равна скорости реакции, если концентрации реагентов постоянны и равны единице.
Выражение (1) относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию.
14. Молекулярность и порядок реакции. Определение молекулярности сложной реакции. Кинетические уравнения реакций нулевого, первого и второго порядков.
Различают молекулярность реакции и ее порядок. Молекулярность реакции определяется числом молекул, участвующих в одном элементарном акте химического взаимодействия, причем имеется в виду только число реагирующих молекул, а не образующихся веществ. Молекулярность реакции указывает число молекул, в которых происходит изменение ковалентных связей в стадии, определяющей суммарную скорость реакции. Так, если в реакцию вступает одна молекула, то такая реакция называется мономолекулярной реакцией. Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
I2 ––> I• + I•
Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):..
СН3Вr + КОН ––> СН3ОН + КВr
Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО ––> 2NО2
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул. Молекулярность реакции легко определить только в случае простых реакций, протекающих в одну стадию.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально. Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции. Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
H2 + I2 → 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции.
Порядок и молекулярность реакции совпадают только для простых реакпий, протекающих в одну стадию в соответствии со стехиометрическим уравнением. Объясняется это тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, через ряд последовательных стадий.
При исследовании сложных реакций пользуются принципом независимости, считая, что каждая из составляющих их простых реакций протекает независимо от других и описывается своим кинетическим уравнением. Общее кинетическое уравнение сложной реакции получают путём объединения кинетических уравнений составляющих её простых реакций с учётом скорости их протекания. В связи с этим такое уравнение часто содержит несколько констант скоростей и показатели порядка по каждому из реагентов в нём могут не совпадать со стехиометрическими коэффициентами, поэтому они определяется только опытным путём. Порядок в сложных реакциях может выражаться как целым, так и дробным числом и даже быть равным нулю. Дробный порядок сложной реакции получается, если она включает в себя несколько лимитирующих стадий, протекающих с сопоставимыми скоростями, но имеющих разный порядок. Нулевой порядок наблюдается в гетерогенных реакциях, протекающих на твёрдой фазе.
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Кинетическое уравнение реакции первого порядка:
![]()
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]() или
или
![]()
7.Скорость химической реакции зависит от многих факторов, среди которых находится температура. При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул. Все это обусловливает увеличение скорости химических реакций с повышением температуры Количественно зависимость скорости гомогенных реакций от температуры может быть выражена установленным опытным путем в приближенной форме правилом Вант - Гоффа: при повышении температуры на каждые 10оС скорость гомогенной химической реакции увеличивается в 2-4 раза.
Уравнение, которое описывает это правило, следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции,
численно равен
—
температурный коэффициент реакции,
численно равен
отношению константы скорости при температуре Т + 10 к константе при температуре Т.
γ = k Т+10 / k Т.
Для большинства биохимических реакций температурный коэффициент Вант-Гоффа варьирует от 1,5 ¸ 3,0. Поэтому, если в результате какого-либо заболевания температура человеческого тела поднялась, например, с 36,50 до 39,50С, это значит увеличение скорости происходящих биохимических процессов в 1,13 – 1,39 раз, т.е. на 13-39%.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции. С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц α, зависящую от температуры:
- α = exp(-E/RT)
и вывел уравнение Аррениуса для константы скорости реакции:
k = koe-Eа/RT,
где ko и Eа зависят от природы реагентов. Еа - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации. Она зависит от природы реагирующих веществ и является характеристикой любой реакции и обычно выражается в кДж/моль. Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция. Энергия активации быстро протекающих катализируемых реакций ниже, чем энергия активации соответствующих некатализируемых реакций. На этом основании часто говорят, что катализатор снижает энергию активации реакции.
Поясним на примере реакции в общем виде:
А2 + В2 = 2АВ
По оси ординат откладываем потенциальную энергию системы, а по оси абсцисс – ход реакции:
исходное состояние ---- переходное состояние – конечное состояние.

Чтобы войти в химический контакт друг с другом, реагирующие вещества А2 и В2 должны преодолеть энергетический барьер. На это затрачивается энергия активации. В случае применения катализатора значение энергии активации Еа меньше, чем без использования катализатора Еа
9,10.О химическом равновесии можно говорить при выполнении двух условий.
а) Во-первых, реакция является химически обратимой, т.е., в зависимости от условий, способна протекать и в прямую, и в обратную сторону.
б) Во-вторых, реакция находится в состоянии термодинамического равновесия: при имеющихся условиях не протекает фактически ни в одну сторону, но при малейшем воздействии может быть сдвинута в любую сторону.
Химическое равновесие характеризуется такой характеристикой химической реакции, как константа равновесия Кр. Это величина, определяющая для данной химической реакции соотношение между концентрациями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс), по значению Кр можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
С помощью кинетических уравнений прямой и обратной реакций выведем выражение для константы равновесия. Пусть происходит обратимая реакция:
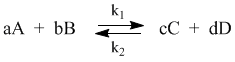
Здесь а, b, c, d – коэффициенты перед веществами в химических уравнениях прямой и обратной реакций. В этом случае можно записать кинетические уравнения:
vпр = k1[A]a[B]b; vобр = k2[C]c[D]d
При наступлении равновесия скорости прямой и обратной реакции становятся равны (vпр = vобр) и можно записать:
k1[A]a[B]b = k2[C]c[D]d
Из этого соотношения можно получить константу равновесия Кр, которая равна отношению констант скорости прямой и обратной реакций:
![]()
В предыдущем уравнении достаточно перенести в левую часть k2
![]()
а из полученного уравнения уже легко получается выражение для константы равновесия Кр:
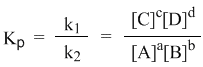
Это не что иное, как математическая запись закона действующих масс для химического равновесия. Часто его формулируют следующим образом: отношение равновесных концентраций продуктов и субстратов (где концентрации взяты в соответствующих стехиометрических степенях) не зависит от исходных концентраций участников. Константа равновесия определяется экспериментально. Численное значение Кр характеризует положение равновесия при данной температуре и не меняется с изменением концентраций реагирующих веществ. Это значит, что независимо от исходных концентраций участников обратимой реакции (и реагентов, и продуктов), если реакция приходит к равновесному состоянию, отношение произведения конечных концентраций продуктов и реагентов оказывается всегда одним и тем же.
Запишем константу равновесия для гомогенной реакции
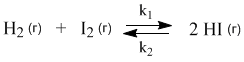
![]()
Для гетерогенной химической реакции концентрации конденсированных фаз (твердых или жидких) условно принимают равными единице и, таким образом, исключают из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
FeOт + COг = Feт + CO2г
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
![]()
Термодинамика дает важное соотношение между стандартной свободной энергией и константой равновесия, названное изотермой химической реакции
DG0 = -R T ln K = -2,3 R T lg K
Как видно из этих уравнений отрицательный знак DG0 возможен только в случае, если lgK > 0, т.е. К > 1, а положительный – если lgK < 0, т.е. К < 1.
Это значит, что при отрицательных значениях DG0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик, при положительном знаке DG0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
Знак DG0 указывает на возможность или невозможность протекания реакции только в стандартных условиях. Чем значительнее убыль энергии Гиббса, тем больше константа равновесия.
11.Состояние химического равновесия зависит от целого ряда факторов, основные из которых - температура, давление и концентрация. При изменении хотя бы одного из них равновесие нарушается и концентрации реагирующих веществ изменяются до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций.
Переход реакционной системы из одного состояния равновесия к другому называется смещением или сдвигом химического равновесия.
Влияние различных факторов на состояние равновесия качественно описывается принципом смещения равновесия, сформулированным французским физико - химиком Анри Ле Шателье: eсли на систему, находящуюся в равновесии производится какое-либо воздействие (изменяется концентрация, температура, давление), то равновесие смещается в направлении процесса, ослабляющего произведенное воздействие.
Поясним на примере реакции синтеза аммиака:
N2 + 3 H2 ![]() 2
NH3DH0 = - 46кДж/моль
2
NH3DH0 = - 46кДж/моль
1)При увеличении концентрации хотя бы одного из реагентов равновесие смещается в сторону образования продуктов, а при добавлении продуктов – в сторону реагентов. Если увеличить концентрацию азота или водорода , то равновесие сместится вправо, в сторону расходования реагентов , в сторону уменьшения концентрации этих веществ. Увеличение концентрации NH3 сместит равновесие влево.
2)Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции, а понижение - в сторону экзотермической. Реакция синтеза аммиака идет с выделением тепла (экзотермическая), поэтому повышение Т смещает равновесие влево, а понижение- вправо. Однако в промышленных условиях синтез аммиака проводят при довольно высоких температурах т.к. при низких Т хотя и достигается больший выход целевого продукта, но скорость установления равновесия настолько мала, что экономичнее синтезировать аммиак с меньшим выходом, но за более короткий срок. Но снижение выхода компенсируется увеличением давления. Одновременное повышение t до 450-5500С и увеличение давления от 15 до100мПа ускоряет процесс достижения равновесия и увеличивает выход продукта.
3)Повышение давления в равновесной системе вызывает реакцию, сопровождающуюся уменьшением числа частиц в газовой фазе, равновесие смещается в сторону меньшего числа газообразных частиц.
В данной реакции увеличение давления сместит равновесие вправо, а уменьшение - влево.
Принцип Ле Шателье применим не только к гомогенным системам , но и к гетерогенным. Гомогенные реакции протекают в однофазной системе и во всем объеме, гетерогенные - в многофазной , на поверхности раздела фаз.
В качестве примера рассмотрим гетерогенную реакцию восстановления оксида углерода (IV).
С(тв ) + СО2(г) 2СО(г) DH0 = 172,46 кДж
1)Увеличение концентрации СО2(г) сместит равновесие вправо, а СО влево.
2)Поскольку процесс эндотермический, то нагревание сместит равновесие вправо, в сторону увеличения выхода СО, а ее охлаждение - влево.
3)Повышение давления будет препятствовать протеканию прямого процесса, уменьшение - способствовать ему.
Буферные системы и их роль в организме человека
8. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости. химической реакции от температуры. . Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ.

Уравнение Аррениуса – это температурная зависимость константы скорости К элементарной химической реакции: К=Аexp(-Еа / kТ). где A – предэкспоненциальный множитель (размерность совпадает с размерностью К), Еа- энергия активации , обычно принимающая положительные значения, Т – абсолютная температура, k-постоянная Больцмана.
1.Химическая кинетика или кинетика химических реакций — раздел физической химии , изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
2. ТИПЫ КЛАССИФИКАЦИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Существует несколько подходов к классификации химических реакций^
по числу и составу реагирующих и образующихся веществ
по изменению степени окисления
по агрегатному состоянию реагирующих веществ
по тепловому эффекту
по участию катализатора
по направлению протекания реакции



Последовательной реакцией называется реакция, имеющая промежуточные стадии типа А → В → С. То есть, при последовательной реакции из одних веществ получаются другие.
Цепные реакции – реакции, в которых возможность протекания каждого элементарного акта сопряжена с успешным исходом предыдущего акта и обуславливает возможность последующего. Образование макроскопических количеств продукта реакции представляет собой результат цепи элементарных актов взаимодействия.
Сопряжённые реакции - такие химические реакции, которые протекают только совместно и при наличии хотя бы одного общего реагента.
