
Лекции / Л6 Атмосфера. Состав и строение
.pdf
|
|
|
|
АТМОСФЕРА |
|
|
|
|
|
|
|||||
Удаление |
Электро |
|
Плазма |
Космическая |
|
|
|||||||||
|
|
|
|
|
|
||||||||||
|
|
−магнитное |
|
|
|
|
|
|
|
||||||
водорода в |
|
(солнечный |
пыль |
|
|
||||||||||
|
|
излучение |
|
|
|
|
|
|
|
||||||
космос |
|
ветер) |
|
|
|
|
|
|
|||||||
|
|
|
Магнитопауза |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Магнитосфера |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ионопауза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ионосфера |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Мезопауза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
≈35 км |
|
|
|
|
Мезосфера |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стратопауза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Озоновый слой |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||
40 км |
|
|
|
Стратосфера |
|
|
|
|
Тропопауза |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10÷12 |
|
|
|
|
Тропосфера |
|
|
|
|
|
|
||||
км |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Земля |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
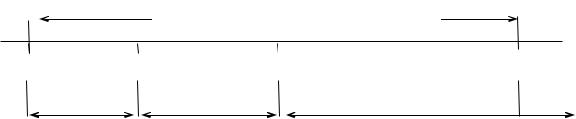
Рис.23. Структура атмосферы Атмосфера – газовая оболочка Земли массой 6 1018 т и состоит в
основном из азота и кислорода. Структура атмосферы складывается из двух частей: внутренней – тропосферы, стратосферы, мезосферы, ионосферы (термосферы) и внешней – магнитосферы (экзосферы). Каждая сфера отделяется от другой небольшой прослойкой – паузой. Каждая сфера характеризуется определенным уровнем температуры, давления и специфическими особенностями химических и физических явлений.
Тропосфера – наиболее плотный слой воздуха, прилегающего к земной
поверхности. Высота 10 ÷12 км. В ней сосредоточено |
4/5 массы земной |
атмо сферы. Температура меняется от + 40°C до |
−50°C. Из-за |
неравномерности нагрева земной поверхности в ней образуются мощные
вертикальные токи воздуха, отмечаются неустойчивость температуры,
влажности, давления и т.п. Этот слой в итоге формирует климат Земли. |
|
Стратосфера (высота 40 км) состоит из изотермического слоя |
−50°C |
(12÷30 км), а затем температура начинает увеличиваться и на высоте 50 км достигает +10°C. Этот слой атмосферы включает озоновый слой (25 ÷40 км),
который образуется при ионизации молекул О 2 под действием космического излучения и коротковолновой части УФ излучения.
Мезосфера, температура понижается до −70÷ −120°C.
Ионосфера (термосфера) характеризуется непрерывным повышением температуры с высотой. На высоте 150 км температура достигает 200 ÷240°C;
на высоте 200 км температура имеет значение 500°C, а на высоте 500 ÷600 км выше 1500°C.
Под действием солнечного излучения протекает множество реакций, в которых участвуют O 2, O3, N2, оксиды азота, пары воды, CO 2. Ионизация происходит в основном на высоте 70÷80 км.
При этом образуются отрицательные ионы: N −, O−, O2−, CO32−, NO2−,
NO3− и положительные ионы: N +, O+, Н +, O2+ и др. Эти ионы образуют
различные комплексы: NO − N2; NO+ CO2; NO+ H2; O2+ H2O; H+ (H2O)n. На высоте 110÷120 км кислород почти весь становится атомарным. Кислородно-
азотный состав сохраняется до высоты 400 ÷600 км. Выше 600 км в
атмосфере начинает преобладать гелий. Гелиевая корона Земли простирается до высоты 1600 км, а выше 2000÷3000 км преобладает атомарный водород.
Хотя в атмосфере совершаются многочисленные физические и химические процессы, ее приземной слой сохраняет практически неизменный состав. Приземной слой воздуха является смесью двух типов газов: постоянных (O2, N2, благородные газы) и переменных, одни из которых образуются естественным путем, а другие частично являются результатом производственной деятельности человека. Наиболее важными из переменных газов являются водяной пар, CO2, O3.
Солнечное излучение.
Солнечное излучение – электромагнитные волны, которые достигают поверхности земли. Состоит из семи процентов ультрафиолетового излучения (УФ) (180-400 нм), сорока восьми процентов видимой части спектра (400-760 нм) и сорока пяти процентов инфракрасного излучения
(760-4000 нм) рис.24):
спектр солнечного излучения
180 нм |
400 нм |
760 нм |
4000 нм |
|
ультрафиолетовое видимая часть |
инфракрасное излучение |
|||
излучение |
|
спектра |
|
45% |
7% |
|
48% |
|
|
Рис.24. Лучистая энергия Солнца Ультрафиолетовое излучение 180-289 нм умерщвляют живые клетки
(например, бактерии), УФ 289-313 нм в малых дохах способствует синтезу витаминов, активизирует дыхание и кровообращение, улучшает общее состояние человека (эффект умеренного загара). В высоких дозах УФ вызывает рак кожи и катаракту глазного хрусталика (кварцевые лампы).
Проходя через атмосферу, солнечное излучение рассеивается на молекулах газов, на взвешенных примесях, поглощается водяным паром, О 3, СО 2, пылевидными частицами. Рассеянное солнечное излучение частично доходит до земной поверхности. Его видимая часть создает свет днем при отсутствии прямых солнечных лучей (например, при сильной облачности).
Энергия солнечного излучения не только поглощается поверхностью Земли, но и отражается ею в виде потока длинноволнового излучения.

S3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
hν |
S2 |
|
|
|
ИК-область |
|
|
|
||
|
|
|
|
(тепловое) |
S1 |
|
|
|
|
|
|
|
||
|
|
|
|
hν1 |
S0 |
|
|
|
|
|
Поглощение |
|
Флуоресценция |
|
|
А + hν → А* |
А*→ А + hν1 |
||
Под действием кванта ультрафиолетового излучения молекула может перейти в возбуждённое состояние:
А + hn ® А*
Далее возможно:
дезактивация за счет флуоресценции:
А*® А + hn¢
дезактивация за счет соударения с другими молекулами (тушение):
А* + М ® А + М¢
диссоциация:
А*® B + C
Вещества-инициаторы фотохимических процессов в атмосфере: O2, O3, Н2O, NO2, N2O.
N2O+ hn ® N2 + O NO2+ hn ® NO+ O O2+ hn ® O + O

O3+ hn ® O2 + O
Образованные в результате фотохимического воздействия частицы могут реагировать дальше:
O + O2 ® O3
2NO + O2 ® 2NO2 NO + O3 ® NO2 + O2 O + NO2 ® NO +O2
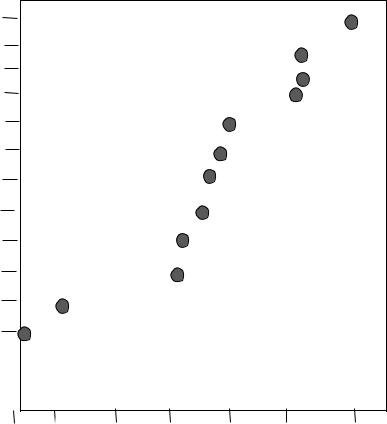
На рис.11. приведены значения времени жизни некоторых газов в
атмосфере. Как видим, радикальные частицы (HO 2 |
• |
и |
HO) способны к |
|
|
• |
существованию не более минуты, время жизни NO 2 дольше – сутки. Метан и СО могут пребывать в атмосфере более года прежде, чем подвергнуться каким либо превращениям.
Для мегаполисов и промышленных объектов с большим выбросом в атмосферу углеводородов наблюдаются следующие процессы:
RН + O2 → RO2Н
RO2Н→ RO• + НO•
RO• + O2 → R• + O3
т.е. образования углеводородных радикалов и озона:
R1CH2−CH2R2 + O3 → R1CH2−O3−CH2R2 (озониды) |
||||||
|
R1CH2−O3−CH2R2 → R1CH2O• + R2CH2O2• |
|||||
R2CH2O2• + NO2 → R2CH2O2NO2 - (фотооксиданты) пероксиацетилнитрат |
||||||
(ПАН) и пероксибензоилнитрат (ПБН) |
|
|
|
|||
|
O |
|
|
|
||
|
C O O NO2 |
O |
||||
|
|
|
|
|
|
|
|
|
|
|
H3C C O O NO |
||
|
|
|
|
2 |
||
Пероксибензоилнитрат |
Пероксиацетилнитрат |
|||||
|
(ПБН) |
(ПАН) |
||||
чрезвычайно ядовитые вещества, которые вызывают астматический кашель, раздражение слизистой глаз, дыхательных путей и т.д.
Для ПАН предельно допустимая концентрация составляет 30 ppb. Для ПБН ещё меньше.
N2O
H2
CH3CCl3
CH4
CO
O3
CS2
SO2
NO2
H2O2
HO2•
HO•
1 с 1 мин 1 ч 1 сут. 1 год 10 лет 100 лет
Рис.25. Время жизни следовых газов в атмосфере Способность органических веществ образовывать свободные радикалы
зависит от их строения. Так, олефины с внутренней двойной связью активнее олефинов с концевой двойной связью; альдегиды > этилен > толуол > парафины > ацетилен >бензол
Таблица 21. Реакционная способность органических соединений при их окислении в атмосфере промышленных городов
Класс 1 |
Класс 2 |
Класс 3 |
(низкая) |
(умеренная) |
(высокая) |
|
|
|
Парафины С1-С3 |
Бутаны, циклобутан |
Моноалкилбензолы |
Ацетилен |
Циклич. кетоны |
Диалкилбензолы |
|
|
|
Бензол |
Этанол |
Триалкилбензолы |
|
|
|
Бензальдегид |
н.-Пентаноны |
Стирол |
Ацетон |
трет.-Алкилацетат |
Метилстирол |
Метанол |
трет.-Моноалкилбензолы |
Олефины алифат. |
Изопропанол |
Парафины С3 и выше |
Кетоны изостроен. |
|
|
|
Этиламины |
2-Нитропропан |
Кетоны непред. |
Галоген.алканы |
Толуиловые альдегиды |
Галоген.алкены |
|
|
|
