
- •Оглавление
- •Введение
- •Строение кислорода и его химические связи
- •Химические связи кислорода с углегодом и водородом
- •Гидрооксисоединения
- •Спирты
- •Классификация спиртов
- •Фенолы
- •Химические свойства гидроксисоединений
- •Применение гидроксисоединений
- •Альдегиды и кетоны
- •Номенклатураи изомерия альдегидов и кетонов
- •Применение альдегидов и кетонов
- •Карбоновые кислоты
- •Классификация карбоновых кислот
- •Номенклатура и изомерия карбоновых кислот
- •Углеводы
- •Список литературы
Строение кислорода и его химические связи
Кислород – элемент VI А группы 2-го периода Периодической системы элементов ; атомый номер 8; атомная масса 16; электроотрицательность 3,5. Электронная конфигурация в основном состоянии 1s22s22p4:
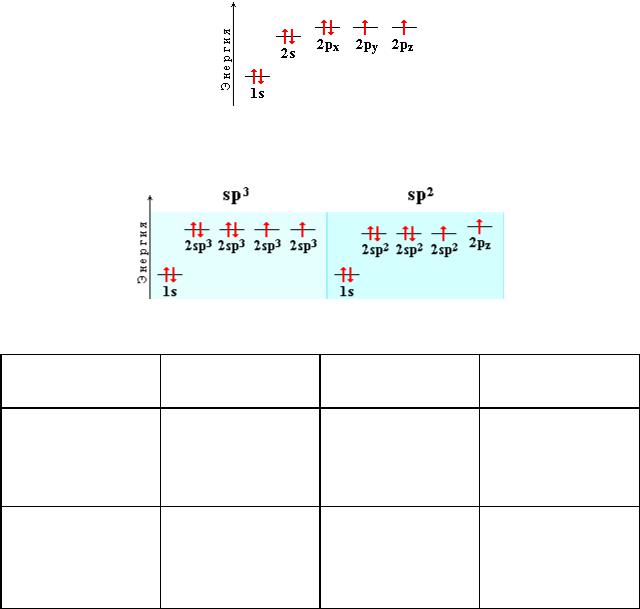
В различных соединениях кислород может находиться в состояниях sp3 и sp2-гибридизации.
Тип гибридизации |
Электронная |
Число гибридных |
Валентный угол |
кислорода |
конфигурация |
орбиталей |
|
sp3 |
1s2(2sp3)6 |
4 |
108,5˚ |
sp2 |
1s2(2sp2)52p1 |
3 |
120˚ |
За счет двух одноэлектронных АО кислород способен к образованию двух ковалентных связей с другими атомами по обменному механизму. В этом случае кислород проявляет валентность 2 и имеет две неподеленные электронные пары. Такой атом кислорода может выступать донором пары электронов, образуя третью связь по донорно-акцепторному механизму. При этом кислород приобретает валентность 3 и заряд +1 (например, в ионе гидроксония H3O+ или алкилгидроксония RH2O+).
Такое взаимодействие кислородсодержащих соединений играет важную роль при проведении реакций в присутствии сильных минеральных кислот в
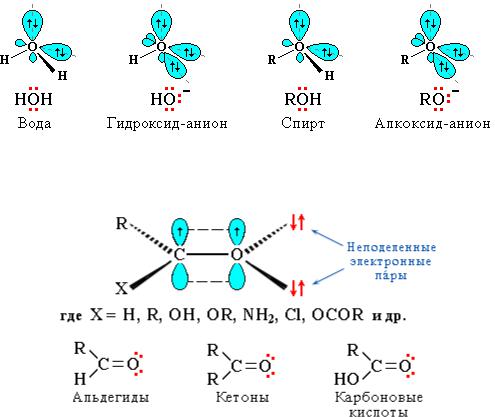
качестве катализаторов (кислотный катализ). Положительно заряженный атом кислорода может участвовать в образовании ионной связи. Соединения, содержащие атом кислорода в sp3-гибридизованном состоянии:
sp2-Гибридизованный атом кислорода присутствует в соединениях с карбонильной группой >С=О:
Кроме того, кислород в sp2-состоянии может быть и в группах ОН или ОR, если они связаны с sp2-атомом углерода, например, в феноле.
Химические связи кислорода с углегодом и водородом
Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3.5, 2.1 и 2.5. Поэтому связи кислорода с Н или С являются ковалентными полярными. В этих связях электронная плотность смещена к более электроотрицательному атому кислорода, создавая на нем частичный отрицательный заряд, а на углероде или водороде - частичный положительный.
