
Большой практикум / 9_Кинетика
.docxОпределение кинетических характеристик ферментативной реакции (Km, Vmax) на примере оксидоредуктазы из светящихся бактерий
АННОТАЦИЯ
В ходе работы была измерена скорость ферментативной реакции (алкогольдегидрогеназы и NAD+ ) спектрофотометрическим методом. Далее методом линерализации Лайнуивера-Берка была определена Константа Михаэлиса KM = 93 мкМ/л и максимальная скорость исследуемой реакции Vmax = 22,7мкМ/мин. По определённым величинам была построена теоретическая кривая ферментативной реакции, которая хорошо соотносится с эксперементальными данными
ВВЕДЕНИЕ
Кинетика ферментативных реакций
В кинетике ферментативных реакций изучают зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Если концентрация фермента остается постоянной, то график зависимости скорости ферментативной реакции от количества субстрата описывается гиперболой (рис. 1.1)
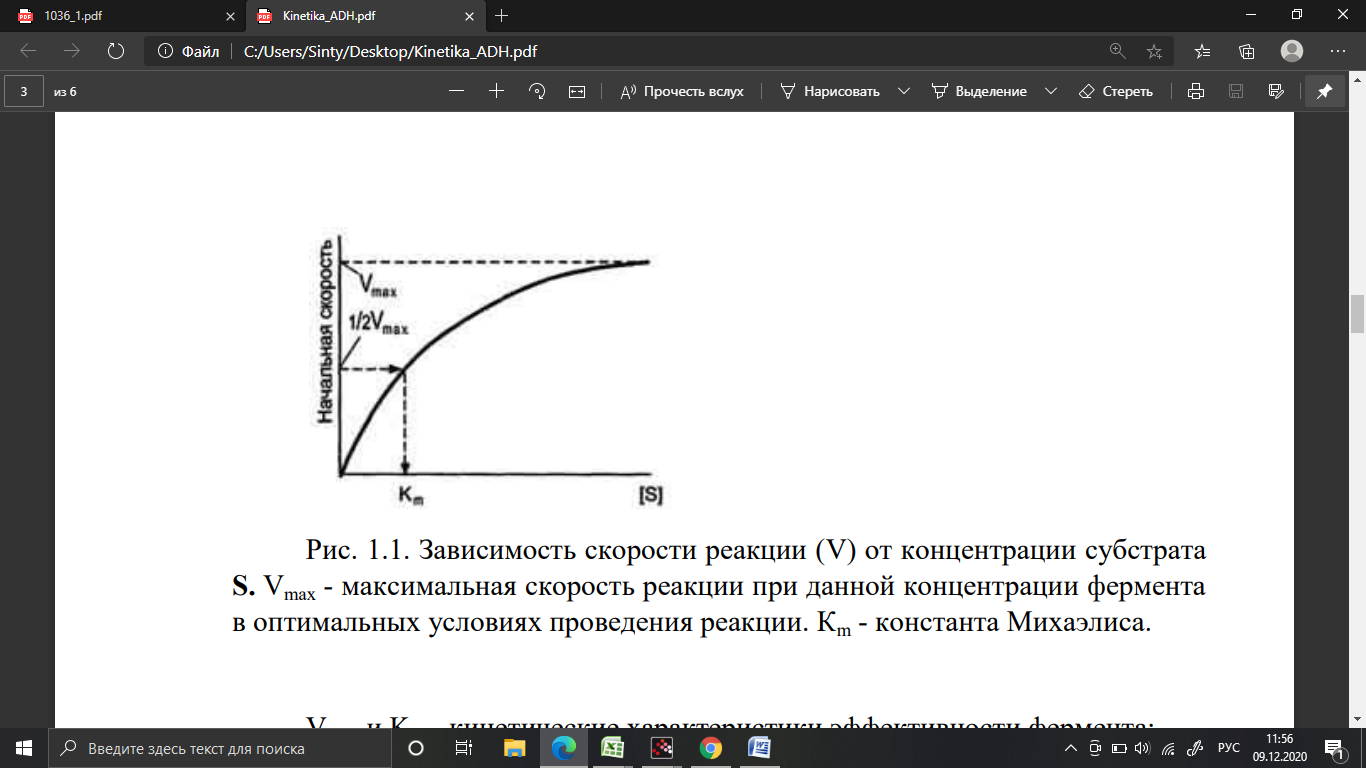
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной Л. Михаэлисом и М. Ментен в 1913 г.
Упрощенно ферментативный процесс можно выразить следующим уравнением:
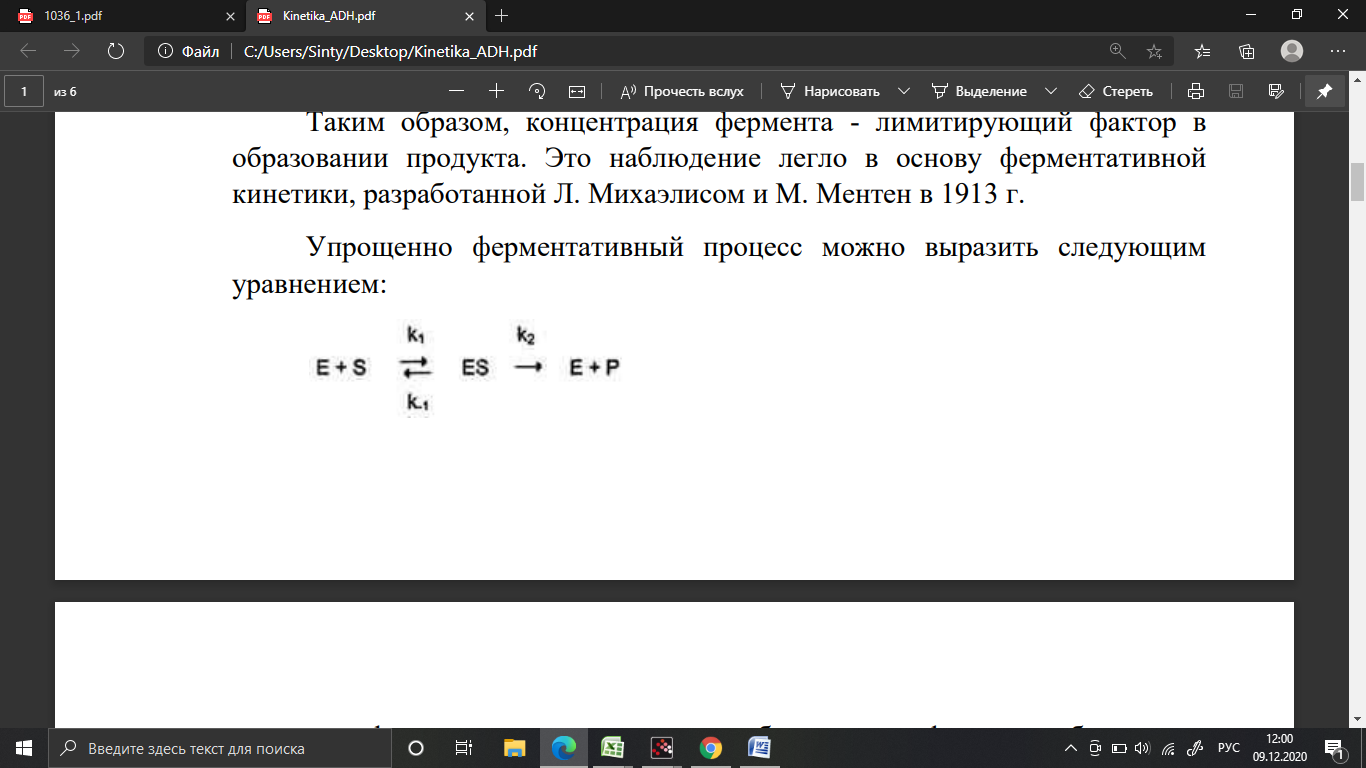
где k1 – константа скорости образования фермент-субстратного комплекса; k-1 – константа скорости обратной реакции, распада ферментсубстратного комплекса; k2 – константа скорости образования продукта реакции.
Соотношение констант скоростей (k-1 +k2)/k1 называют константой Михаэлиса и обозначают Кm.
Скорость реакции пропорциональна концентрации ферментсубстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в ферментсубстратном комплексе ES, т.е. [Е] = [ES]. Зависимость скорости ферментативной реакции от концентрации субстрата выражается уравнением Михаэлиса-Ментен:
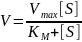
Когда скорость реакции равна половине максимальной, KM =[S]. Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше KM (S>>KM), то можно считать KM+S S. Следовательно, скорость реакции становится равной максимальной скорости: V=Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше KM (S<< KM), то сумма (KM + S) примерно равна КM, следовательно, V = Vmax[S]/KM, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
Vmах и KM - кинетические характеристики эффективности фермента:
Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата;
КM характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента; чем меньше КM, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше КM, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
Линерализация
Линеаризация — метод, при котором исследование нелинейной системы заменяется анализом линейной системы, в некотором смысле эквивалентной исходной. При методе Лайнуивера-Берка уравнение Михаэлиса-Ментен заменяется уравнением:
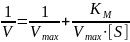
График этого метода выглядит:
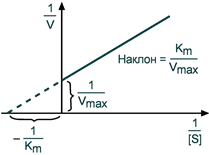
МАТЕРИАЛЫ И МЕТОДЫ
Измерение активности алкогольдегидрогеназы проводят спектрофотометрическим методом. Стандартный спектрофотометр устроен по следующей схеме: свет от лампы попадает в монохроматор, который выделяет из него заданную длину волны, и проходит сквозь кювету с образцом, его интенсивность регистрируется детектором (фотоэлектронным умножителем) и передается на управляющую станцию (компьютер).
Применение спектрофотометра для измерения скорости реакции, катализируемой алкогольдегидрогенозой, становится возможным благодаря тому, что субстрат реакции – NAD+ изменяет свой спектр поглощения при переходе в восстановленную форму (NADH). При восстановлении появляется характерная полоса с максимумом при 340 нм. Поэтому, регистрируя скорость изменения оптической плотности при 340 нм, можно рассчитать скорость ферментативной реакции (т.е. скорость расходования субстрата).
РЕЗУЛЬТАТЫ
Таблица 1 – результаты активности алкогольдегидрогеназы
№ |
Образец |
Повторность |
A при t=0 |
A при t=90 сек |
dA |
V, мкМ/мин |
|||
ADH, мкл |
Этанол, мкл |
Буфер, мкл |
NAD, мкл |
||||||
1 |
10 |
25 |
1960 |
10 |
1 |
0,0468 |
0,0759 |
0,0291 |
3,12 |
2 |
0,0434 |
0,065 |
0,0216 |
2,32 |
|||||
3 |
0,0446 |
0,0674 |
0,0228 |
2,44 |
|||||
2 |
20 |
25 |
1950 |
20 |
1 |
0,046 |
0,0966 |
0,0506 |
5,42 |
2 |
0,0458 |
0,0786 |
0,0328 |
3,52 |
|||||
3 |
0,0471 |
0,0928 |
0,0457 |
4,90 |
|||||
3 |
40 |
25 |
1930 |
40 |
1 |
0,0468 |
0,1169 |
0,0701 |
7,51 |
2 |
0,0457 |
0,0987 |
0,053 |
5,68 |
|||||
3 |
0,059 |
0,1245 |
0,0655 |
7,02 |
|||||
4 |
80 |
25 |
1890 |
80 |
1 |
0,0526 |
0,1553 |
0,1027 |
11,01 |
2 |
0,0561 |
0,1679 |
0,1118 |
11,98 |
|||||
3 |
0,0596 |
0,1793 |
0,1197 |
12,83 |
|||||
5 |
160 |
25 |
1810 |
160 |
1 |
0,0732 |
0,2496 |
0,1764 |
18,91 |
2 |
0,0697 |
0,2445 |
0,1748 |
18,74 |
|||||
3 |
0,0676 |
0,2508 |
0,1832 |
19,64 |
|||||
Таблица 2 – линерализации методом Лайнуивера-Берка
СNAD, мкM |
V, мкМ/мин |
1/СNAD, (мкM)-1 |
1/V, мин /мкМ |
0,012 |
2,62594 |
83,33333 |
0,380816 |
0,024 |
4,61236 |
41,66667 |
0,216809 |
0,048 |
6,73812 |
20,83333 |
0,148409 |
0,096 |
11,94 |
10,41667 |
0,083752 |
0,192 |
19,0925 |
5,208333 |
0,052377 |
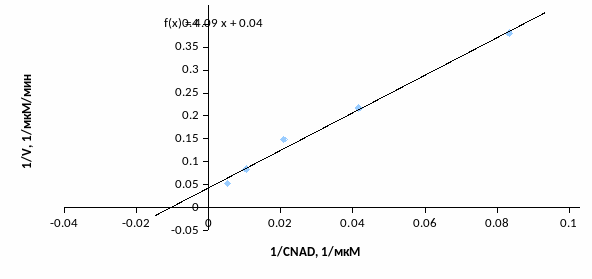
Рис. 2 – График линерализации методом Лайнуивера-Берка
Исходя из графика получаем, что 1/KM = 0,01, а 1/Vmax = 0,044. Отсюда KM = 93; Vmax = 22,7
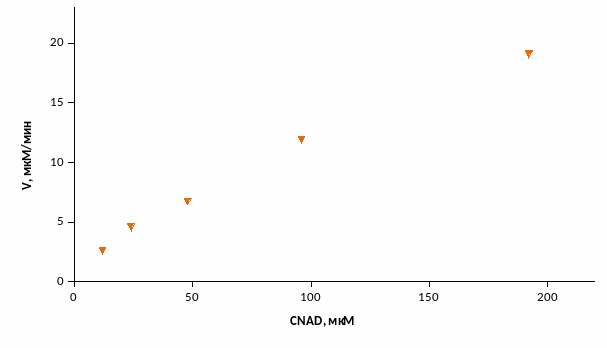
Рис. 3 – График зависимости скорости реакции от концентрации
ВЫВОДЫ
Скорость ферментативной реакции увеличивается с ростом концентрации NAD.
Методом линерализации Лайнуивера-Берка была определена Константа Михаэлиса KM = 93 мкМ/л и максимальная скорость исследуемой реакции Vmax = 22,7 мкМ/мин. По определённым величинам была построена теоретическая кривая ферментативной реакции, которая хорошо соотносится с эксперементальными данными. Значение константы Михаэлиса KM = 93 мкМ/л отличается от литературных данных KM = 36 мкМ/л [1]. По-видимому, это было вызвано погрешностями, образовавшимися при линерализации, а также небольшим количеством измерений.
ДОПОЛНИТЕЛЬНЫЕ ИСТОЧНИКИ ЛИТЕРАТУРЫ
Тишков В. И., Пометун А. А. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА И БЕЛКОВАЯ ИНЖЕНЕРИЯ БАКТЕРИАЛЬНОЙ И РАСТИТЕЛЬНОЙ ФОРМИАТДЕГИДРОГЕНАЗ.
