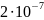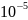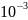Большой практикум / 8_Поляризация
.docxПоляризационные исследования флуоресценции биологических объектов
АННОТАЦИЯ
В ходе работы были зарегистрированы спектры и анизотропия люминесценции растворов с разной степенью связывания белка с красителем и на основе этого установлена константа диссоциации, равная 0,77 µМ. Полученная константа диссоциации совпадает с теоретической (K ≈ 0,7 µМ). Значения анизотропии возрастали с увеличением концентрации белка.
ВВЕДЕНИЕ
Флуоресценция молекул может стать важным источником информации о процессах, протекающих в биологических системах различной сложности. Экспериментальные методы детектирования излучения в оптическом диапазоне к настоящему времени развились настолько, что позволяют регистрировать испускание нескольких фотонов. Такая чувствительность делает флуоресцентную спектроскопию незаменимым инструментом для изучения живых систем на молекулярном уровне. При исследовании структуры и динамики биологических объектов с помощью природных и искусственных флуорофоров для получения необходимой информации могут быть использованы следующие параметры:
интенсивность люминесценции,
спектр флуоресценции (положение максимума, полуширина),
время жизни флуоресцентного состояния,
характеристики поляризации (или анизотропии) флуоресценции.
Последние параметры, изучаемые при возбуждении объекта поляризованным светом, являются источником важной информации как о характеристиках микроокружения излучающей частицы (вязкости среды, температуре и др.), так и о процессах, в которые объект исследования может быть вовлечен (денатурация белков, ассоциация белков между собой и с лигандами, связывании субстратов и др.)
Измерение фундаментальной анизотропии требует специальных условий. Для того чтобы исключить диффузионное вращение, флуорофоры помещают в стеклообразные растворы, такие, как пропиленгликоль при -70С. Кроме того, растворы должны быть достаточно разбавленными, чтобы исключить деполяризация из-за перепоглощения излучения или резонансного переноса энергии. При таких условиях флуорофоры остаются неподвижными в течение времени нахождения в возбужденном состоянии. Тогда измерение значения r0 позволяет определить угол между диполями поглощения и испускания . Так как ориентация диполей поглощения различна для каждой полосы поглощения, то угол и r0 меняются с длиной волны. Спектр анизотропии – это график зависимости анизотропии флуоресценции от длины волны для флуорофора в вязком разбавленном растворе. Обычно анизотропия не зависит о длины волны испускания, поэтому приводятся только спектры анизотропии возбуждения. Наибольшее значение r0, как правило, наблюдается для наиболее длинноволновой полосы поглощения. Это связано с тем, что флуоресценция обычно происходит из низшего флуоресцентного состояния, а оно также соответствует длинноволновой полосе поглощения (правило зеркальной симметрии). Следовательно, в поглощение и испускание вовлекается один и тот же электронный переход, который имеет приблизительно однонаправленные моменты. Большие значения (меньшие значения r0) получают при возбуждении в высшие электронные состояния, из которых обычно 15 не происходит испускания флуоресценции, поскольку флуорофоры быстрее релаксируют в низшее синглетное состояние. Спектр анизотропии выявляет углы между моментами переходов в поглощении и испускании, но направления этих моментов собственно в молекуле не определяет.
Часто квантовый выход флуорофора при связывании изменяется. Среднее значение анизотропии связано с долей от общего количества флуорофора, находящегося в связанном состоянии, выражением:
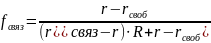
где fсвяз - доля от общего количества флуорофора, находящегося в связанном состоянии, rсвоб и rсвяз - анизотропии свободного и связанного флуорофоров соответственно, R - отношение квантовых выходов связанной и свободной форм.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристики флуоресценции красителя регистрируют на люминесцентном спектрометре Aminco-Bowman Series 2 (Thermo Spectronics, США). Для правильного управления работой данного прибора рекомендуется до начала эксперимента ознакомиться с его инструкцией по эксплуатации.
Образец помещают в стеклянную или кварцевую кювету 10х10 мм. Минимальный объем исследуемого раствора – 1,5 мл.
Измерение анизотропии флуоресценции проводят с помощью специального модуля люминесцентного спектрометра, включающего автоматически управляемые поляризаторы, расположенные на оптическом пути возбуждающего и испускаемого света. Перед началом работы на приборе следует убедиться, что поляризаторы правильно установлены, т.е. размещены на оптическом пути прибора.
Для определения константы связывания красителя с белком необходимо провести измерение параметров флуоресценции красителя (спектра испускания и анизотропии флуоресценции) в присутствии и отсутствии белка. Концентрация красителя и чувствительность регистрирующей системы (напряжение на ФЭУ и ширина щелей монохроматоров) в течение всего эксперимента должны оставаться неизменными.
РЕЗУЛЬТАТЫ
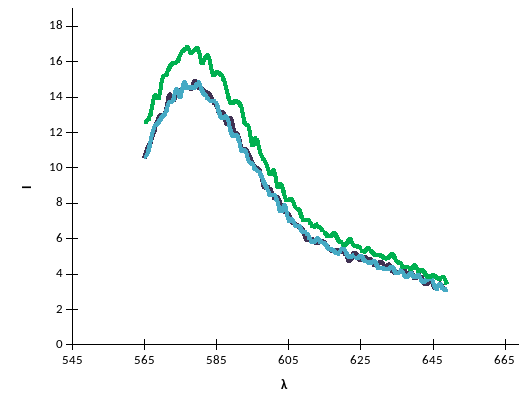

С=10-3
С=10-5
С=0
Рис. 1 – Спектры люминесценции красителя в присутствии белка разных концентраций
Таблица 1 — Характеристики флуоресценции красителя в присутствии белка разных концентраций
№ |
Концентрации, М |
Характеристики флуоресценции |
||||
Краситель |
Белок |
max, нм |
Imax, отн.ед |
P |
r |
|
1 |
|
0 |
579 |
14,884 |
0,01375 |
0,00921 |
2 |
|
|
580 |
14,8228 |
0,03692 |
0,02492 |
3 |
|
|
577 |
16,8024 |
0,1294 |
0,09019 |
fсвяз = 0,175742
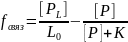
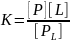
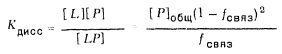 [1]
[1]
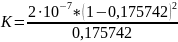
K=0,77
ВЫВОДЫ
Реакции ассоциации приводят к изменению структуры молекулы и соответственно к изменению анизотропии люминесценции.
Уровень анизотропии возрастает с увеличением концентрации белка.
На основе анализа анизотропии растворов с разной степенью связывания белка с красителем была установлена константа диссоциации 0,77 µМ.
Полученная константа диссоциации совпадает с теоретической (K ≈ 0,7 µМ) [2].
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Лакович Д., Козьменко М. В., Савицкий А. П. Основы флуоресцентной спектроскопии. – Мир, 1986.
Zhang Y., Görner H. Photoprocesses of xanthene dyes bound to lysozyme or serum albumin //Photochemistry and photobiology. – 2009. – Т. 85. – №. 3. – С. 677-685.