
Большой практикум / 6_Абсорбционная спектроскопия_белки
.docxАбсорбционная спектроскопия макромолекул: белки
Аннотация
Работа посвящена изучению абсорбционной спектроскопии белков. Были сняты и проанализированы спектры поглощения растворов белка (бычьего сывороточного альбумина), триптофана и тирозина, растворённых в калий-фосфотном буфере и растворе гидроксида натрия.
Было установлено, что спектр поглощения бычьего сывороточного альбумина (БСА) достигает пика на той же длине волны, что и спектр триптофана (279 нм). Обе аминокислоты проявили pH зависимость спектра поглощения. Повышение pH сдвигает спектр в длинноволновую область. При денатурации БСА мочевиной спектр белка не изменял свою форму, оптическая плотность растворов повышалась.
ВВЕДЕНИЕ
Под первичной структурой белков понимают линейную цепочку аминокислот, соединённых ковалентными связями.
Вторичная структура белка формируется в результате ближнего взаимодействия боковых цепей, в результате чего белок может укладываться в такие структуры как:
спирали, которые могут быть левозакрученными и правозакрученными с разным периодом и шагом. Большинство спиральных структур в полипептидных цепях поддерживается внутримолекулярными водородными связями. Водородная связь при этом образуется между карбонильной группой одного аминокислотного остатка и аминогруппой другого, лежащего ближе к N-концу полипептида.
β-листы (β-структура, складчатые слои) — зигзагообразные структуры, в которых водородные связи образуются между относительно удалёнными друг от друга в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали.
полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях, богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно.
повороты — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин «петля».
полуповороты, или переходы, — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 90°.
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Третичная структура в значительной степени определяется первичной структурой. В стабилизации третичной структуры белка принимают участие ковалентные связи (между двумя остатками цистеина — дисульфидные мостики), ионные связи между противоположно заряженными боковыми группами аминокислотных остатков, водородные связи, гидрофильно-гидрофобные взаимодействия (ри взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора, тогда на поверхности молекулы оказываются полярные гидрофильные боковые группы).
Четвертичная структура — это и количество, и способ укладки полипептидных цепей (протомеров, субъединиц) в пространстве. Характерна для белков, построенных из двух или более пептидных цепей (олигомеров).
Оптическая плотность в спектроскопии — это мера ослабления света прозрачными объектами растворами. Вычисляется как десятичный логарифм отношения потока излучения, падающего на объект, к потоку излучения прошедшего через образец:
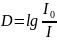 (1)
(1)
Коэффициент молярной экстинкции (ɛ) является характеристикой того, насколько сильно химическое вещество поглощает свет на заданной длине волны. Коэффициент является неотъемлемым свойством данного вещества.
Закон Бугера — Ламберта — Бера — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде. Закон выражается следующей формулой:
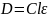 (2)
(2)
где D - оптическая плотность раствора, l - длина пути, которую прошёл пучок света в растворе, ɛ - коэффициент молярной экстинкции.
МАТЕРИАЛЫ И МЕТОДЫ
Измерение поглощения осуществляется с помощью спектрофотометра. С помощью этого прибора измеряют отношение двух потоков оптического излучения. Один поток падает на исследуемый образец, а другой поток испытывает какое – либо взаимодействие с данным образцом. Спектрофотометр производит измерения для различных длин волн оптического излучения. В результате этих операций получается спектр отношений потоков. Схема использованной установки представлена на рисунке 1.
1

Были приготовлены растворы белка (С = 1·10-5 М) в калий-фосфатном буфере (С = 0,05 М), растворы триптофана (С = 5·10-5 М), тирозина (С = 5·10-4 М) в калий-фосфатном буфере (С = 0,05 М) и растворе гидроксида натрия (С = 0,1 M). После снятия спектров поглощения к раствору белка добавлялся денатурирующий агент (мочевина) в объёме 0,1, 0,2, 0,3 и тд. мл, после чего снимались соответствующие спектры поглощения. Спектры регистрировались в диапазоне 320-400 нм.
РЕЗУЛЬТАТЫ
Максимумы поглощения исследуемых растворов представлены в таблице 1. Коэффициент молярной экстинкции находили по закону Бугера — Ламберта — Бера (формула 2).
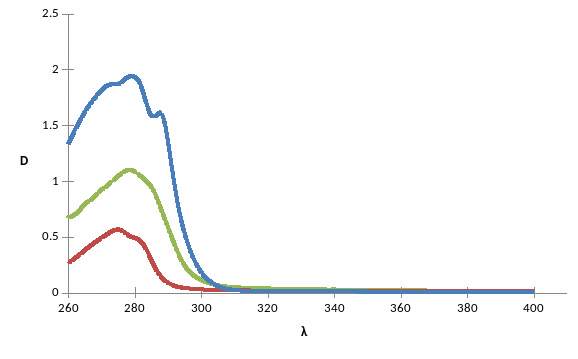
Рис. 1 — спектры поглощения триптофана, тирозина и БСА в калий-фосфатном буфере
Таблица 1 — максимумы поглощения растворов триптофана (С = 5·10-5 М), тирозина (С = 5·10-4 М) и бычьего сывороточного альбумина (С = 1·10-5 М).
№ |
Образец |
Максимум поглощения |
||
, нм |
D |
, M-1 см-1 |
||
1 |
Trp + NaOH |
281 |
1,894 |
37880 |
2 |
Trp + buf |
279 |
1,942 |
3884 |
3 |
Tyr + NaOH |
293 |
0,968 |
19360 |
4 |
Tyr + buf |
275 |
0,566 |
1132 |
5 |
Альбумин + buf |
279 |
1,1 |
110000 |
6 |
Альбумин + buf + 0,1 мл мочевины |
278 |
1,063 |
106300 |
7 |
Альбумин + buf + 0,2 мл мочевины |
278 |
1,029 |
102900 |
8 |
Альбумин + buf + 0,3 мл мочевины |
279 |
0,976 |
97600 |
9 |
Альбумин + buf + 0,4 мл мочевины |
279 |
0,94 |
94000 |
10 |
Альбумин + buf + 0,5 мл мочевины |
279 |
0,91 |
91000 |
11 |
Альбумин + buf + 0,6 мл мочевины |
279 |
0,878 |
87800 |
12 |
Альбумин + buf + 0,7 мл мочевины |
279 |
0,848 |
84800 |
13 |
Альбумин + buf + 0,8 мл мочевины |
279 |
0,821 |
82100 |
14 |
Альбумин + buf + 0,9 мл мочевины |
279 |
0,792 |
79200 |
15 |
Альбумин + buf + 1,0 мл мочевины |
279 |
0,767 |
76700 |
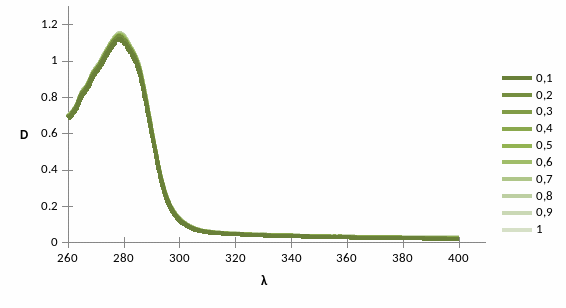 Рис.
2 —
спектры поглощения БСА при добавлении
мочевины
Рис.
2 —
спектры поглощения БСА при добавлении
мочевины
Таблица 2 — нормированные максимумы поглощения растворов БСА
№ |
Количество добавляемой мочевины, мл |
, нм |
D |
, M-1 см-1 |
1 |
0,1 |
278 |
1,11615 |
111615 |
2 |
0,2 |
278 |
1,1319 |
113190 |
3 |
0,3 |
279 |
1,1224 |
112240 |
4 |
0,4 |
279 |
1,128 |
112800 |
5 |
0,5 |
279 |
1,1375 |
113750 |
6 |
0,6 |
279 |
1,1414 |
114140 |
7 |
0,7 |
279 |
1,1448 |
114480 |
8 |
0,8 |
279 |
1,1494 |
114940 |
9 |
0,9 |
279 |
1,1484 |
114840 |
10 |
1,0 |
279 |
1,1505 |
115050 |
ВЫВОДЫ
Спектр поглощения бычьего сывороточного альбумина (БСА) достигает пика на той же длине волны, что и спектр триптофана (279 нм). По-видимому, БСА на поверхности имеет больше триптофановых остатков, чем тирозиновых.
Обе аминокислоты проявили pH зависимость спектра поглощения. Повышение pH сдвигает спектр в длинноволновую область. Возможно, это происходит ввиду повышения диссоциации фенольного кольца.
При денатурации БСА мочевиной спектр белка не изменял форму спектра, оптическая плотность повышалась.
