
Когай / химия
.pdf
1.Типы химических связей в органических соединениях. Виды гибридизации атома углерода: (рисунки гибридизованных и негибридизованных орбиталей).
Химическая связь – совокупность взаимодействий между электронами и ядрами, приводящих к
соединению атомов в молекулу. Основной тип – ковалентные связи.
Ковалентная связь - связь, образованная за счет обобществления электронов связываемых
атомов. Свойства ковалентных связей:
1)Энергия ковалентных связей зависит от степени перекрывания атомных орбиталей: чем больше перекрывание – тем прочнее связи.
2)Связи направлены в пространстве определенным образом. Направление связей зависит от
геометрии атомных орбиталей и способа их перекрывания.
3)Связи бывают неполярными и полярными.
Неполярные – образованы атомами с одинаковой ЭО. CH3-CH3, Cl-Cl, H-H Полярная – образованы атомами с разной электроотрицательностью.
Донорно-акцепторная или координационная связь – это ковалентная связь, в которой один атом
(донор) предоставляет не поделенную пару электронов, а другой (акцептор) – свободную орбиталь.
Водородная связь – связь между атомом водорода и сильно электроотрицательным элементом (O, N, F, S, Cl). Водородные связи могут быть внутримолекулярными и межмолекулярными.
Виды гибридизации атома углерода
Гибридизация - это смешивание валентных электронных облаков и образование качественно новых, равноценных гибридных валентных электронных облаков.
При образовании химических связей у атома углерода происходит гибридизация.
Основное состояние атома углерода: |
возбужденное: |
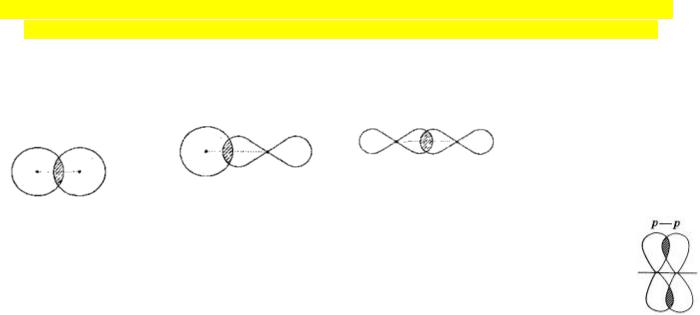
2.Характеристика σ- и π-связей: способы образования, направленность в пространстве, (примеры соединений, в которых присутствуют σ- и π-связи). Энергия σ- и π-связей.
Свойство σ-связи: σ-связь цилиндрически симметрична относительно линии связывания ядер атомов. Энергия диссоциации σ -связи = 88ккал/моль.
S-S- |
S-P |
P-P |
перекрывания |
|
|
|
|
|
Свойство π-связи: π-связь образуется в результате бокового перекрывания р- орбиталей. У атома после образования σ-связи остались неспаренные электроны, он
может использовать эти электроны на образование π-связи (при этом образуются двойные и тройные связи). π-связь цилиндрически несимметрична. Энергия диссоциации π-связи = 60ккал/моль.
Примеры соединений: σ: метан, этан; σ и π: этилен, ацетилен

3.Механизм цепных радикальных реакций. Основные стадии цепных радикальных реакций (на примере галогенирования алканов). Типы генерирования радикалов. Ингибиторы и инициаторы цепных радикальных реакций.
Радикал – атом или группа атомов, имеющая неспаренный электрон
Особенности:
•один первичный акт активации приводит к превращению огромного числа молекул исходных
веществ в радикалы
•любая цепная радикальная реакция включает 3 стадии: зарождение, рост, обрыв цепи
•отдельные реакции радикального процесса протекают с разными скоростями
2. |
Рост цепи: |
|
|
|
|
|
2 |
|
2 ∙ |
|||||||
1. |
Зарождение цепи: |
|
|
|
|
|
|
|||||||||
Основные стадии: |
|
|
|
|
|
|
|
|
∙ + |
|||||||
|
|
3 ∙∙ + ∙ → 3 |
||||||||||||||
|
3 |
∙ + |
∙∙ → 3 |
− + ∙ |
||||||||||||
3. |
|
|
|
∙ |
+ ∙ |
→ 2 |
|
|
|
|||||||
Обрыв цепи: |
|
∙ → |
3 − |
|
|
|||||||||||
|
|
3 |
∙ + |
|
||||||||||||
Типы |
|
|
∙ |
+ |
∙ → |
|
|
− |
||||||||
|
генерирования3 3 радикалов3 |
: |
|
3 |
||||||||||||
|
¦: |
→ |
− |
++: − |
|
|
|
|
|
|||||||
1. |
− |
| ¦ |
|
|
|
| |
|
|
, X=F,Cl,Br |
|||||||
|
| ¦ |
|
|
|
|
|
| |
|
|
|||||||
3. |
¦: → |
− |
:− + + |
|
|
|
|
|||||||||
− |
| ¦ |
|
|
|
|
| |
; |
|
|
, Z=Li,Na,K |
||||||
2. |
|
| ¦ |
|
∙ |
|
|
|
| |
|
∙ |
||||||
|
|
|
+ ∙ |
|
+ ∙ → |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ингибиторы2 |
|
и инициаторы: |
|
|
|
|
|
|||||||||
Хлорирование пропана: |
|
2 ∙ |
|
|||||
2. |
Рост цепи: |
|
|
2 |
∙ + 2 |
|||
1. |
|
3 2 3 + |
∙ 3 2 2 |
|||||
Зарождение цепи: |
|
|
|
|
→ |
|||
|
|
|
|
|
→ |
|
|
|
3. |
Обрыв → 3 2 2 |
− |
|
|
– ∙ |
|||
− + 3 2 3 |
||||||||
|
|
|
∙ + ∙ |
→; |
2 |
|
|
|
|
∙ 3 7 + ∙ → 3 7 |
− (3 алк) |
|
|||||
|
цепи: |
∙ → 6 14 |
|
|
; |
|
||
|
∙ 3 7 + 3 |
7 |
|
|
|
|
||
Образование активной частицы на стадии зарождения цепи с разрывом химической связи протекает при особых условиях (высокая t, hv, ионизирующее излучение), а также в присутствии инициаторов.
Ингибиторы – тормозят реакцию. Например, реакция галогенирования алканов замедляется в присутствии кислорода. Кислород взаимодействует с алкильными радикалами, образуя мало реакционноспособный перекисный радикал, который обрывает цепь: СН3 • + О2 → СН3 –О–О•
Инициатор (ускоряет реакцию, расходуются в ходе реакции) - вещества, при нагревании которых
происходит гомолитический разрыв связи с образованием активных радикалов, начинающих цепную реакцию.
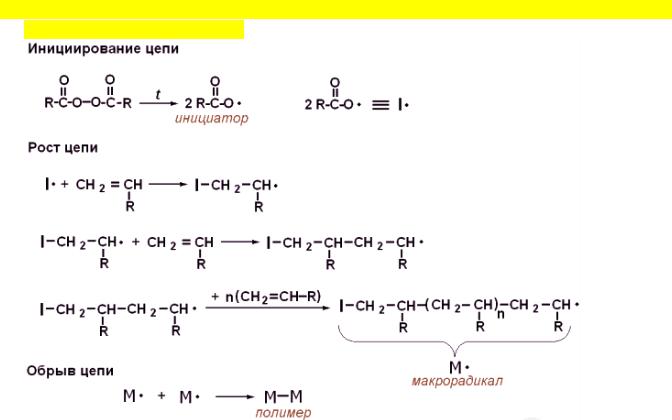
4.Механизм радикальной цепной реакции полимеризации алкенов. Инициаторы (виды и температуры их разложения)
2-этилгексилпероксидикарбонат – 47 ºС
Дибензоилпероксид – 70 ºС Персульфат калия – 90 ºС
2,3-Диметил-2,3-дифенилбутан – 240 ºС
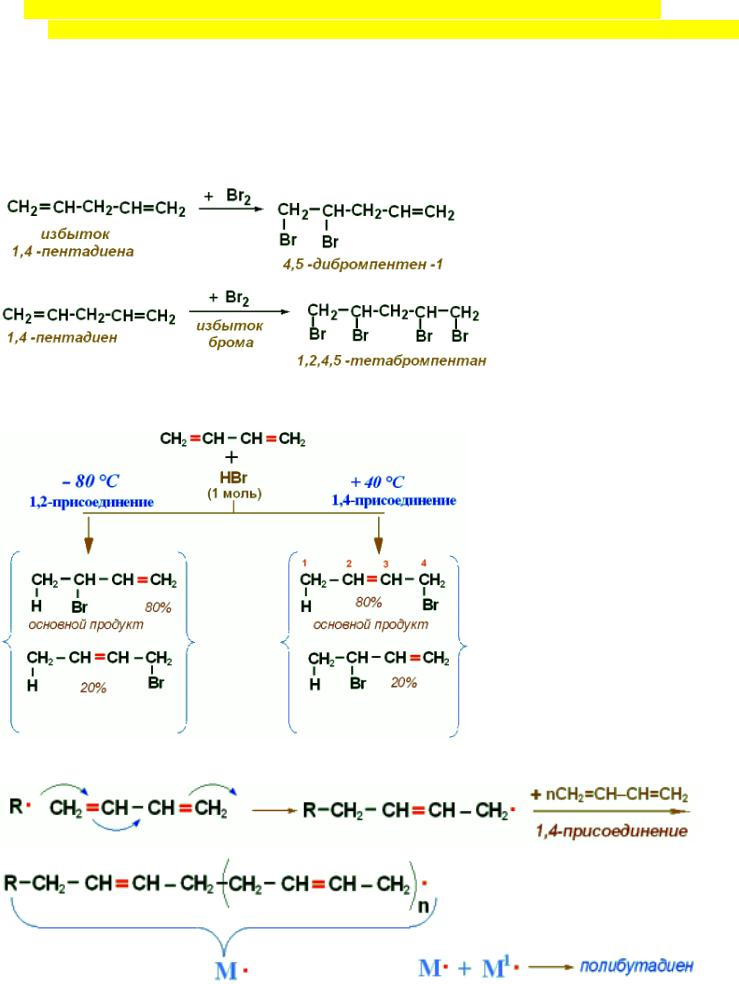
5.Особенности строения сопряженных диенов. Отличие сопряженных диенов от не сопряженных диенов (на примерах реакций). Реакция полимеризации сопряженных диенов.
H2C=CH-HC-CH2
Сопряженные диены отличаются от алкенов тем, что они: вступают в реакции 1,4-присоединения, более реакционноспособны чем алкены, термодинамически более устойчивы.
В диенах с изолированными двойными связями, двойные связи реагируют независимо, т.е. так, как если бы они находились в разных молекулах:
В диенах с сопряженными связями p-орбитали, образующие сопряженные π-связи, составляют
общую систему, т.к. частично перекрываются:
Реакция радикальной полимеризации протекает предпочтительно как 1,4-присоединение:

6.Ароматичность. Правило Хюккеля. Бензоидные и не бензоидные ароматические соединения. Примеры. Строение бензола.
Ароматичность – понятие, характеризующее совокупность особых структурных, энергетических и магнитных свойств, а также особенностей реакционной способности циклических структур с системой сопряженных связей.
Правило Хюккеля: к ароматическим системам (соединениям, катионам, анионам) относятся плоские
циклические системы, содержащие 4n+2, где n=0,1,2,3, делокализированных π-электронов.
Бензоидные соединения - арены и структурные производные аренов, содержат бензольные ядра. (нафталин, толуол).
Небензоидные соединения - все остальные ароматические соединения (фуран, пиридин).
Строение бензола: по правилу Хюккеля n = 1,
Хюккелевское число электронов (4n + 2) = 6
Каждый атом углерода в sp2-гибридизациии и связан с двумя соседними атомами углерода и атомом водорода тремя s-связями.
7.Механизм электрофильного замещения в ароматических соединениях: строение π-σ- комплекса. Лимитирующая стадия реакции. Зависимость скорости реакции электрофильного замещения от устойчивости σ-комплекса.
Лимитирующая стадия реакции: если реакция состоит из нескольких стадий, протекающих с разными скоростями, то общая скорость реакции определяется скоростью самой медленной стадии
– лимитирующей стадии.
Устойчивость σ-комплексов зависит от числа и природы заместителей в бензольном кольце. Чем устойчивее σ-комплекс, тем он более реакционноспособен.
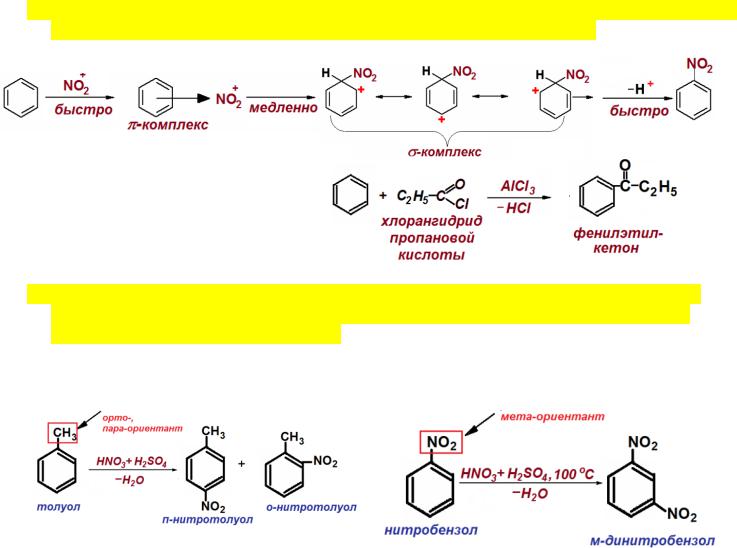
8.Механизм электрофильного замещения в ароматических соединениях. (В общем виде и на примере одного из типов реакций: алкилирования, ацилирования и т.д.).
Нитрование бензола
Ацилирование бензола хлорангидридом пропановой кислоты
9.Правила ориентации в бензольном кольце: ориентанты 1-го и 2-го рода. Влияние типа заместителя, уже находящегося в бензольном кольце, на скорость замещения вновь поступающего заместителя. Примеры.
1 род: орто-пара-ориентанты. Относят |
2 род: мета-ориентанты. Относят |
электронодонорные заместители: |
электроноакцепторные заместители: |
-OH, -NH2, -OR, -R, -Ar |
-C≡N, -COOH, -C=O, -SO3H, -CX3, -NO2 |
Электронодонорные заместители, |
Электроноакцепторные заместители, |
находящиеся в бензольном кольце, |
находящиеся в бензольном кольце, |
ускоряют реакции замещения по сравнению |
замедляют аналогичные реакции. |
с реакциями в незамещенном бензоле. |
|

10.Кислотность карбоновых кислот, фенолов, спиртов. Константа кислотности карбоновых кислот. Сравнение кислотности карбоновых кислот с кислотностью спиртов и фенолов (на примерах реакций). Зависимость силы карбоновых кислот от заместителей, находящихся в α- положении к карбоксильной группе.
Карбоновые кислоты более сильные кислоты, чем вода. Их тенденция отдавать ион водорода
такова, что в водном растворе существует измеримое равновесие между кислотой и ионами, таким образом карбоновые кислоты гораздо более+кислые2: : . − + 3 +
Кислотность фенола гораздо выше кислотности этанола. Электроноакцепторные заместители в бензольном кольце увеличивают кислотность фенолов.
Спирты являются очень слабыми кислотами. Это объясняется тем, что алкоксид-ион,
образующийся при диссоциации спирта, содержит на атоме кислорода большую электронную
плотность по сравнению с гидроксид-ионом. |
|
= |
[ ] |
Усиление кислотных свойств: спирты, вода, фенолы, карбоновые кислоты. |
|||
Кислотность карб.к-т характеризуется константой кислотности: |
|
|
[ −][ 3 +] |
Сравнение кислотности:
Спирты, как кислоты, реагируют со щелочными металлами, образуя алкоголяты: 2 ROH + 2 Na → 2 RONa + H2
Фенолы в отличие от спиртов в обычных условиях реагируют со щелочами, образуя феноляты:
С6H5OH + NaOH → С6H5ONa + H2O
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями:
2RCOOH + 2Na = 2RCOONa + H2
RCOOH + NaOH = RCOONa + H2O
2RCOOH + Na2CO3 = 2RCOONa + H2O + CO2
Зависимость силы карбоновых кислот от заместителей, находящихся в α-положении к карбоксильной группе:
Электроноакцепторные заместители должны рассредоточивать отрицательный заряд, стабилизовать анион и тем самым увеличивать кислотность.
Электронодонорные заместители должны усиливать отрицательный заряд, дестабилизовать анион и тем самым уменьшать кислотность.
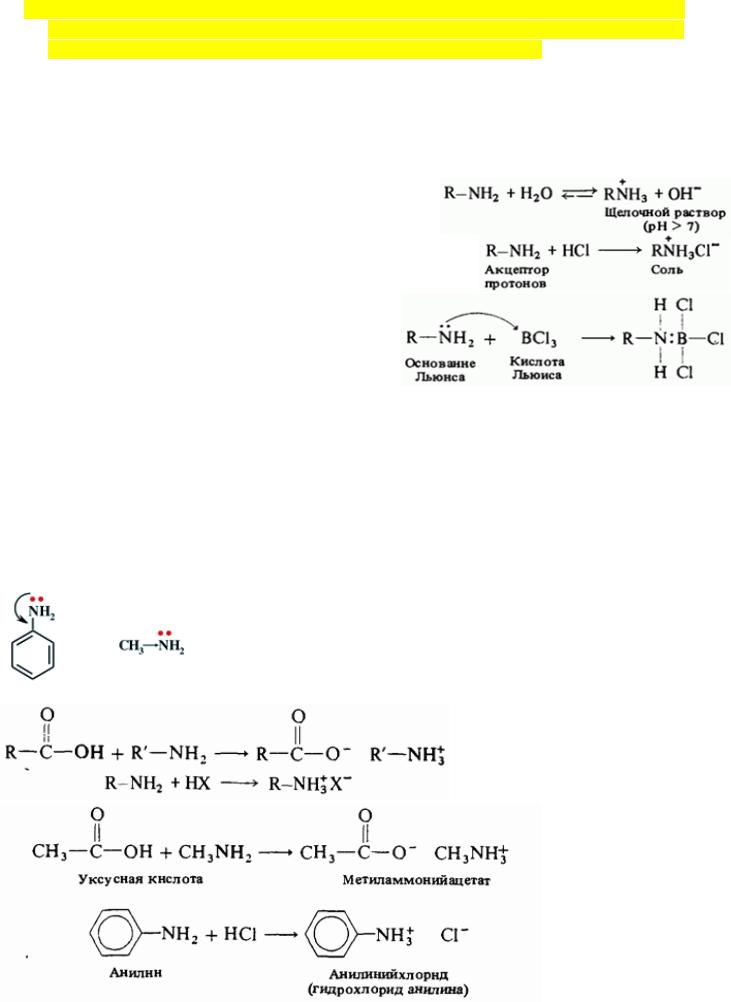
11.Основность аминов. Константа основности. Сравнение основности алифатических и ароматических аминов; причины различия их основности. Взаимодействие аминов с органическими и неорганическими кислотами (примеры реакций).
Амины являются единственным классом органических соединений, обладающих заметной основностью. Однако амины — слабые основания.
Основность аминов обусловлена наличием не поделенной пары электронов на атоме азота. Окрашивают лакмус в синий цвет, рН водных растворов аминов > 7.
1.Кислотно-основное взаимодействие воды и амина
2.Амины реагируют с кислотами, выступая акцептором протонов (основные свойства)
3.Амины являются донором электронной пары (основание Льюиса)
Основность убывает: вторичные-первичные- третичные-NH3-ароматические амины
Константа основности: мера основности вещества,
|
[ 3+][ −] |
которая представляет собой константу равновесия взаимодействия амина с водой. |
|
= |
[ 2] |
Чем сильнее оснвоание, тем большее число протонов будет оторвано от молекул воды и выше будет концентрация гидроксид-ионов в растворе. Таким образом более сильные основания характеризуются большими значениями константы основности.
Основность алифатических и ароматических аминов:
Основность ароматических аминов намного ниже, чем у
алифатических аминов.
Так как не поделенная электронная пара азота участвует в π- cопряжении с электроным облаком ароматического кольца, поэтому протону Н труднее присоединиться к ней.
Взаимодействие аминов с органическими и неорганическими кислотами:
