
- •2. Распределение электронов в атоме. Периодическая система элементов д. И. Менделеева.
- •2. Классификация элементарных частиц, лептоны, адроны. Свойства элементарных частиц (заряд, спин и т.Д.). Античастицы. Кварковая модель адронов.
- •2. Квантовые числа (главное, орбитальное, спиновое). Распределение электронной плотности в атоме, орбитали, заполнение электронов в элементах периодической таблицы.
- •2. Понятие оператора физической величины, собственных значений. Оператор импульса, кинетической энергии. Уравнение Шрёдингера.
- •2. Радиоактивность, виды. Единицы радиоактивности (Рентген, Зиверт, Кюри…). Прохождение частиц и гамма-излучения через вещество, защита от радиации. Радионуклидный анализ.
- •2. Тепловое излучение. Понятие абсолютно черного тела, серого тела. Закон Стефана-Больцмана, закон излучения Кирхгоффа. Закон смещения Вина. Формула Планка для излучения абсолютно черного тела.
- •Принцип действия
- •Принципиальное устройство синхротрона
- •2. Тонкая структура спектров. Спин электрона. Опыт Штерна-Герлаха.
- •2. Внешний фотоэффект и его законы. Уравнение Эйнштейна. Внутренний и вентильный фотоэффекты. Практическое применение фотоэффекта.
- •2. Рентгеновские спектры. Закон мозли.
1. 1. Спектр атомарного водорода, серии Лаймана, Бальмера, Пашена, Модель водорода по Бору (постулаты Бора, вывод радиуса орбит, энергии электрона), спектральные линии водорода.
Изолированные атомы в виде разреженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий → спектр испускания атомов – линейчатый.
Спектр — распределение значений физической величины (обычно энергии, частоты или массы). Обычно под спектром подразумевается электромагнитный спектр — распределение интенсивности электромагнитного излучения по частотам или по длинам волн.
Спектральная линия — линия в спектре электромагнитного излучения атомов, молекул и других квантовых систем. Излучение, соответствующее данной спектральной линии, характеризуется определенной длиной волны и, следовательно, частоты. Каждая спектральная линия отвечает определенному квантовому переходу.
Линии в спектрах расположены не беспорядочно, а объединяются в группы — серии линий.
С пектральная
серия
— набор спектральных
линий,
которые получаются при переходе
электронов
с любого из вышележащих термов
(состояние электронной подсистемы,
определяющая энергетический уровень,
энергия данного уровня) на один
нижележащий, являющийся основным для
данной серии.
пектральная
серия
— набор спектральных
линий,
которые получаются при переходе
электронов
с любого из вышележащих термов
(состояние электронной подсистемы,
определяющая энергетический уровень,
энергия данного уровня) на один
нижележащий, являющийся основным для
данной серии.
Рис.1: Часть спектра атомарного водорода в видимой УФ-области. Линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Б альмер
обнаружил, что длины волн серии водорода
могут быть точно предсталены формулой:
альмер
обнаружил, что длины волн серии водорода
могут быть точно предсталены формулой:
Е![]() сли
перейти от длины волны λ к частоте ω, то
получится такая формула
Бальмера,
а соответствующая ей серия спектральных
линий – серия
Бальмера.
сли
перейти от длины волны λ к частоте ω, то
получится такая формула
Бальмера,
а соответствующая ей серия спектральных
линий – серия
Бальмера.
– постоянная ридберга R=2,07*1016 c-1
В спектре водорода имеется несколько серий. В УФ-части спектра — серия Лаймана, а в инфракрасной области — серия Пашена.
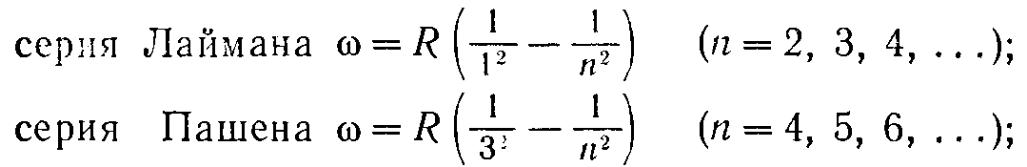
Частоты всех линий спектра водородного атома можно представить формулой, которая носит название обобщенная формула Бальмера:
![]() ,
где m-значение
1 для серии Бальмера, 2 для Лаймана, 3 для
Пашена и тд. При заданном m
число n
принимает все целочисленные значения,
начиная с m+1.
,
где m-значение
1 для серии Бальмера, 2 для Лаймана, 3 для
Пашена и тд. При заданном m
число n
принимает все целочисленные значения,
начиная с m+1.
Граница серии – предельное значение: R/m^2=T(n), к которому стремится при возрастании n частота линии каждой серии (H-бесконечность на рисунке с водородной серией). Частота любой линии спектра водорода может быть представлена в идее разности двух чисел близких границ серии. Эти числа будут называться термами. Так, частота первой линии Бальмера для водорода будет равна Т(2)-Т(3).
Модель атома Томпсона. Атом – равномерно заполненный положительным электричеством шар, внутри которого находится электрон. Суммарный заряд атома равен заряду электрона, так что в целом атом нейтрален.
Модель атома по Резерфорду. Атом – система зарядов, в центре которой расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена ядре. Электроны движутся вокруг ядра по искривленной траектории.
Эти теории не смогли объяснить устойчивость атома и характер атомного спектра, механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода (и ряда других атомов), оставались непонятными. Решил эту проблему датский физик Нильс Бор, сформулировав постулаты, противоречащие классическим представлениям. Он создал теорию строения атома, способную объяснить опыты Резерфорда и спектр излучения паров водорода.
Модель атома по Бору: Атом состоит из положительно заряженного ядра – протона, а также из отрицательно заряженного электрона, который вращается вокруг ядра по круговой орбите. Их заряды равны по абсолютному значению.
Постулаты Бора
Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям.Это означает, что электроны могут двигаться только по определенным орбитам, соотетствующим их стационарным состояниям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
Момент импульса электрона на этих орбитах кратен постоянной Планка:
![]() ,
где me
– масса электрона,
,
где me
– масса электрона,
![]() -
скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
-
скорость электрона на орбите с номером
n,
rn
– радиус орбиты с номером n,
n
=1,2,3,….
![]() Дж·с
– постоянная Планка.
Дж·с
– постоянная Планка.
И
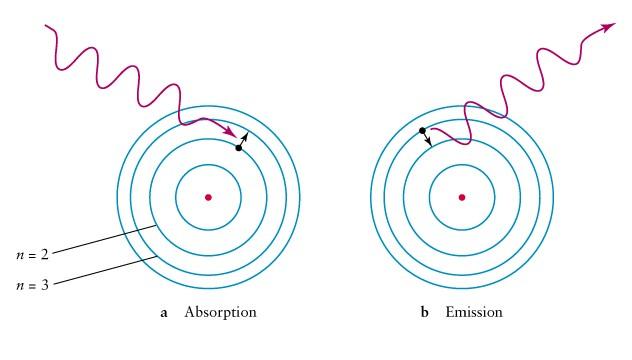 злучение
испускается или поглощается в виде
светового кванта энергии
злучение
испускается или поглощается в виде
светового кванта энергии
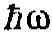 при переходе электрона из одного
стационарного (устойчивого) состояния
в другого. Величина
светового кванта
(энергия кванта) равна разности энергий
тех стационарных состояний, между
которыми совершается кантовый скачок
электрона:
при переходе электрона из одного
стационарного (устойчивого) состояния
в другого. Величина
светового кванта
(энергия кванта) равна разности энергий
тех стационарных состояний, между
которыми совершается кантовый скачок
электрона:
 ,
где E
n1
и
E
n2
-
энергия электрона в состоянии 1 и 2 (т.е.
на орбитах 1 и 2),
,
где E
n1
и
E
n2
-
энергия электрона в состоянии 1 и 2 (т.е.
на орбитах 1 и 2),
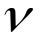 -
частота электромагнитных волн,
-
частота электромагнитных волн,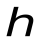 -
постоянная Планка.
-
постоянная Планка.
+М (момент импульса) = постоянная Планка*n
Радиус орбиты электрона в атоме водорода.
Согласно
1-му постулату Бора,
![]() .
.
Число n – главное кантовое число
Выразим скорость электрона:
![]() .
(3)
.
(3)
Рассмотрим круговые электронные орбиты. На электрон с зарядом -e со стороны ядра с зарядом +e действует сила Кулона F, сообщая электрону нормальное ускорение,
![]()
![]() .
.
По 2-му закону Ньютона,
 .
(4)
.
(4)
Сократим
![]() и
подставим скорость из (3):
и
подставим скорость из (3):
![]() .
.
Отсюда
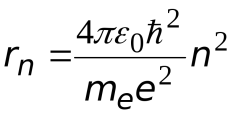 .
.
Радиус
первой орбиты электрона (n
= 1), называется радиусом
Бора
![]() или r0
или r0
![]() =
=
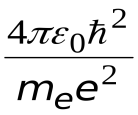
![]() 0.53·10-10
м.
0.53·10-10
м.
Радиус орбиты электрона в атоме водорода
![]() ,
n
=1,2,3,…. – номер орбиты.
,
n
=1,2,3,…. – номер орбиты.
Энергия электрона в атоме водорода.
Энергия
электрона представляет собой сумму
кинетической энергии
![]() и
потенциальной
и
потенциальной![]() (энергия взаимодействия электрона с
ядром)
(энергия взаимодействия электрона с
ядром)
![]() и
и
![]() .
.
Потенциальная
энергия – это энергия электрона с
зарядом
![]() в
электрическом поле ядра. Из уравнения
(4) видно, что
в
электрическом поле ядра. Из уравнения
(4) видно, что
![]() .
.
Тогда на n –ой орбите энергия электрона равна
![]() =
=
![]() =
=![]() .
.
Т.е. кинетическая энергия электрона равна полной энергии, взятой со знаком «-».
Также полную энергию можно записать через потенциальную:
=![]() ,
или
,
или
![]() .
.
Подставим
![]() .
Тогда
.
Тогда
![]() =
=
![]() .
.
Энергия на первой орбите (на первом энергетическом уровне) равна
![]() =
=
![]() =
-13,6 эВ.
=
-13,6 эВ.
Величину
![]() =
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
13,6 эВ = 2,18∙10-18
Дж
называют
энергией ионизации
(эта энергия необходима, чтобы перевести
электрон, находящийся на первом уровне,
в свободное состояние, т.е. чтобы
ионизовать атом). Окончательно, энергия
электрона на n
–ом
энергетическом уровне (на n
–ой
орбите) записывается как
=
![]() .
.
Спектр излучения водорода.
Энергия излучаемого или поглощаемого кванта:
![]() .
.
Частота
![]() ,
,![]() длина
волны,
длина
волны,![]() -
скорость света в вакууме.
-
скорость света в вакууме.
![]() =
=![]() +
+![]() =
=
![]() ,
,
![]() =
=
![]() .
.
=
![]() -
формула Бальмера,
-
формула Бальмера,
определяет длины волн в спектре атома водорода.
![]() =
1,1∙107
м-1
-
постоянная Ридберга.
=
1,1∙107
м-1
-
постоянная Ридберга.
![]() и
и
![]() -
номера энергетических состояний (номера
орбит) электрона.
-
номера энергетических состояний (номера
орбит) электрона.
Переходы электрона с возбужденных энергетических состояний на основной энергетический уровень ( = 1) сопровождаются излучением вУФ области спектра (серия линий Лаймана),
переходы на уровень с = 2 приводят к линиямв видимой области (серия Бальмера),
переходы на уровень с = 3, 4, 5, … приводят излучению в ИК области.
Теория Бора не смогла объяснить строение сложных атомов. Для объяснения поведения микрочастиц была развита квантовая механика.
Она основана на том, что любая микрочастица, наряду с корпускулярными, обладает также волновыми свойствами (гипотеза де Бройля).
2. Распределение электронов в атоме. Периодическая система элементов д. И. Менделеева.
Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
n, l – характеризуют размер и форму облака (орбиты),
ml – характеризует ориентацию электронного облака (орбиты) в пространстве:
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Определяет момент импульса в электроне. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы.
Орбитали с l = 0 называются s-орбиталями, l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 - d-орбиталями (5 типов), l = 3 - f-орбиталями (7 типов).
Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l до - l, включая 0. Например, при l = 1 число mпринимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: px, py, pz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона.
В нормальном (невозбужденном) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях. Поэтому, казалось бы, в любом атоме в нормально состоянии все электроны должны быть в состоянии 1s (n=1,l=0). Но это не так.
Почему? Принцип Паули. Формулировка принципа Паули, которая и была введена им в квантовую теорию (1925 г.) еще до построения квантовой механики: в одном и том же атоме (или в какой-либо квантовой системе) не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел: n, l, m, ms - одновременно два электрона не могут находиться в одном и том же состоянии.
Принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
М аксимальное
число электронов, находящихся в
состояниях, описываемых набором трех
квантовых чисел n,
l
и m,
и отличающихся только ориентацией
спинов электронов равно 2.
аксимальное
число электронов, находящихся в
состояниях, описываемых набором трех
квантовых чисел n,
l
и m,
и отличающихся только ориентацией
спинов электронов равно 2.
Спиновое число может принимать только 2 значения, поэтому в состояниях с данным значением n могут находиться в атоме не более 2n2 электронов:
С овокупность
электронов в многоэлектронном атоме,
имеющих одно и то же главное квантовое
число n,
называется электронной
оболочкой
или слоем.
Оболочки подразделяются на подоболочки,
отличающиеся значением квантового
числа l.
овокупность
электронов в многоэлектронном атоме,
имеющих одно и то же главное квантовое
число n,
называется электронной
оболочкой
или слоем.
Оболочки подразделяются на подоболочки,
отличающиеся значением квантового
числа l.
Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью. Вид основных типов орбиталей показан на рисунке:
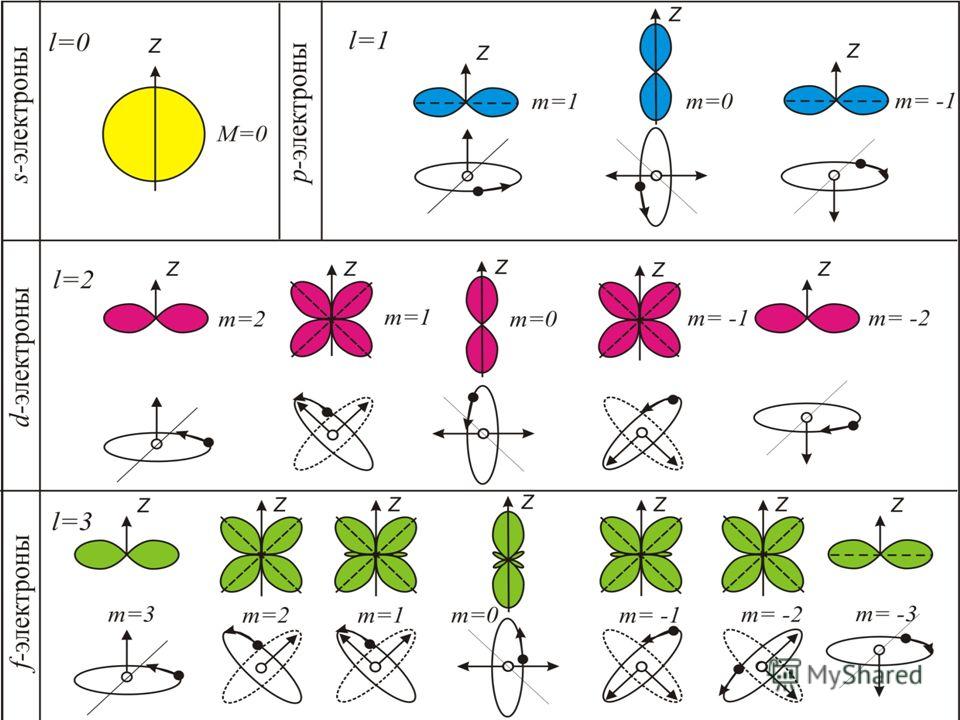
Поскольку орбитальное квантовое число принимает значения от 0 до -1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l + 1). Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам приведено в таблице
Главное квантовое число n |
1 |
2 |
3 |
4 |
5 |
||||||||||||
Символ оболочки |
K |
L |
M |
N |
O |
||||||||||||
Максимальное число электроновв оболочке |
2 |
8 |
18 |
32 |
50 |
||||||||||||
Орбитальное квантовое число l |
0 |
0 |
1 |
0 |
1 |
2 |
0 |
1 |
2 |
3 |
0 |
1 |
2 |
3 |
4 |
||
Символ подоболочки |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
5f |
5g |
||
Максимальное число электронов в подоболочке |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
10 |
14 |
18 |
||
т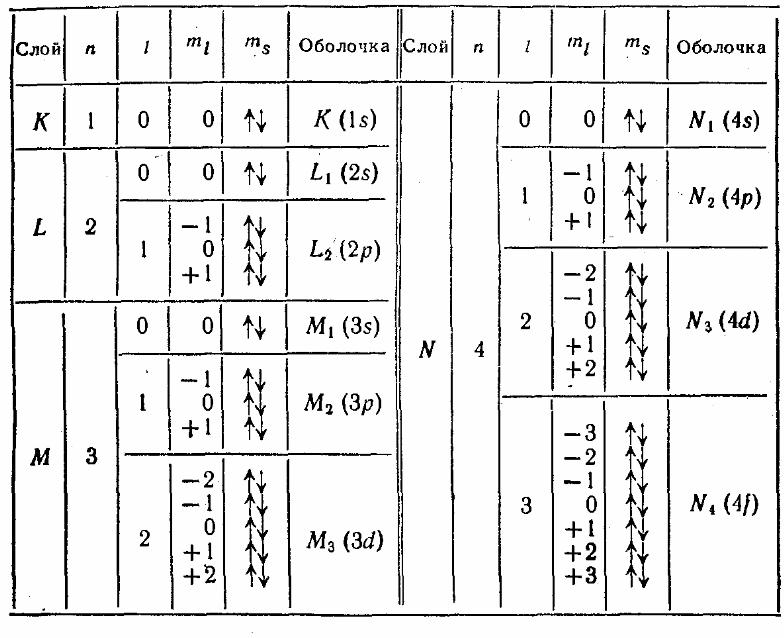 а
же таблица, но понятнее
а
же таблица, но понятнее
Таблица Менделеева
В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Объяснение периодическому закону дала квантовая теория атома.
В основе систематики химических элементов лежит заряд ядра атома, а не его атомная масса (Бор, 1922).
Заряд ядра любого атома выражается целым числом Z в единицах элементарного заряда е, равного заряду одного электрона, взятому со знаком плюс.
Число Z определяет номер химического элемента в периодической системе и называется его порядковым номером. Если атом электрически нейтрален, то число электронов в атомной оболочке равно Z.
Свойства элементов зависят от числа электронов в атомной оболочке и ее строения.
Химические свойства элементов определяются периферийными электронами.
Современное объяснение периодической системы элементов основано на трех принципах.
Принцип первый: состояние атомной оболочки характеризуется состояниями ее отдельных электронов, которые полностью определяются четырьмя квантовыми числами:
Принцип второй - Паули: В атоме может существовать только один электрон в состоянии, характеризуемом данными значениями четырех квантовых чисел. Это означает, что два электрона, связанные в одном и том же атоме, должны различаться значениями, по крайней мере, одного квантового числа.
Принцип третий: атом устойчив тогда, когда находится в состоянии с наименьшей возможной энергией (правило Хунда). Это означает, что при присоединении к системе нового электрона его энергия связи должна быть максимально возможной.
ОСТААЛЬНОЕ ГОВНО ПРО ЗАПОЛЕНИЕ НА БУМАЖКЕ ЕБУЧЕЙ
2. 1. Волны де Бройля, длина волны электрона, ускоренного в электрическом потенциале. Волновые свойства частиц, опыты Дэвиссона и Джермера.
Волны де Бройля – волны, связанные с любой движущейся материальной частицей. Любая движущаяся частица (например, электрон) ведёт себя не только как локализованный в пространстве перемещающийся объект - корпускула, но и как волна, причём длина этой волны даётся формулой λ = h/р, где h = 6.6·10-34 Дж.сек – постоянная Планка, а р – импульс частицы. Эта волна и получила название волны де Бройля (в честь французского физика-теоретика Луи де Бройля, впервые высказавшего гипотезу о таких волнах в 1923 г.). Если частица имеет массу m и скорость v << с (с – скорость света), то импульс частицы р = mv и дебройлевская длина волны связаны соотношением λ = h/mv.
Длина волны де Бройля тем меньше, чем больше масса частицы и её скорость. Например, частице с массой в 1 кг, движущейся со скоростью 1 м/с, соответствует волна де Бройля с длиной волны примерно равной 6,626*10^-34 м, что лежит далеко за пределом, доступным наблюдению. Поэтому волновые свойства несущественны в механике макроскопических тел. Для электронов же с энергиями от 1 эВ до 10 000 эВ длина волны де Бройля лежит в пределах от ~ 1 нм до 10−2 нм, то есть в интервале длин волн рентгеновского излучения. Поэтому волновые свойства электронов должны проявляться, например, при их рассеянии на тех же кристаллах, на которых наблюдается дифракция рентгеновских лучей
Свет обладает как волновыми, так и корпускулярными свойствами. Волновые свойства проявляются при распространении света (интерференция, дифракция). Корпускулярные свойства проявляются при взаимодействии света с веществом (фотоэффект, излучение и поглощение света атомами).
Свойства фотона как частицы (энергия E и импульс p) связаны с его волновыми свойствами (частотой ν и длиной волны λ) соотношениями
E = hν; p = hν / c = h / λ, |
|
|
Опыт Дэвиссона-Джермера
Проводилось
исследование отражения электронов от
монокристалла никеля. Установка включала
в себя монокристалл никеля, сошлифованный
под углом и установленный на держателе.
На плоскость шлифа направлялся
перпендикулярно пучок монохроматических
электронов. Скорость электронов
определялась напряжением U{\displaystyle
\ U} на
электронной пушке:

{\displaystyle \upsilon ={\sqrt {\frac {2eU}{m_{e}}}}.}Под углом {\displaystyle \ \theta } к падающему пучку электронов устанавливался цилиндр Фарадея, соединённый с чувствительным гальванометром. По показаниям гальванометра определялась интенсивность отражённого от кристалла электронного пучка. Вся установка находилась в вакууме.
В опытах измерялась интенсивность рассеянного кристаллом электронного пучка в зависимости от угла рассеяния {\displaystyle \ 0<\theta <90^{o},} от азимутального угла {\displaystyle \ 0<\varphi <360^{o}}, от скорости {\displaystyle \ \upsilon } электронов в пучке.
Опыты показали, что имеется ярко выраженная выборочность рассеяния электронов. При различных значениях углов и скоростей, в отражённых лучах наблюдаются максимумы и минимумы интенсивности. Условие максимума:
{\displaystyle
\ \Delta =2d\sin \theta =\lambda n,n=1,2,...}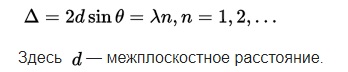
Таким образом наблюдалась дифракция электронов на кристаллической решетке монокристалла. Опыт явился блестящим подтверждением существования у микрочастиц волновых свойств.
Так как дифракционная картина исследовалась для потока электронов, то необходимо было доказать, что волновые свойства присущи не только потоку большой совокупности электронов, но и каждому электрону в отдельности. Это удалось экспериментально подтвердить в 1948 году советском физику В. А. Фабриканту. Он показал, что даже в случае столь слабого электронного пучка, когда каждый электрон проходит через прибор независимо от других (промежуток времени между двумя электронами в 104 раз больше времени прохождения электроном прибора), возникающая при длительной экспозиции дифракционная картина не отличается от дифракционных картин, получаемых при короткой экспозиции для потоков электронов, в десятки миллионов раз более интенсивных. Следовательно, волновые свойства частиц не являются свойством их коллектива, а присущи каждой частице в отдельности.
Впоследствии дифракционные явления обнаружили также для нейтронов, протонов, атомных и молекулярных пучков. Это окончательно послужило доказательством наличия волновых свойств микрочастиц и позволило описывать движение микрочастиц в виде волнового процесса, характеризующегося определенной длиной волны, рассчитываемой по формуле де Бройля. Открытие волновых свойств микрочастиц привело к появлению и развитию новых методов исследования структуры веществ, таких, как электронография и нейтронография, а также к возникновению новой отрасли науки — электронной оптики.
