himiya moi
.docx
45.
Медно-цинковый
гальванический элемент Якоби-Даниэля.
Процессы на электродах. Понятие ЭДС.
Гальванический элемент
– любое устройство, дающее возможность
получать электрический ток за счет
проведения той или иной химической
реакции. Рассмотрим систему, в которой
медь и цинк в виде пластинок помещены
в растворы своих солей, разделенных
перегородкой – диафрагмой.
При разомкнутой цепи электроды
приобретают равновесные потенциалы,
которые отличаются по знаку и по
величине. При ее замыкании электроны
от цинкового электрода перемещаются
к медному. На электродах нарушается
равновесие:
![]() Получают
развитие двух реакций: на катоде –
окисление Zn=Zn2++2ē,
на аноде – восстановление
Cu2++2ē=Сu0.Суммарная
реакция:
Получают
развитие двух реакций: на катоде –
окисление Zn=Zn2++2ē,
на аноде – восстановление
Cu2++2ē=Сu0.Суммарная
реакция:
![]() Гальванический
элемент на основе такой реакции был
предложен русским ученым Якоби.
Создателем является и ученый Даниэль.
В связи с восстановлением катионов у
медного электрода накапливается избыток
анионов SO22-,
а у цинкового электрода их недостаток.
Эти анионы начинают перемещаться через
полупроницаемую перегородку, замыкая
цепь .Причина
возникновения тока
– разность потенциалов на электродах.
ЭДС элемента
– максимальная разность потенциалов,
отвечающая обратимым условиям работы
гальванического элемента. Она равна
алгебраической сумме отдельных скачков
потенциалов на границах раздела фаз,
образующих элемент. Очевидно, чем больше
ЭДС, тем быстрее протекает реакция
окисления-восстновления .Гальваническая
цепь –
последовательная совокупность скачков
потенциалов на поверхностях раздела,
отвечающих данному гальваническому
элементу. В данном случае цепь
записывается:
Гальванический
элемент на основе такой реакции был
предложен русским ученым Якоби.
Создателем является и ученый Даниэль.
В связи с восстановлением катионов у
медного электрода накапливается избыток
анионов SO22-,
а у цинкового электрода их недостаток.
Эти анионы начинают перемещаться через
полупроницаемую перегородку, замыкая
цепь .Причина
возникновения тока
– разность потенциалов на электродах.
ЭДС элемента
– максимальная разность потенциалов,
отвечающая обратимым условиям работы
гальванического элемента. Она равна
алгебраической сумме отдельных скачков
потенциалов на границах раздела фаз,
образующих элемент. Очевидно, чем больше
ЭДС, тем быстрее протекает реакция
окисления-восстновления .Гальваническая
цепь –
последовательная совокупность скачков
потенциалов на поверхностях раздела,
отвечающих данному гальваническому
элементу. В данном случае цепь
записывается:
![]()
![]() 1
и 3 – скачки на границах «электрод-электролит»,
2 – на границе электролита, 4 – на границе
двух металлов .Величиной
1
и 3 – скачки на границах «электрод-электролит»,
2 – на границе электролита, 4 – на границе
двух металлов .Величиной
![]() можно пренебречь.
можно пренебречь.
46.
Зависимость
ЭДС гальванического элемента от природы
реагирующих веществ, температуры и
концентрации. Стандартная ЭДС.
Гальванический элемент
– любое устройство, дающее возможность
получать электрический ток за счет
проведения той или иной химической
реакции .Влияние
природы реагирующих веществ. Пусть
протекает реакция:
![]() Максимальная полезная работа:
Максимальная полезная работа:
![]()
![]()
![]() Реакция2:
Реакция2:
![]()
![]() Вывод.
В зависимости от природы веществ, ЭДС
будет меняться .Влияние
температуры. Согласно
уравнению Гиббса-Гельмгольца, работа
реакции. При наличии исходных
термохимических данных можно рассчитать
ЭДС. 2)Зависимость от температуры:
Вывод.
В зависимости от природы веществ, ЭДС
будет меняться .Влияние
температуры. Согласно
уравнению Гиббса-Гельмгольца, работа
реакции. При наличии исходных
термохимических данных можно рассчитать
ЭДС. 2)Зависимость от температуры:
![]() Сделаем
подстановки:
Сделаем
подстановки:
![]()
![]()
![]()
![]() Qp
– теплота реакции, которая выделяется
или поглощается при ее необратимом
проведении. Если реакция протекает
обратимо, то часть энергии реакции
превращается в работу А, а часть q
остается в виде теплоты в элементе, q
характеризует связанную энергию.
Определив градиент ЭДС, можно вычислить
изменение энтропии для реакции. Если
q<0,
Qp
– теплота реакции, которая выделяется
или поглощается при ее необратимом
проведении. Если реакция протекает
обратимо, то часть энергии реакции
превращается в работу А, а часть q
остается в виде теплоты в элементе, q
характеризует связанную энергию.
Определив градиент ЭДС, можно вычислить
изменение энтропии для реакции. Если
q<0,
![]() т.е. ЭДС уменьшается с ростом температуры.
Если q>0,
т.е. ЭДС уменьшается с ростом температуры.
Если q>0,
![]() т.е. ЭДС растет с ростом температуры
.Для гальванических элементов q
подбирают малом, чтобы
т.е. ЭДС растет с ростом температуры
.Для гальванических элементов q
подбирают малом, чтобы
![]() Влияние
концентрации. Пусть реакция
Влияние
концентрации. Пусть реакция
![]() Изотерма
реакции:
Изотерма
реакции:
![]() Преобразуем
и получим:
Преобразуем
и получим:
![]() Обозначим
первое слагаемое за
Обозначим
первое слагаемое за
![]() Это
стандартная
ЭДС, она
отвечает случаю равенства единице
концентраций всех участвующих веществ,
т.е. стандартному изменению свободной
энергии реакции
Это
стандартная
ЭДС, она
отвечает случаю равенства единице
концентраций всех участвующих веществ,
т.е. стандартному изменению свободной
энергии реакции
![]()
47.
Стандартный
водородный электрод. Формула Нернста.
Стандартный потенциал. Ряд напряжений.
В настоящее
время невозможно рассчитать или
экспериментально определить абсолютное
значение потенциала на отдельно взятом
электроде (абсолютный
электродный потенциал).Поэтому
значение потенциала на электроде всегда
определяется по отношению к эталонному
электроду, потенциал которого условно
принимается за нуль.В электрохимии
таким электродом является нормальный
водородный элемент.Его
устройство: в стеклянный сосуд сложной
формы залит раствор серной кислоты
такой концентрации, что
![]() В него опущена платиновая пластинка,
покрытая платиновой
чернью. Снизу в сосуд подается газообразный
водород. Насыщенная им пластина ведет
себя как водородный электрод. То есть
имеет место равновесие: (губчатая
пластина) – платиновый электрод, Р=1атм.
Водород омывает платину, растворяется
в ней. Насыщенная водородом платина
начинает вести себя как водородный
электрод, т.е.
В него опущена платиновая пластинка,
покрытая платиновой
чернью. Снизу в сосуд подается газообразный
водород. Насыщенная им пластина ведет
себя как водородный электрод. То есть
имеет место равновесие: (губчатая
пластина) – платиновый электрод, Р=1атм.
Водород омывает платину, растворяется
в ней. Насыщенная водородом платина
начинает вести себя как водородный
электрод, т.е.
![]() Скачок
потенциала на границе
Скачок
потенциала на границе
![]() имеет определенную величину, которую
принимают за 0.За условную величину,
характеризующую потенциал электрода,
принимают ЭДС гальванического элемента,
составленного из этого электрода и
НВЭ.Стандартный потенциал металла –
ЭДС гальванического элемента, состоящего
из данного электрода, погруженного в
раствор, где активность ионов металла
равна 1, и из СВЭ. Уравнение Нернста
(T=298К):
имеет определенную величину, которую
принимают за 0.За условную величину,
характеризующую потенциал электрода,
принимают ЭДС гальванического элемента,
составленного из этого электрода и
НВЭ.Стандартный потенциал металла –
ЭДС гальванического элемента, состоящего
из данного электрода, погруженного в
раствор, где активность ионов металла
равна 1, и из СВЭ. Уравнение Нернста
(T=298К):
![]() Если расположить все металлы в ряд по
алгебраической величине их стандартных
потенциалов, получим ряд
напряжений.
Отрицательный потенциал принадлежит
электродам, которые заряжаются
отрицательно по отношению к НВЭ
.Положительный – электрод заряжается
положительно по отношению к НВЭ.
Если расположить все металлы в ряд по
алгебраической величине их стандартных
потенциалов, получим ряд
напряжений.
Отрицательный потенциал принадлежит
электродам, которые заряжаются
отрицательно по отношению к НВЭ
.Положительный – электрод заряжается
положительно по отношению к НВЭ.
![]()
![]()
, ,,,где
![]() —
электродный потенциал,
—
электродный потенциал, ![]() —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;![]() —
абсолютная температура;
—
абсолютная температура;
![]() — постоянная
Фарадея, равная 96485,35 Кл·моль−1;
— постоянная
Фарадея, равная 96485,35 Кл·моль−1;![]() —
число молей электронов,
участвующих в процессе;
—
число молей электронов,
участвующих в процессе;
![]() и
и ![]() — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
48.
Типы
электродов. Окислительно-восстановительные
электроды Электрод
– проводник 1 рода, погруженный в раствор
электролита в условиях прохождения
через него тока. Три
типа: электроды
первого, второго и третьего рода.
Электроды
1-го рода. Металлы,
погруженные в растворы своих солей.
солей:
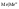 Электроды
2-го рода. Металл
погружен в насыщенный раствор своей
малорастворимой соли, к которой добавлена
другая соль с тем же анионом, но хорошо
растворимая. Пример.
Электроды
2-го рода. Металл
погружен в насыщенный раствор своей
малорастворимой соли, к которой добавлена
другая соль с тем же анионом, но хорошо
растворимая. Пример.
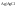 Процессы
на электроде:
Процессы
на электроде:
 Электроды
3-го рода (газовые электроды). Известны
водородный, кислородный и хлорный
электроды. Потенциал газового электрода
зависит как от активности ионов, так и
от давления газа. Кроме электродов
существуют
цепи (концентрационные
и альмагамные). Концентрационная
цепь. В сосуд
помещены 2 одинаковых электрода и залиты
раствором, содержащим ионы металла.
При замыкании цепи получают развитие
процессы, приводящие к выравниванию
концентрации всех растворов. ЭДС
элемента:
Электроды
3-го рода (газовые электроды). Известны
водородный, кислородный и хлорный
электроды. Потенциал газового электрода
зависит как от активности ионов, так и
от давления газа. Кроме электродов
существуют
цепи (концентрационные
и альмагамные). Концентрационная
цепь. В сосуд
помещены 2 одинаковых электрода и залиты
раствором, содержащим ионы металла.
При замыкании цепи получают развитие
процессы, приводящие к выравниванию
концентрации всех растворов. ЭДС
элемента:
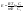 Альмагамные
цепи. Альмагама
– сплав металла со ртутью, остающийся
жидким при комнатной температуре. В
сосуд залиты альмагамы с различной
концентрацией металла и электролит,
содержащий ионы металла. При работе
элемента: окисление в первом отделе,
восстновление – во втором. Процессы
продолжаются до выравнивания концентраций
электролитов и альмагам.
Окислительно-восстановительный электрод
представляет собой гладкую платиновую
пластинку, опущенную в раствор с ионами
какого-либо вещества в окисленной и
восстановленной формах. В принципе
любой электрод окислительно-восстановительный,
но этот термин применяется только в
том случае, если материал электродов
не изменяется, а служит лишь источником
или приемником электронов. Эти электроды,
таким образом, обеспечивают отвод/подвод
электронов. Имеются таблицы стандартных
окислительно-восстановительных
потенциалов.
Альмагамные
цепи. Альмагама
– сплав металла со ртутью, остающийся
жидким при комнатной температуре. В
сосуд залиты альмагамы с различной
концентрацией металла и электролит,
содержащий ионы металла. При работе
элемента: окисление в первом отделе,
восстновление – во втором. Процессы
продолжаются до выравнивания концентраций
электролитов и альмагам.
Окислительно-восстановительный электрод
представляет собой гладкую платиновую
пластинку, опущенную в раствор с ионами
какого-либо вещества в окисленной и
восстановленной формах. В принципе
любой электрод окислительно-восстановительный,
но этот термин применяется только в
том случае, если материал электродов
не изменяется, а служит лишь источником
или приемником электронов. Эти электроды,
таким образом, обеспечивают отвод/подвод
электронов. Имеются таблицы стандартных
окислительно-восстановительных
потенциалов.
49.
Электролиз.
Последовательность разряда ионов на
катоде и аноде. Электролиз
- это окислительно-восстановительный
процесс, протекающий при прохождении
постоянного тока через раствор или
расплав электролита.Сущность
электролиза:
на катоде(-) идет процесс восстановления,
на аноде(+) – процесс окисления.Пример.
![]() Различают
первичные
(электронный) и вторичные
(химический) процессы.Последовательность
разряда ионов в водных растворах.Вода
частично ионизирована.
Различают
первичные
(электронный) и вторичные
(химический) процессы.Последовательность
разряда ионов в водных растворах.Вода
частично ионизирована.
![]() На катоде в первую очередь восстанавливается
тот катион, потенциал которого более
положителен.Все металлы можно разделить
на 3 группы.1-я
группа – с
наименьшей алгебраической величиной
На катоде в первую очередь восстанавливается
тот катион, потенциал которого более
положителен.Все металлы можно разделить
на 3 группы.1-я
группа – с
наименьшей алгебраической величиной
![]() от Li до Al (включительно). При электролизе
водных растворов, содержащих ионы
металлов 1-й группы на катоде идет только
процесс восстановление катионов Н+.2-я
группа - со
средней алгебраической величиной
от Li до Al (включительно). При электролизе
водных растворов, содержащих ионы
металлов 1-й группы на катоде идет только
процесс восстановление катионов Н+.2-я
группа - со
средней алгебраической величиной
![]() от Mn
до Fe
(Fe3+).
При электолизе водных растворов,
содержащих ионы Ме 2ой группы на катоде
идут 2 процесса: Men++nē®Me°,
H++ē®H.
от Mn
до Fe
(Fe3+).
При электолизе водных растворов,
содержащих ионы Ме 2ой группы на катоде
идут 2 процесса: Men++nē®Me°,
H++ē®H.
![]() - выход по току, отношение практически
полученного на катоде вещества к
теоретически возможному, которое должно
было бы выделиться по закону Фарадея.3-я
группа – с
наибольшей алгебраической величиной
- выход по току, отношение практически
полученного на катоде вещества к
теоретически возможному, которое должно
было бы выделиться по закону Фарадея.3-я
группа – с
наибольшей алгебраической величиной
![]() все
Ме, расположенные в ряду напряжений
после водорода. На катоде – только
восстановление катионов Ме, Меn++nē®Ме°.
Порядок окисления анионов на аноде: на
аноде в 1-ю очередь окисляется анион,
все
Ме, расположенные в ряду напряжений
после водорода. На катоде – только
восстановление катионов Ме, Меn++nē®Ме°.
Порядок окисления анионов на аноде: на
аноде в 1-ю очередь окисляется анион,
![]() которого более отрицателен.В случае
нерастворимого анода (графит, уголь,
Pt, Au, Ir) в первую очередь окисляются
анионы бескислородных кислот. Если
этих ионов нет, то если среда щелочная,
окисляются анионы гидроксила. Если
среда кислая или нейтральная, то имеет
место прямое окисление воды.В случае
растворимого анода, имеет место процесс:
которого более отрицателен.В случае
нерастворимого анода (графит, уголь,
Pt, Au, Ir) в первую очередь окисляются
анионы бескислородных кислот. Если
этих ионов нет, то если среда щелочная,
окисляются анионы гидроксила. Если
среда кислая или нейтральная, то имеет
место прямое окисление воды.В случае
растворимого анода, имеет место процесс:
![]()
50.
Законы
Фарадея. Выход по току. Первый
закон: при электролизе данного электролита
количества веществ, выделяющихся на
электродах, прямо пропорционально
количеству электричества, прошедшему
через электролит. q
– электрохимический эквивалент. Второй
закон: при электролизе различных
электролитов одинаковые количества
электричества выделяют на электродах
такие количества веществ, которые прямо
пропорциональны их химическим
эквивалентам. Пример. При прохождении
1 фарадея (96500 Кл) электричества на
электродах выделяется 1 г-экв вещества.
В формулу первого закона следует ввести
поправочный сомножитель – выход по
току. Закон Фарадея:
q
– электрохимический эквивалент. Второй
закон: при электролизе различных
электролитов одинаковые количества
электричества выделяют на электродах
такие количества веществ, которые прямо
пропорциональны их химическим
эквивалентам. Пример. При прохождении
1 фарадея (96500 Кл) электричества на
электродах выделяется 1 г-экв вещества.
В формулу первого закона следует ввести
поправочный сомножитель – выход по
току. Закон Фарадея:
 Электрический эквивалент q
– количество вещества в мг, выделяющееся
на электродах при прохождении 1 Кл
электричества. Вторая формулировка.
Электрический эквивалент q
– количество вещества в г, выделяющееся
на электродах при прохождении 1 А*ч
электричества.q=Э/Ф,
Э – г-экв. Удельный расход энергии при
электролизе: W=U*I*t/m=U/(q*η),
[Вт*ч/г].
Электрический эквивалент q
– количество вещества в мг, выделяющееся
на электродах при прохождении 1 Кл
электричества. Вторая формулировка.
Электрический эквивалент q
– количество вещества в г, выделяющееся
на электродах при прохождении 1 А*ч
электричества.q=Э/Ф,
Э – г-экв. Удельный расход энергии при
электролизе: W=U*I*t/m=U/(q*η),
[Вт*ч/г].
 -выход
по току.
Химическая и концентрационная поляризация
при электролизе. Понятие перенапряжения.В
процессе электролиза всегда возникает
некоторая разность потенциалов,
направленная противоположно той,
которая накладывается извне. Это явление
носит название поляризации.
Различают химическую
и концентрационную.Химическая
обусловлена химическими изменениями
на поверхности электрода.Концентрационная
поляризация: концентрация
потенциалопределяющих ионов у анода
и катода в процессе электролиза будет
различаться, у катода она меньше
равновесной, у анода – больше. Возникает
концентрационный элемент, ЭДС которого
направлена навстречу внешней ЭДС, она
может быть уменьшена путем перемешивания
раствора. Напряжение
разложения
– наименьшее значение внешней ЭДС, при
достижении которого начинается
длительный электролиз (с выделением
его продуктов).
Поляр-ю
электр-ов можно ум-ть перемешиванием.
В зав-ти от типа поляр-и,ей можно
ум.перемемеш-ем,повыш-ем т-ры,ув.конц-и,ув-ем
пл-ди электрода Перенапряжение
– это разность между напряжением
разложения, фактически необходимым
для протекания электролиза в данной
электрохимической системе, и ЭДС
гальванического элемента, отвечающего
этой системе. Вред
перенапряжения:
добавочный расход электроэнергии,
польза:
удается получать электролизом водных
растворов металлы, потенциалы которых
отрицательны.
-выход
по току.
Химическая и концентрационная поляризация
при электролизе. Понятие перенапряжения.В
процессе электролиза всегда возникает
некоторая разность потенциалов,
направленная противоположно той,
которая накладывается извне. Это явление
носит название поляризации.
Различают химическую
и концентрационную.Химическая
обусловлена химическими изменениями
на поверхности электрода.Концентрационная
поляризация: концентрация
потенциалопределяющих ионов у анода
и катода в процессе электролиза будет
различаться, у катода она меньше
равновесной, у анода – больше. Возникает
концентрационный элемент, ЭДС которого
направлена навстречу внешней ЭДС, она
может быть уменьшена путем перемешивания
раствора. Напряжение
разложения
– наименьшее значение внешней ЭДС, при
достижении которого начинается
длительный электролиз (с выделением
его продуктов).
Поляр-ю
электр-ов можно ум-ть перемешиванием.
В зав-ти от типа поляр-и,ей можно
ум.перемемеш-ем,повыш-ем т-ры,ув.конц-и,ув-ем
пл-ди электрода Перенапряжение
– это разность между напряжением
разложения, фактически необходимым
для протекания электролиза в данной
электрохимической системе, и ЭДС
гальванического элемента, отвечающего
этой системе. Вред
перенапряжения:
добавочный расход электроэнергии,
польза:
удается получать электролизом водных
растворов металлы, потенциалы которых
отрицательны.
51.
Классификация
химических источников тока.
Существуют 3 типа ХИТ: первичные
- гальванические элементы, вторичные
– аккумуляторы и топливные элементы.1)В
гальванических элементах активные
вещества, необходимые для работы
элемента, закладываются в него при
монтаже, после израсходования веществ
элемент утилизируется(одноразовые
батарейки)2)В
основу аккумулятора
положена высоко-обратимая хим реакция
окисления-восстановления, которую
можно проводить в обоих направлениях.3)Топливный
элемент – это ХИТ
длительного действия, начинающий и
прекращающий работу с началом и
прекращением подачи активных веществ
в электродам.Достоинства
ХИТ: высокий
КПД, экологическая чистота, бесшумность,
автономность действия.Недостаток
– низкие удельные характеристики.
Марганцево-цинковый
элемент:
наиболее широко применяется среди
первичных ХИТ. Электрохимическая
цепь:
(-)Zn|NH4Cl|MnO2(+).
Электролит – 20% раствор NH4Cl,
загущенный до студнеобразного состояния,
для предотвращения высыхания и загнивания
вводят специальные добавки. MnO2
спрессован с добавкой сажи – для
увеличения электроемкости. ЭДС от 1,48
до 1,8 в зависимости от кристаллической
модификации MnO2,
начальное напряжение 1,1-1,25В. Процессы
при разряде: (-) Zn-2ē+2H2O>Zn(OH)2+2H+,
(+)2MnO2+2ē+2H+>2MnO.OH,
Zn+2MnO2+2H2O=Zn(OH)2+2MnO.OH.
Вторичная реакция:
Zn(OH)2+2NH4Cl=[Zn(NH3)2]Cl2+2MnO.OH
Свинцово-кислотный аккумулятор —
наиболее распространенный на сегодняшний
день тип аккумуляторов.
Элемент свинцово-кислотного аккумулятора
состоит из электродов (положительных
и отрицательных) и разделительных
изоляторов (сепараторов), которые
погружены в электролит.
Электроды представляют собой свинцовые
решётки. У положительных активным
веществом является диоксид
свинца (PbO2),
у отрицательных активным веществом
является губчатый свинец.
Химическая
реакция (слева направо — разряд,
справа налево — заряд): Анод:
![]() Катод:
Катод:![]() В
итоге получается, что при разряде
аккумулятора расходуется серная кислота
из электролита (и плотность электролита
падает, а при заряде, серная кислота
выделяется в раствор электролита из
сульфатов, плотность электролита
растёт). В конце заряда, при некоторых
критических значениях концентрации
сульфата свинца у электродов, начинает
преобладать процесс электролиза воды.
При этом на катоде выделяется водород,
на аноде — кислород.
При заряде не стоит допускать электролиза
воды, в противном случае необходимо её
долить для восполнения потерянного в
ходе электролиза количества.
В
итоге получается, что при разряде
аккумулятора расходуется серная кислота
из электролита (и плотность электролита
падает, а при заряде, серная кислота
выделяется в раствор электролита из
сульфатов, плотность электролита
растёт). В конце заряда, при некоторых
критических значениях концентрации
сульфата свинца у электродов, начинает
преобладать процесс электролиза воды.
При этом на катоде выделяется водород,
на аноде — кислород.
При заряде не стоит допускать электролиза
воды, в противном случае необходимо её
долить для восполнения потерянного в
ходе электролиза количества.
52.
Коррозия
металлов. Химическая и электрохимическая
коррозия.Коррозия – самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное. Потери
от коррозии велики: десятки миллиардов
долларов в индустриально-развитых
странах. Химическая
коррозия (газовая и жидкостная). Газовая
– разрушение происходит в атмосфере
сухого газа – окислителя (кислород,
галогены).
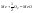 На
поверхности металла образуется твердая
пленка оксида. Скорость окисления
зависит от прочности пленки (наличия
или отсутствия трещин). Если пленка
растягивается, трещины образуются
легко. Если сжимается – гораздо труднее.
Это
зависит от отношения мольных объемов
окислителя и металла.
На
поверхности металла образуется твердая
пленка оксида. Скорость окисления
зависит от прочности пленки (наличия
или отсутствия трещин). Если пленка
растягивается, трещины образуются
легко. Если сжимается – гораздо труднее.
Это
зависит от отношения мольных объемов
окислителя и металла.
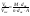 М – молекулярная масса оксида, d
– плотность, n
– число атомов в молекуле оксида, А –
атомная масса металла.Если отношение
<1
=> пленка растягивается, если >1
=> сжимается.Некоторые металлы (железо,
алюминий, хром, нержавеющая сталь) могут
подвергаться пассивации
(образование на поверхности под действием
реагентов слоев, препятствующих
коррозии) .Пример.
М – молекулярная масса оксида, d
– плотность, n
– число атомов в молекуле оксида, А –
атомная масса металла.Если отношение
<1
=> пленка растягивается, если >1
=> сжимается.Некоторые металлы (железо,
алюминий, хром, нержавеющая сталь) могут
подвергаться пассивации
(образование на поверхности под действием
реагентов слоев, препятствующих
коррозии) .Пример.
 Активными газами, вызывающими газовую
коррозию являются – хлор, фтор, кислород,
сероводород. Жидкостная
коррозия – разрушение металла в жидкой
непроводящей среде (нефть, бензин,
керосин, смазочные масла). Скорость
невелика. Электрохимическая
коррозия (гальванокоррозия и
электрокоррозия).Гальванокоррозия.
При протекании процесса разрушающийся
металл является отрицательным
электродом.Рассмотрим пример.На границе
«металл-жидкость» образуется слой
ионов железа, удерживаемых отрицательно
заряженным металлом у своей поверхности.
Ионы железа удерживают на расстоянии
ионы водорода, не давая им восстановиться
за счет электронов железа. Отсюда,
коррозионная стойкость химически
чистого железа.В случае технического
железа (содержит примеси) происходит
восстановление ионов водорода (пример
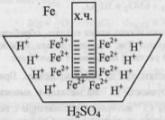
примесей – углерод).Электрокоррозия.Идет
процесс электролиза под действием тока
от внешнего источника.Рассмотрим
пример.Коррозия стального трубопровода
в почве под действием электрических
токов. Возникают 2 участка: 1. где рельс
(источник тока) играет роль катода (-),
а участок провода под ним – роль анода
(+).2. справа от стыка. рельс – анод, провод
– катод.Слева от стыка разрушается
трубопровод, справа – рельс.Разрушение
происходит локально – на ограниченном
участке.
Активными газами, вызывающими газовую
коррозию являются – хлор, фтор, кислород,
сероводород. Жидкостная
коррозия – разрушение металла в жидкой
непроводящей среде (нефть, бензин,
керосин, смазочные масла). Скорость
невелика. Электрохимическая
коррозия (гальванокоррозия и
электрокоррозия).Гальванокоррозия.
При протекании процесса разрушающийся
металл является отрицательным
электродом.Рассмотрим пример.На границе
«металл-жидкость» образуется слой
ионов железа, удерживаемых отрицательно
заряженным металлом у своей поверхности.
Ионы железа удерживают на расстоянии
ионы водорода, не давая им восстановиться
за счет электронов железа. Отсюда,
коррозионная стойкость химически
чистого железа.В случае технического
железа (содержит примеси) происходит
восстановление ионов водорода (пример
примесей – углерод).Электрокоррозия.Идет
процесс электролиза под действием тока
от внешнего источника.Рассмотрим
пример.Коррозия стального трубопровода
в почве под действием электрических
токов. Возникают 2 участка: 1. где рельс
(источник тока) играет роль катода (-),
а участок провода под ним – роль анода
(+).2. справа от стыка. рельс – анод, провод
– катод.Слева от стыка разрушается
трубопровод, справа – рельс.Разрушение
происходит локально – на ограниченном
участке.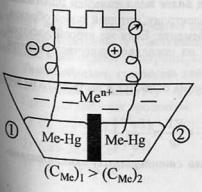
53.
Основные методы борьбы с коррозией.Коррозия
– самопроизвольно
протекающий процесс поверхностного
окисления металла в результате его
химического или электрохимического
взаимодействия с окружающей средой.В
результате коррозии металл из свободного
состояния переходит в связанное. Потери
от коррозии велики: десятки миллиардов
долларов в индустриально-развитых
странах.Методы
борьбы различны: -антикоррозийное
легирование
металла – введение в металл добавок,
чтобы повысить стойкость основного
металла.-защитные
покрытия
(металлические и неметаллические):1)анодное
– Zn/Fe
(Zn
защищает,покрыт тонкой оксидной
пленкой).Если оксидн.пленку снять-электролит
может касаться цинка и ме.(-а): Zn-2e=Zn2+
Для воды:
Н0+2е=Н2
Для
кислой:O2+H2+4e=4(OH)-
Для
воды:2H2O+2e=H2+2(OH)-
При нарушении анодного покрытия,основная
деталь все-равно защищена.
2)катодное
покрытие менее активного ме-Fe/Ni
металлические наносятся под давлением
сжатого воздуха. характерно покрытие
листового материала тонким слоем
другого материала. неметаллические –
лаки ,краски, битум, солидол. -ингибиторы
коррозии.
вещества, замедляющие процесс разрушения
металла. Пример.
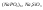 -электрозащита. защищаемый
металл приводят в контакт с менее
благородным металлом (цинк или магний).
-электрозащита. защищаемый
металл приводят в контакт с менее
благородным металлом (цинк или магний).
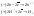 Поток
электронов направляется к защищаемому
металлу. Этот
вид защиты используется для магистральных
труб, корпусов кораблей и т.д.
Поток
электронов направляется к защищаемому
металлу. Этот
вид защиты используется для магистральных
труб, корпусов кораблей и т.д.
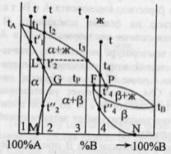
54. Кристаллическое состояние вещества. Химическая связь в кристаллах
Твердые вещества
могут находиться в аморфном или
кристаллическом состояниях. Вещества
в аморфном состоянии не имеют четкой
структуры, их иногда называют
«переохлажденными жидкостями с аномально
высокой вязкостью».Кристаллические
структуры. Наименьшая
структурная единица – элементарная
ячейка. В зависимости от решеток и углов
между характеристическими осями
различают 7 основных видов (кубическая,
ромбоэдрическая и пр.).Тип кристаллической
системы определяется природой и
размерами частиц, видом химических
связей между ними, температурой и
другими факторами. Многие соединения
могут существовать в двух и более
кристаллических структурах. Это явление
– полиморфизм.
Все кристаллы можно разделить по видам
химической связи.
Стоит отметить, что существуют кристаллы
со смешанными связями.1.
Молекулярная связь. В
узлах кристаллических решеток находятся
молекулы, между которыми действуют
вандервальсовы силы, имеющие невысокую
энергию. Для кристаллов с молекулярными
связями характерны низкие температуры
плавления и высокая сжимаемость.2.
Ковалентная связь. В
узлах кристаллов располагаются атомы,
образующие прочные ковалентные связи.
Это обуславливает высокую энергию
решетки. Кристаллы с ковалентной связью
- диэлектрики или полупроводники.
Типичными примеры: алмаз и кремний.3.
Ионная связь. Структурные
единицы – положительно и отрицательно
заряженные ионы, между которыми
происходит электростатическое
взаимодействие, характеризуемое высокой
энергией. Кристаллы с ионной связью
при низких температурах являются
диэлектриками. При температурах близких
к температуре плавления они становятся
проводниками электричества.4.
Металлическая связь. Специфические
свойства металлов (высокая проводимость,
теплопроводность, ковкость, пластичность,
металлический блеск) можно объяснить
особым типом связи – металлическая.
Во всех узлах кристаллической решётки
расположены положительные ионы металла.
Между ними беспорядочно движутся
валентные электроны, отщепившиеся от
атомов при образовании ионов. Эти
электроны удерживают вместе положительные
ионы, в противном случае решётка
распалась бы под действием сил
отталкивания между ионами. 5.
Смешанная связь. Тот
или иной вид связи встречается редко,
обычно – наложение двух или более
связей.
З-н
постоянства межграневых углов: Кристаллы
одной и тойже модификации данного в-ва
могут иметь различную в-ну,форму и к-во
граней,но углы м/у соответствующ.гранями
остаются постоянными.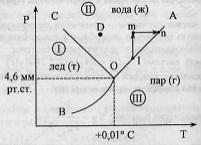
55.
Составные
части системы и компоненты. Правило
фаз. Диаграмма воды.
Составные
части системы
– химически индивидуальные вещества,
составляющие данную систему и способные
к самостоятельному существованию. В
равновесной системе
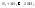 имеются 3 составных части. Константа
равновесия:
имеются 3 составных части. Константа
равновесия:
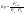 Если известны парциальные давления
двух участников реакции, система
определена. Независимые компоненты –
индивидуальные вещества, наименьшее
число которых необходимо и достаточно
для образования всех фаз системы. Число
независимых
компонентов
– разница между числом составных частей
и числом связывающих уравнений. В данном
примере: 3-1=2. Степени
свободы –
независимые переменные, которые можно
произвольно менять, не нарушая состояния
системы (числа и характера фаз). Правило
фаз позволяет
определить число фаз в системе при
равновесии и изменение этого числа при
изменении какого-либо параметра.
Если известны парциальные давления
двух участников реакции, система
определена. Независимые компоненты –
индивидуальные вещества, наименьшее
число которых необходимо и достаточно
для образования всех фаз системы. Число
независимых
компонентов
– разница между числом составных частей
и числом связывающих уравнений. В данном
примере: 3-1=2. Степени
свободы –
независимые переменные, которые можно
произвольно менять, не нарушая состояния
системы (числа и характера фаз). Правило
фаз позволяет
определить число фаз в системе при
равновесии и изменение этого числа при
изменении какого-либо параметра.
 С – число степеней свободы, К –
компоненты, Ф – фазы. Если
С – число степеней свободы, К –
компоненты, Ф – фазы. Если
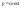 и
и
 выражение
выражение
 Пример.
Определить кол-во фаз в системе
Пример.
Определить кол-во фаз в системе
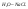 С=К-Ф+2=4-Ф. Максимальное число фаз=минимум
С.
С=К-Ф+2=4-Ф. Максимальное число фаз=минимум
С.
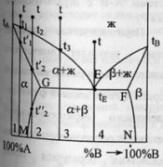
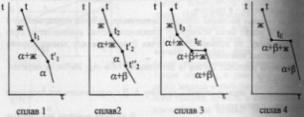
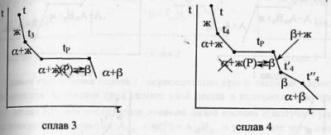
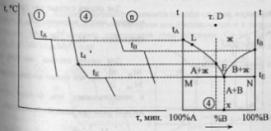
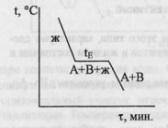
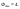 Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.В качестве системы
возьмем воду.
K=1
=> состав как переменная отпадает, и
фактически имеем Р-Т диаграмму.
С=К-Ф+2=3-Ф; максимальное число фаз,
находящихся в равновесии, равно 3. 1 -
поле СОВ-область существования твердой
фазы – льда. 2 – СОА – жидкая фаза –вода.
3 – АОВ – водяной пар. Если число
ст.св.0,то 3 фазы. Если число ст.0,то 2 фазы.
Если число ст.2,то 1 фаза. Двувариантная
сист.- Одновариант.сист.- ОС-повыш-е
давл-я вызывает пониж-е т-ры,т.к.вызывает
обр-е той фазы,к-ая обладает большей
плотностью.
Диаграмма
состояния системы
- диаграмма, указывающая, в каких фазовых
состояниях находится система в
зависимости от условий: температура,
давление и состав.В качестве системы
возьмем воду.
K=1
=> состав как переменная отпадает, и
фактически имеем Р-Т диаграмму.
С=К-Ф+2=3-Ф; максимальное число фаз,
находящихся в равновесии, равно 3. 1 -
поле СОВ-область существования твердой
фазы – льда. 2 – СОА – жидкая фаза –вода.
3 – АОВ – водяной пар. Если число
ст.св.0,то 3 фазы. Если число ст.0,то 2 фазы.
Если число ст.2,то 1 фаза. Двувариантная
сист.- Одновариант.сист.- ОС-повыш-е
давл-я вызывает пониж-е т-ры,т.к.вызывает
обр-е той фазы,к-ая обладает большей
плотностью.