
Семинар_07_МВА_Реальный_газ_пар_жидкость_2
.pdfСеминар по ТТД №06.
MVA
Термодинамические свойства воды и водяного пара, таблицы свойств
водяного пара.
Число степеней свободы термодинамической системы (ТС).
Гетерогенная термодинамическая система (Heterogeneous thermodynamic system).
Термодинамическая система, состоящая из отдельных частей, разграниченная поверхностями раздела. При переходе через поверхность раздела хотя бы одно термодинамическое свойства вещества изменяется скачкообразно.
Гомогенная термодинамическая система (Homogeneous thermodynamic system).
Термодинамическая система, между любыми частями которой нет поверхностей раздела. При переходе от точки к точке термодинамические свойства вещества изменяется плавно. Если во всех точках такой системы термодинамические свойства одинаковы, то она называется «однородной термодинамической системой»
Фаза (Phase). Гомогенная часть гетерогенной термодинамической системы, ограниченная поверхностью раздела.
Правило фаз Гиббса. Число степеней свободы термодинамической системы:
j = n – m + 2, |
(7-1) |
где, n – число компонентов системы (смеси); m – количество фаз. Для индивидуального вещества (чистого):
1)одна фаза, j = 2;
2)две фазы, j = 1;
3)три фазы, j = 0.
Три фазы – тройная точка – равновесное состояние трех фаз.

Фазовые диаграммы.
Полные p, v- и t, s- диаграммы.
Рассмотрим диаграммы реального вещества, на которой представлены три фазы: твердая, жидкая, газообразная.
Рисунок 7-1. p, v- диаграмма |
Рисунок 7-2. p, v- диаграмма. Ж + П |
Рисунок 7-3. t, s- диаграмма |
Рисунок 7-4. t, s- диаграмма. Ж + П |

Полная p, t- диаграмма.
Рисунок 7-5. p, t- диаграмма
Тр – тройная точка (здесь – главная –
Т+Ж+П); Рисунок 7-6. p, t- диаграмма. Ж + П Кр – критическая точка; а-Тр – линия сублимации (возгонки); Тр-б – линия плавления; Тр-Кр – линия кипения
(парообразования, конденсации, насыщения, фазового перехода Ж – П).
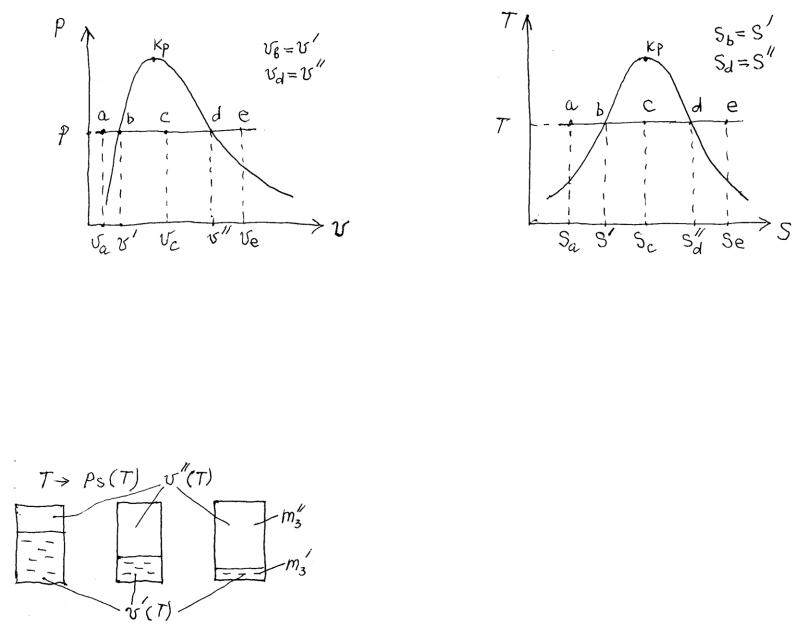
Рисунок 7-7. p, v- диаграмма |
Рисунок 7-8. t, s- диаграмма |
1)a – жидкость недогретая до кипения (Ж); табл. III;
2)b – кипящая жидкость (КЖ), обозначается апострофом; табл. I или II;
3)c – влажный пар (ВП);
4)d – сухой насыщенный пар, обозначается двойным апострофом (СНП); табл. I или II;
5)e – перегретый пар (ПП); табл. III;
Во ВП для индивидуального вещества (чистого) j = 1.
|
m = m' + m"; V = V' + V" . |
(7-2) |
|
, V” |
|
|
|
|
V' = v'·m'; V" = v" ·m". |
(7-3) |
|
, V’ |
vВП = V/m = [v'·(m – m") + v" ·m"]/m. |
(7-4) |
|
|
|||
|
vВП = (1 – x)·v' + x·v", |
(7-5) |
|
Рисунок 7-9. Три двухфазные равновесные |
x = m"/m. |
(7-6) |
|
ТС при одной температуре T. |
|||
|
|
Степень сухости пара x = m"/m. Степень влажности y = m'/m. Очевидно, x + y = 1.
Для любой экстенсивной величины Z (V, H, S, U, …) во влажном паре можно записать:
zВП = (1 – x)·z' + x·z" = z' + x·(z" – z') , |
(7-7) |
где z – это удельные величины v, h, s, u, … |
|
Если известна величина zВП при заданном p или t, то всегда можно найти степень сухости: |
|
x = (zВП – z') / (z" – z'), |
(7-8) |
например, для энтропии ВП: |
|
x = (sВП – s') / (s" – s'), |
(7-9) |
Задача №29 (9.1).
Состояние воды определяется параметрами:
1)p = 6,0 МПа, t = 320°C;
2)p = 4 бар, v = 0,015 м3/кг;
3)t = 170°C, v = 0,000105 м3/кг;
4)t = 170°C, v = 0,000108 м3/кг;
5)p = 18,2 МПа, t = 357,90°C;
Задача №29 (9.1).
Состояние воды определяется параметрами:
1) p1 = 6,0 МПа, t1 = 320°C;
ts(6,0 МПа) = |
°С; |
|
ps(320°C) = |
МПа. |
|
v1 |
= |
м3/кг; |
h1 |
= |
кДж/кг; |
s1 = |
кДж/(кг·К). |
|
u1 |
= h1 – p1·v1 = |
кДж/кг. |

Рисунок 7-9. p, t- диаграмма |
Рисунок 7-10. p, v- диаграмма |
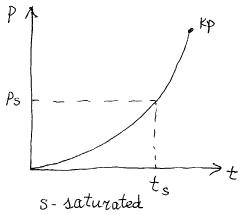
ts(6 МПа) = 275,59°С; ps(302°C) = 11,28 МПа.
Рисунок 7-11. t, s- диаграмма Рисунок 7-12. h, s- диаграмма
