
- •Контрольные задания по химии
- •1. Основные стехиометрические законы химии. Строение атома и химическая связь. Ионно-электронный метод уравнивания окислительно-восстановительных реакций
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •2. Химическая термодинамика
- •2.1. Основные формулы для расчетов
- •2.2. Примеры типовых расчетов
- •3. Химическая кинетика
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы по химической термодинамике и кинетике
- •4. Жидкие растворы
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •5. Электрохимия
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •Список литературы
- •Приложения
- •1. Термодинамические величины для простых веществ и соединений
- •2. Стандартные электродные потенциалы
- •Содержание
- •198376, Санкт-Петербург, ул. Проф. Попова, 5
3. Химическая кинетика
Основные формулы для расчетов
Зависимость скорости реакции от концентрации реагирующих веществ (кинетическое уравнение)
![]() (3.1)
(3.1)
где v − скорость реакции;aA + bB → продукты реакции;
[A], [B] либоcA,cB− концентрации веществ, вступающих в реакцию;
k− константа скорости реакции.
Зависимость скорости реакции от температуры (уравнение Вант‑Гоффа):
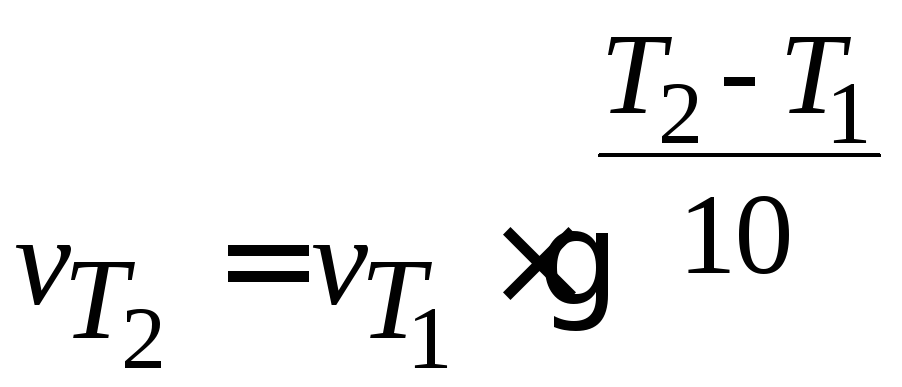 , (3.2)
, (3.2)
где
![]() и
и![]() − скорости
реакции при температурахT2иT1соответственно;
− скорости
реакции при температурахT2иT1соответственно;
γ − температурный коэффициент скорости реакции (коэффициент Вант-Гоффа).
Уравнение Аррениуса
![]()
где
![]() − константа
скорости реакции при температуреT;
− константа
скорости реакции при температуреT;
![]() − энергия активации;
− энергия активации;
const − константа интегрирования.
Для реакции, протекающей при температурах T2иT1:
 (3.3)
(3.3)
Для
реакций, протекающих при одной и той же
температуре, при разных значениях
энергии активации
![]() и
и![]() с соответствующими значениями констант
скоростей
с соответствующими значениями констант
скоростей![]() и
и![]() :
:
 (3.4)
(3.4)
Примеры типовых расчетов
Пример 3.1.В системе, где протекает реакция
2Al(тв) + 3Br2(г) = 2AlBr3(г),
концентрацию брома увеличили в 4 раза. Во сколько раз возрастет скорость реакции?
Решение.Так как алюминий − твердое вещество, то в соответствии с (3.1) кинетическое уравнение для исходного состояния имеет вид
![]()
Скорость реакции после увеличения концентрации брома
![]()
Пример 3.2.Реакция между газамиAиBпротекает по уравнению
2A + B = C.
Исходные концентрации: [A] = 0.5 моль/л; [B] = 0.3 моль/л; константа скорости реакцииk = 0.4. Найти начальную скорость реакции и скорость в момент времени, когда в результате протекания реакции концентрацияBуменьшится на 0.1 моль/л. Реакция протекает в постоянном объеме.
Решение.Начальная скорость реакции определяется по соотношению (3.1):
![]()
К моменту уменьшения концентрации вещества Bна 0.1 моль/л его концентрация составит 0.3 − 0.1 = 0.2 моль/л. КонцентрацияAв соответствии с уравнением реакции к этому же времени уменьшится на 0.1∙ 2 = 0.2 моль/л и составит 0.5 − 0.2 = 0.3 моль/л. Скорость реакции в этот момент будет
![]()
Пример 3.3.Во сколько раз возрастает скорость реакции при повышении температуры с 290 до 340K, если температурный коэффициент скорости реакции γ = 2.
Решение.Из уравнения (3.2)

Скорость реакции увеличится в 32 раза.
Пример 3.4.Константа скорости реакции приT = 283Kравна 1.08∙10−4, а приT = 333Kk = 5.484∙10−2с−1. Определить энергию активации и константу скорости приT = 303K.
Решение.Используя соотношение (3.3), получим:

Используя то же соотношение, получаем:

Пример 3.5.Введение катализатора снижает энергию активации реакции с 88 000 до 63 000 Дж/моль. Рассчитать, во сколько раз при этом увеличивается скорость реакции, если реакция протекает приT = 298K.
Решение.Пустьv1иv2− скорости,
аk1иk2 − константы
скоростей реакции до и после введения
катализатора. Учитывая, что ,
и используя соотношение (3.4), получаем:
,
и используя соотношение (3.4), получаем:

Скорость увеличится в 24 300 раз.
Пример 3.6.Приt= 127 °С реакция заканчивается за 100 мин. Энергия активации 180 000 Дж/моль. Температуру повысили на 20 °С и ввели катализатор, понижающий энергию активации до 165 000 Дж/моль. Сколько времени потребуется для протекания реакции в этих условиях?
Решение.Сначала по формуле (3.3) рассчитывается изменение скорости реакции при повышении температуры от 400 до 420K:

Затем по формуле (3.4) рассчитывается изменение скорости при T = 420 Kв результате введения катализатора:

Общее увеличение скорости реакции, вызванное повышением температуры и введением катализатора, будет равно произведению изменений скоростей реакции в каждом случае:
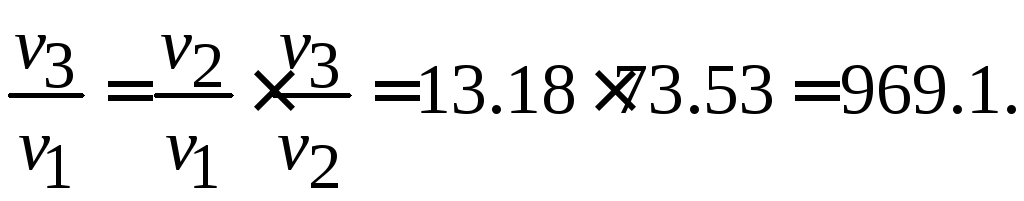
Время
τ, необходимое для протекания реакции,
обратно пропорционально скорости
реакции v, т. е.![]() .
В рассматриваемом случае
.
В рассматриваемом случае
 ,
,
отсюда
![]()
Время, за которое закончится реакция после повышения температуры и введения катализатора, составит 6.19 с.
