
книга / Alyautdin-Farmakologia
.pdfГлава 44. Системы доставки лекарственных средств |
1023 |
Однако громоздкая конструкция, необходимость в постоянном источнике питания, значительная продолжительность ингаляции и высокая стоимость снижают возможность применения данного устройства.
Анатомо-физиологические особенности легких обеспечивают некоторые преимущества для системного введения препаратов. Большая площадь альвеолярного дерева, тонкий эпителий дыхательных путей
иограниченное количество протеолитических ферментов превращают легкие в почти идеальное место для проникновения полипептидов
ипротеинов в системный кровоток. Разработан порошковый ингалятор для системного введения инсулина, но сложности с дозировкой пока ограничивают его использование в клинической практике. Перспективным также является ингаляционное применение и других пептидных гормонов (глюкагон, соматотропин). Еще одно направление в повышении эффективности систем ингаляционной доставки предполагает использование аэрозолей с высокопористыми частицами очень низкой плотности. Такие частицы менее подвержены агрегации и обеспечивают большую аэрозолизацию. Кроме того, эти частицы имеют «аэродинамический диаметр» (параметр, основанный на соотношении плотности и размера частицы), близкий к частицам традиционных аэрозолей, что позволяет, несмотря на относительно большой размер (5–20 мкм), достичь глубоких отделов легких. Попав в легкие, такие частицы не будут подвержены фагоцитозу, поскольку макрофаги способны фагоцитировать вещества не более 2–3 мкм. Таким образом, препараты могут вводится достаточно эффективно в течение длительного периода времени.
44.1.3. Трансдермальные системы доставки
Трансдермальные системы доставки используют для местного применения дерматологических препаратов и для системного введения ЛВ, как правило, с целью пролонгации их действия. Трансдермальные системы доставки включают в себя специальные лекарственные формы (пластыри, пленки) и различные методы увеличения проницаемости кожи для ЛС (ионофорез, сонофорез).
Роговой слой эпидермиса, состоящий из липидов и кератиноцитов, — главный барьер для трансдермального транспорта. Небольшие (<500 Да) липофильные молекулы ЛВ достаточно хорошо проникают через кожу в системный кровоток, минуя печень, путем пассивной диффузии. В настоящее время широко используют трансдермальные пластыри при заместительной гормонотерапии (эстрадиол, тестостерон), укачивании (скополамин), ишемической болезни сердца (нитроглицерин), никотиновой
1024 |
Часть II. Частная фармакология |
зависимости (никотин), гипертонии (клонидин), боли (фентанил, лидокаин) и др. Основные достоинства трансдермальных систем — высокая биодоступность препарата при неинвазивном пути введения и снижение гепатотоксического действия. Это обусловлено тем, что ЛВ попадает сразу в бассейн полой вены, минуя портальную. Кроме того, эти системы дают возможность обеспечить длительное поступление ЛС без колебаний концентрации препарата в крови, что очень важно для веществ с узким терапевтическим индексом. Таким образом, если к данным достоинствам добавить механизм, позволяющий решить проблему пенетрации вещества через роговой слой, то этот путь будет достаточно эффективен и для молекул, обычно не проникающих через кожу.
Ионофорез может быть одним из методов, позволяющих увеличить трансдермальный транспорт молекул с низким зарядом и низкой молекулярной массой. Для ионофореза используют электрические импульсы с низким напряжением в течение длительного времени. Эта технология уже используется в клинике для местного лечения гипергидроза и для системного введения анальгетиков. Также исследуется возможность использования высоковольтных токов в короткий промежуток времени (милисекунды). В эксперименте было показано, что данная технология вызывает временное обратимое появление пор в эпидермисе. Этот феномен, известный под названием электропорация, может быть использован в будущем для системного трансдермального введения больших, заряженных молекул, например, гепарина или олигонуклеотидов.
Ультразвуковое увеличение доставки ЛС через кожу (сонофорез) также было исследовано для доставки инсулина, интерферона и эритропоэтина. Ультразвук вызывает кавитацию кожи — образование очень малых пространств в роговом слое, заполненных воздухом. В результате эпидермис становится похожим на «сеть», через которую проникновение веществ увеличивается в 1 000 раз. При этом сонофорез не повреждает кожу, и ее структура через 2 ч возвращается в свое «нормальное» состояние, а ранние стадии клинических исследований показали отсутствие побочных действий этого метода. Более того, сонофорез может быть использован для диагностического взятия межклеточной жидкости, находящейся под роговым слоем. В эксперименте было показано, что в резервуар, расположенный между ультразвуковым датчиком и кожей крысы, можно эвакуировать межклеточную жидкость. Таким методом можно, например, измерять уровень глюкозы в крови для мониторирования суточных колебаний у больных сахарным диабетом.
Наряду с этим для увеличения трансдермального транспорта иногда используют микроиглы, липосомы, сурфактанты, алкоголь, макрофлюкс и др.
Глава 44. Системы доставки лекарственных средств |
1025 |
44.2. НОВЫЕ СИСТЕМЫ ДОСТАВКИ (ПОЛИМЕРНЫЕ СИСТЕМЫ)
Основное свойство полимерных систем доставки — постепенное высвобождение ЛС. Как правило, используют биодеградируемые материалы, полимеры синтетического и природного происхождения, среди которых наибольшее развитие получили полиэфиры — полилактиды, полилактидгликолиды, полиэтиленгликоль, полиангидриды, полиортоэфиры, полисахара (крахмал, декстран, хитозан), и в последние годы — полигидроксиалканоаты. Биодеградируемые носители лекарственных препаратов постепенно разрушаются в организме. При этом на скорость биодеградации полимерного матрикса и, соответственно, высвобождение ЛВ влияют многие факторы: химическая структура и состав, расположение мономеров, наличие ионных групп и случайных мономеров или дефектов в полимерной цепи, пространственная структура, молекулярный вес, наличие низкомолекулярных включений, параметры процесса изготовления, стерилизация, условия хранения, форма и место имплантации, адсорбируемые и абсорбируемые включения (вода, липиды, ионы и др.), физико-химические факторы (ионный обмен, ионная сила, рН), физические факторы (изменения формы и размера, коэффициента диффузии, разрушение вследствие растворения или давления), механизм гидролиза. Полимерные системы широко используют в самых различных областях медицины контрацепция, химиотерапия, лечение аритмий. Эти системы позволяют не только контролировать высвобождение, но и осуществлять целевую доставку ЛС.
44.2.1. Основные механизмы высвобождения препарата из полимерных систем
Основные механизмы высвобождения препарата из полимерных систем — диффузия, химическая реакция и активация.
Диффузия
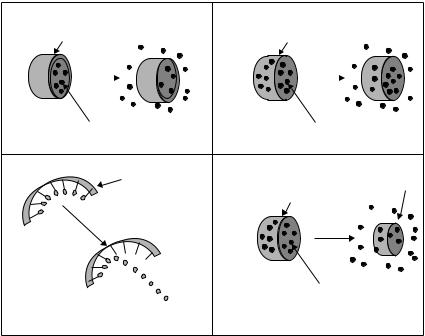
Диффузия из резервуара или капсулы — один из самых распространенных механизмов высвобождения ЛВ из полимерных систем (рис. 44.1А). В настоящий момент исследуются системы доставки, содержащие кетотифен, левотироксин♠ и др. Высокой эффективностью обладают противозачаточные средства Norplant♠, Monoplant♠ — контрацептивы длительного действия, имеющие диффузионный механизм высвобождения ЛС. Левоноргестрел, синтетический прогестин, хранится в небольших силико-
1026 |
Часть II. Частная фармакология |
новых трубочках, имплантированных в предплечье. Препарат медленно диффундирует через полимерную капсулу в течение 5 лет, обеспечивая эффективную длительную контрацепцию. Но, к сожалению, такие резервуарные системы ограничены размером молекулы ЛС, которая должна быть менее 300 Да.
Также широко используют матричную систему, в которой ЛС содержится не в одном большом резервуаре, а в комплексе взаимосвязанных пор внутри полимера (рис. 44.1Б). Эта система менее ограничена размером молекул ЛС, потому что каждая пора может разместить молекулы с молекулярной массой в несколько миллионов дальтон. Скорость диффузии между порами, а следовательно, внутри матрицы и из матрицы наружу системы контролируется архитектурой матрикса — плотные перетяжки и решетки между порами предотвращают быстрое высвобождение хранящегося там препарата. Такую систему используют в клинической практике для введения аналога гонадотропин-рилизинг гормона (ГнРГ). Аналог ГнРГ — пептидный гормон, ингибирующий продукцию гормонов передней доли гипофиза (ЛГ и ФСГ), эффективен при лечении гормональнозависимых заболеваний, таких как рак простаты. Главным ограничением этого терапевтического подхода in vivo был короткий период полуэлиминации аналога ГнРГ при внутримышечном введении. Однако при включении препарата в микрокапсулы полимера при внутримышечном введении период полуэлиминации ГнРГ значительно увеличивается, и терапевтическая концентрация сохраняется в течение 1–4 мес. Помимо диффузии, высвобождение ЛС из микрокапсул может осуществляться с помощью химической реакции между полимером и водой (рис. 44.1Г).
Химическая реакция
В полимерных системах, основанных на химической реакции, предусмотрено, что часть полимера с течением времени будет подвержена деградации. Этот процесс осуществляется за счет химической или ферментативной реакции. В некоторых конструкциях различные химические связи, соединяющие препарат с полимером, расщепляются в организме за счет эндогенных ферментов (рис. 44.1В). Обычно используются эфирные связи, так как карбоксильная и гидроксильная группы имеются в большинстве препаратов. Иногда использование эфирных связей невозможно, потому что они могут быть легко гидролизированы эстеразами, повсеместно распространенными в организме. Амидные связи, которые также часто используются, обладают относительно бо́льшей стабильностью фермента, чем эфирные связи. Особый интерес представляют пептидные связи, избирательно расщепляющиеся в тканях. Например, катепсин (ли-
Глава 44. Системы доставки лекарственных средств |
1027 |
зосомальная цистеиновая протеаза) вырабатывается в опухолевых клетках
вбо́льших количествах, чем в нормальных, следовательно, и концентрация препарата в опухоли будет значительно выше, чем в крови. Подобное действие имеет система доставки метотрексата, в которой используются связи, чувствительные к матричной металлопротеиназе-2.
Большинство нерастворимых полимеров способно подвергаться эрозии, в результате чего появляются большие поры, и структура становится неустойчивой и губкоподобной. При таком способе деградации достаточно тяжело достичь постоянной скорости высвобождения препарата, что создает потенциальный риск побочного и токсического действий, связанных с одномоментным высвобождением большой дозы ЛВ. Для решения этой проблемы были разработаны системы, в которых для оптимизации деградации были использованы гидрофобные мономеры, соединенные между собой ангидридными связями. Таким образом, деградации подвергается только поверхность матрицы. При этом скоростью деградации можно управлять с помощью комбинирования мономеров с более гидрофобными мономерами. В результате время, в течение которого полимер сохраняется, определяется соотношением используемых мономеров, а равномерно распределенный в такой полимерной матрице препарат будет высвобождаться длительно и с постоянной скоростью. Такие системы доставки находятся в экспериментальной стадии исследований для лечения эпилепсии, хронических ран, остеопороза. Первым фармакологическим средством с таким контролируемым высвобождением ЛС,
прошедшим все фазы клинических испытаний, стал противоопухолевый препарат Gliadel♠. После хирургического удаления мультиформной глиобластомы, агрессивной формы опухоли мозга, в месте опухоли размещается до восьми небольших пластин-полимеров с противоопухолевым препаратом кармустином. В процессе разрушения поверхности полимера, который длится в течение 1 мес, кармустин медленно высвобождается, при этом концентрация препарата в опухоли поддерживается на достаточном высоком уровне для обеспечения противоопухолевого действия,
вто время как негативных системных эффектов удается избежать. Такой принцип лечения значительно продлевает жизнь пациентов с этой формой рака.
Активация
Этот механизм высвобождения ЛС из полимерных систем доставки обеспечивается активацией растворителя, который, не вступая в реакцию с полимером химически, инициирует высвобождение ЛС посредством набухания полимера (рис. 44.1А) или осмоса (рис. 44.1Б).
1028 |
|
|
Часть II. Частная фармакология |
||
А |
Б |
||||
Полимерная капсула |
Полимерный матрикс |
||||
|
|
|
|
|
|
ЛС находится в резервуаре |
ЛС растворено внутри полимера |
|
В |
Полимерная |
Г |
|
Вода |
|
|
основа |
|
|
Полимерный матрикс |
|
|
|
|
|
Вода или фермент |
|
ЛС растворено внутри полимера
Вода или фермент высвобождают ЛС, разрушая связь с полимером
Рис. 44.1. Полимерные системы доставки лекарственных веществ (пояснения в тексте)
Примеры такой системы — пероральные лекарственные формы с пролонгированным высвобождением некоторых блокаторов кальциевых каналов, адреноблокаторов, органических нитратов и др. ЛС смешивается
сосмотически активным веществом, таким как соль, и покрывается мембраной, проницаемой для воды и не проницаемой для препарата. Затем
спомощью лазера в капсуле (мембране) проделывается небольшое отверстие. После приема внутрь постоянный осмотический приток воды через мембрану заставляет препарат высвобождаться через отверстие, тем самым обеспечивая длительную постоянную концентрацию ЛС в крови. По сравнению с обычными (немедленного высвобождения) пероральными лекарственными формами такая система доставки способна вызывать у пациентов больший эффект при лечении ишемической болезни сердца с меньшим
количеством побочных действий. Аналогичная система используется в препарате Concerta♠ с пролонгированным высвобождением метилфенидата для лечения детей с синдромом дефицита внимания и гиперактивности.
Глава 44. Системы доставки лекарственных средств |
1029 |
44.2.2. Интеллектуальные системы доставки
Существуют ситуации, при которых для обеспечения эффекта необходимо импульсное, непостоянное высвобождение ЛС. На такой основе функционирует вышеупомянутый небулайзер с системой ААD. Суть этого принципа состоит в том, чтобы постоянно адаптироваться к изменениям дыхания пациента и высвобождение ЛС осуществлять только во время вдоха, что исключает выделение аэрозоля во время выдоха, а также создает основу для более точной дозировки. На этом принципе основана импульсная система доставки инсулина, которая обеспечивает дополнительное болюсное введение гормона сразу после еды и тем самым предотвращает внезапное, чрезмерное повышение концентрации глюкозы в крови. Один из примеров регулируемой системы доставки — система доставки инсулина, содержащая специальные магнитные шарики, включенные в полимерную матрицу. В эксперименте на крысах данная система была имплантирована подкожно, инсулин медленно высвобождался путем диффузии из матрицы, как было уже описано выше. При внешнем воздействии переменного магнитного поля движение магнитных гранул в матрице вызывало повреждение пор, в которых находился инсулин, таким образом эффективно вытесняя его из матрицы, при этом доза инсулина напрямую зависела от величины приложенного магнитного поля. Другие методы увеличения скорости диффузии препарата из полимерной матрицы основаны на применении ультразвука либо электрического тока. Ультразвуковые системы доставки, используя волны определенной частоты, способны вызвать эффект, схожий с магнитными системами. Ультразвук вызывает кавитацию в полимере, разрушая пористую архитектуру полимера, обеспечивая быстрое высвобождение ЛС. Использование электрического тока может вызвать электролиз воды на поверхности некоторых полимеров, местно снижая рН и нарушая водородные связи внутри комплекса. Вследствие этого полимер разлагается быстрее, высвобождая большие дозы препарата. Импульсная доставка также может быть достигнута за счет различных условий окружающей среды. Например, могут быть разработаны гидрогели, чувствительные к изменению температуры или рН.
Оригинальная система доставки была создана на основе силиконовых микрочипов, обеспечивая более точный контроль за скоростью высвобождения ЛС. Каждый микрочип содержит до 1000 крошечных резервуаров с ЛС, покрытых тонким слоем золота. Применение небольшого внешнего напряжения на отдельный имплантированный резервуар электрохимически растворяет золото, высвобождая хранящийся там препарат. При этом
1030 |
Часть II. Частная фармакология |
резервуары можно наполнять и открывать по отдельности, что дает почти безграничные возможности для дозирования одного препарата в отдельности или при сочетании нескольких препаратов.
44.2.3. Целенаправленная доставка
Точная адресная доставка ЛС позволяет обеспечить высокую концентрацию препарата в патологическом очаге или в ткани без риска системных токсических эффектов. Наиболее простой способ целевой доставки — анатомическое размещение полимерной системы, как было описано при применении пластин-полимеров с противоопухолевым препаратом кармустином, размещенных в месте опухоли. Существуют и другие препараты, которые за счет анатомического расположения обеспечивают адресную доставку ЛС, среди них наиболее значимые — Estring♠, Nestorone♠ (вагинальное кольцо, обеспечивающее поступление эстрадиола непосредственно в слизистую оболочку влагалища для контрацепции или лечения постменопаузного синдрома), Озурдекс♠ (глазной имплантат, содержащий триамцинолона ацетонид, для лечения отека сетчатки при тромбозе центральной вены сетчатки), стенты (металлическая или пластиковая конструкция, помещенная в просвет полых органов для расширения участка, суженного патологическим процессом) при ангиопластике, которые изготавливаются со специальным лекарственным покрытием (импрегнация гепарином; алмазоподобное углеродное, фосфохолиновое, силиконкарбидное покрытие; золото, покрытие сиролимусом, эверолимусом) для профилактики рестеноза. Также в стадии разработки находятся такие перспективные препараты, как система доставки наносеребра для лечения хронических ран, фактора роста тромбоцитов (рlatelet-derived growth factor, PDGF) для повышения регенерации костной ткани, целый ряд препаратов для лечения болезней сетчатки, противовирусные препараты и др.
Ко многим тканям доступ возможен только через кровь, что значительно усложняет адресную доставку ЛС. Существуют пассивные и активные методы целенаправленной доставки полимерных систем при внутривенном введении. При пассивной адресной доставке используют различия
впроницаемости сосудов между нормальной и патологической тканью. Например, полимер, содержащий ЛС с высокой молекулярной массой,
вбольшей степени накапливается в опухолевых тканях, чем в нормальных, так как капилляры опухоли имеют большую проницаемость. Таким образом, вместо использования хотя и меньших доз низкомолекулярных противоопухолевых препаратов, но обладающих большим объемом рас-
Глава 44. Системы доставки лекарственных средств |
1031 |
пределения, выгоднее применять высокие и более эффективные дозы препарата с высокой молекулярной массой комплекса ЛС-полимер для целенаправленной доставки к опухолям. Кроме того, полимер с ЛС может быть сконструирован таким образом, чтобы ферментативное расщепление препарата осуществлялось после выхода полимерного комплекса из кровотока и захвата его опухолевыми клетками. В одной из таких систем противоопухолевый препарат доксорубицин сопряжен с растворимым в воде неиммуногенным полимером за счет пептидных связей (рис. 4.1В). Такой комплекс полимера с ЛС накапливается в опухоли меланомы мыши в концентрациях до 70 раз больше, чем в нормальной ткани, за счет высокой проницаемости сосудов опухоли. Оказавшись внутри клетки опухоли, пептидные связи расщепляются под действием лизосомальных протеаз, высвобождая цитотоксический препарат. При этом полимерная часть комплекса либо биодергадируется, либо удаляется из организма через почки.
Существует несколько методов активной целевой доставки ЛС. Например, человеческие IgM-антитела против опухолевого антигена могут быть использованы для транспорта полимерного комплекса с доксорубицином в злокачественные ткани. Связанный с полимером с помощью кислотнолабильных связей, доксорубицин избирательно будет высвобожден в кислой среде опухоли. В другой системе галактоза используется для транспорта полимера с ЛС в печень через асиалогликопротеиновые рецепторы клеточной поверхности гепатоцитов.
Кроме того, к активным методам целевой доставки относят целенаправленную доставку ЛС через гематоэнцефалический барьер. ГЭБ представляет собой непреодолимое препятствие для проникновения большого количества ЛС, в том числе антибиотиков, противоопухолевых препаратов и множества препаратов с нейротропной активностью. Такая избирательная проницаемость ГЭБ обусловлена не только морфологическим строением (выраженная базальная мембрана, плотные соединения между эндотелиоцитами, наличие астроцитов, микроглии), но и другими факторами, например наличием специального белка Р-гликопротеина, осуществляющего обратный транспорт веществ, проникших через ГЭБ (см. главу «Фармакокинетика лекарственных веществ»). Одним из решений проблемы проникновения через ГЭБ было создание полимерных наночастиц. Наиболее успешными показали себя полибутилцианоакрилатные и полилактид-ко-гликолидные наночастицы. Данные наночастицы, нагруженные различными ЛС, способны транспортировать препараты через ГЭБ в ЦНС. В эксперименте была показана способность целенаправленно доставлять в головной мозг такие терапевтические средства, самостоя-
1032 |
Часть II. Частная фармакология |
тельно не способные проникать через ГЭБ, как гексапептид даларгин♠, противопухолевый препарат доксорубицин, лоперамид, тубокурарин♠ и др. Несмотря на то, что механизм проникновения таких наночастиц через ГЭБ пока до конца не изучен, перспективы их клинического применения велики и являются широким полем для будущей деятельности ученых и клиницистов.
44.2.4. Липосомальные системы доставки
ЛС, связанные с полимером, — стабильная структура, которая может циркулировать в крови в течение длительного периода времени. Тем не менее эти полимеры могут содержать только небольшое количество препарата, тем самым ограничивая дозу введенного вещества. Способность липосом включать в себя самые разные вещества практически без каких-либо ограничений в отношении их химической природы, свойств и размера молекул дает большие возможности для решения множества проблем доставки ЛС через кровь. Высвобождение ЛС из липосомы осуществляется несколькими способами: эндоцитоз, слияние с клеточной мембраной, биодеградация липосомы и др. Основные свойства, которыми должны обладать липосомы, — специфическая тропность к определенным тка- ням-мишеням и защита от иммунной системы. Ввиду размера липосом наибольшей тканевой тропностью к ним обладают клетки ретикуло-эн- дотелиальной системы. Наряду с этим возможно и целенаправленное высвобождение ЛС из липосом, например при локальном воздействии температуры, рН, а также ультразвука. Для повышения специфичности можно использовать антитела, аналогичные тем, которые используются для активной целевой доставки комплекса полимер-ЛС. Например, антитела к протоонкогену HER2, стимулирующему рост злокачественных клеток молочной железы и других видов рака, в настоящее время изучаются в качестве высокоспецифического транспорта ЛС к опухоли. Антитела против E-селектина (гликопротеин, находящийся на клеточной поверхности эндотелиоцитов) могут быть использованы для целенаправленной доставки ЛС к сосудистым эндотелиальным клеткам. Защита липосомы от клеток ретикуло-эндотелиальной системы может быть достигнута путем добавления водорастворимых полимеров, таких как полиэтиленгликоль (ПЭГ), на липосомальную поверхность, что сделает липосомы более гидрофильными и менее подверженными захвату клетками органов ретикулоэндотелиальной системы. Свойство «пегилированных» липосом быть «невидимыми» дало им образное название «липосомы-невидимки» (stealth Liposomes) аналогично известному самолету-невидимке «стелс».
