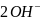Задачи Крюкова / ЭДС 3
.docx1. Запишите уравнение химической реакции, протекающей самопроизвольно в элементе:
Ag | Pb | PbJ2 (тв) | KJ (р-р) | AgJ (тв) | Ag
На основании табличных данных Ео и dEo/dT для этого элемента рассчитайте при 298 К стандартные значения ΔrGo, ΔrНo и ΔrSo реакции, протекающей в элементе.
Решение:
По приведенному гальваническому элементу составим уравнение химической реакции, также воспользуемся таблицей 79 и выпишем оттуда электроды:
Реакция |
E°, В |
AgI
+ e = Ag + |
-0,152 |
Pb |
-0,365 |
Суммарная
реакция:
2AgI
+ Pb
= Pb
+ 2Ag
Из
таблицы 81 выпишем ЭДС и температурный
коэффициент ЭДС: Eo=0,21069
В,
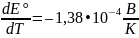 .
.
Запишем основные термодинамические выражения и произведем расчеты:
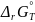 =
–nE°F=
–2 • 0,21069 • 96486 = –40657
=
–nE°F=
–2 • 0,21069 • 96486 = –40657
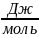
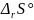 =
=
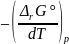 = nF
= nF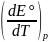 = 2 • 96486 • (–1,38 •
= 2 • 96486 • (–1,38 •
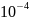 )
= –27
)
= –27
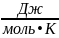
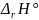 =
+ T •
= –40657+298 • (–27)= –48703
=
+ T •
= –40657+298 • (–27)= –48703

Ответ:
= –40657
;
= –27
;
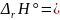 –48703
.
–48703
.
2. ЭДС гальванического элемента, составленного из насыщенного каломельного электрода (электрода сравнения) и хингидронного электрода (индикаторного) в данном растворе, рН которого неизвестен, при 298 К равна 0.163 В. Пользуясь справочными данными рассчитайте рН данного раствора, если электрод сравнения в данной цепи – отрицательный.
Решение:
Составим гальванический элемент из данных электродов. Для этого обратимся к таблице 79:
Реакция |
ЭДС |
|
E( |
|
E°= 0,699 В |
Гальванический элемент:
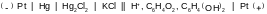
На основании данных, приведенных выше, рассчитаем pH, используя уравнение Нернста:
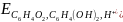 =
=
 –
–
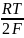 ln
ln
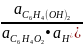
Активности
 и
равны 1, так как это чистые вещества.
и
равны 1, так как это чистые вещества.
E
=
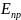 –
–
 =
–
ln
=
–
ln
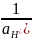 –
=
+
–
=
+
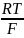 ln
ln
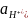 –
= 0,163 В
–
= 0,163 В
Так как pH = –lg
+
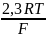 lg
= E +
lg
= E +
0,699+ lg = 0,163+ 0,2415
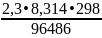 lg
=
–0,2945
lg
=
–0,2945
lg = –4,99
pH = 4,99
Ответ: pH = 4,99 .
3. Пользуясь справочными данными рассчитайте константу равновесия реакции:
Sn2+ + ClO4– + H2O = Sn4+ + ClO3– + 2OH–, протекающей при 298 К в водном растворе.
Решение:
Гальванический
элемент состоит из 2 окислительно-восстановительных
электродов: (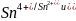 )
.
)
.
1)Запишем уравнения:
Электродная реакция |
E°, В |
|
0,15 |
|
0,36 |
2)E°
=
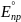 –
–
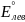 = 0,36 – 0,15 = 0,21 В
= 0,36 – 0,15 = 0,21 В
3)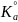 = exp(
= exp(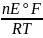 )
=
exp(
)
=
exp(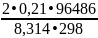 )
= 1,27•
)
= 1,27•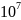
Ответ:
 1,27•
.
1,27•
.

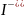
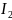 + 2e = Pb + 2
+ 2e = Pb + 2
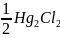 +
e = Hg +
+
e = Hg +
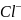
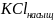 )
= 0,2415 В
)
= 0,2415 В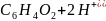 +
2e =
+
2e =
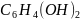
 +
2e
=
+
2e
=
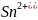
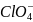 +
+
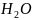 +2e =
+2e =
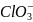 +
+