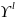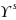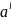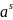лабы / Fkhot_laba1_Kryukova
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра микро- и наноэлектроники
отчет
по лабораторной работе №1
по дисциплине «ФХОТ изделий электроники и наноэлектроники»
Тема: Моделирование диаграмм состояния полупроводниковых систем с неограниченной растворимостью компонентов в жидкой и твердой фазах
Студентка гр. 8206 |
|
Крюкова И.А. |
Преподаватель |
|
Налимова С.С. |
Санкт-Петербург
2020
Цель работы: Изучение фазовых равновесий в бинарных полупроводниковых системах с непрерывным твердым раствором методом компьютерного моделирования; расчет параметров межатомного взаимодействия; выбор моделей растворов, адекватно описывающих экспериментальную Т-х-проекцию диаграммы состояния.
Экспериментальные результаты и исходные данные
Система: InAs-AlAs
Таблица 1: Координаты точек линий ликвидуса и солидуса
T, К |
XlB, мол. доли |
XSB, мол. доли |
1273 |
0,02 |
0,44 |
1339 |
0,03 |
0,64 |
1407 |
0,04 |
0,77 |
1539 |
0,06 |
0,88 |
1606 |
0,10 |
0,91 |
1706 |
0,17 |
0,94 |
1906 |
0,50 |
0,96 |
1939 |
0,60 |
0,97 |
1973 |
0,70 |
0,98 |
2000 |
0,84 |
0,98 |
Таблица 1: Исходные данные температур плавления и энтальпий плавления
Taпл, К |
Тbпл, К |
Напл, Дж/моль |
Нbпл, Дж/моль |
1215 |
2043 |
73600 |
142260 |
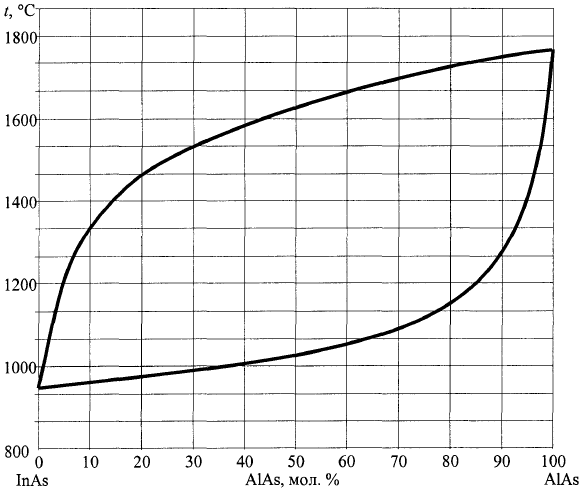
Рис.1 Т-х проекция диаграммы состояния системы InAs-AlAs
Обработка результатов эксперимента
Приведем Т-х проекции диаграмм состояния (экспериментальной и теоретически рассчитанной), а также найденные значения параметров взаимодействия Wl opt и Ws opt:
T,
К
X,
мол.

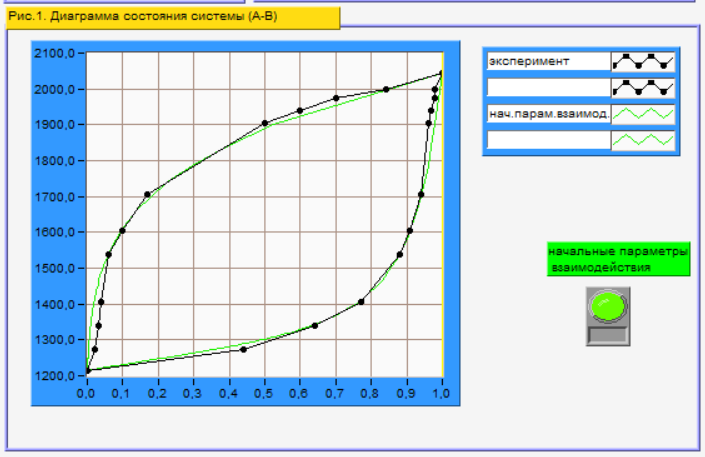
Рис.2 Т-х проекция диаграммы состояния системы InAs-AlAs, построенная в среде LabView
Был произведен поиск более точного приближения параметров взаимодействия к оптимальным.
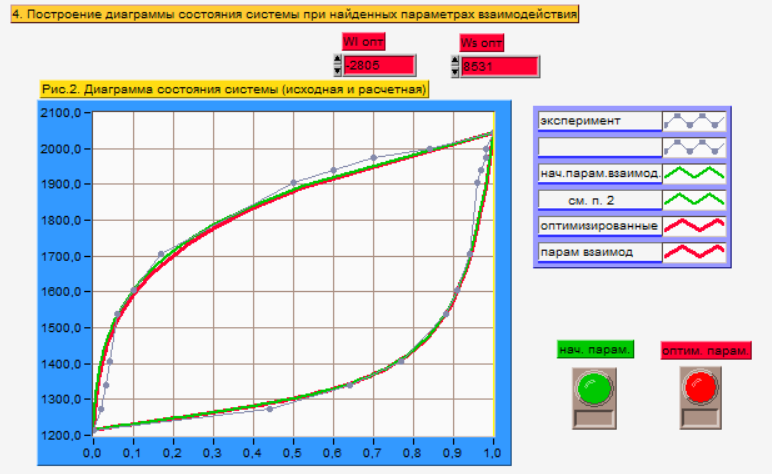
Рис.3 Т-х проекция диаграммы состояния системы, при найденных параметрах взаимодействия
Найдены следующие оптимальные параметры межатомного взаимодействия в жидком (Wl) и твердом (Ws) растворах:
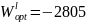 ;
;
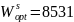
Приведем Т-х проекции диаграмм состояния, построенные в соответствии с п.11 методических указаний
T,
К
X,
мол.


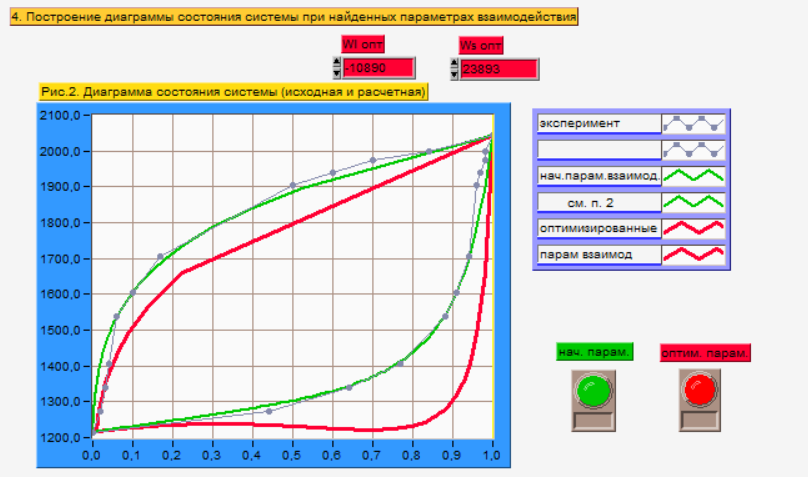
Рис.4 Т-х проекция диаграммы состояния системы InAs-AlAs, при найденных параметрах взаимодействия, отличающихся по знаку
При существенном изменении параметров Ws и Wl диаграмма состояния сильно отклоняется от теоретической кривой, что говорит о правильности нахождения оптимальных параметров.
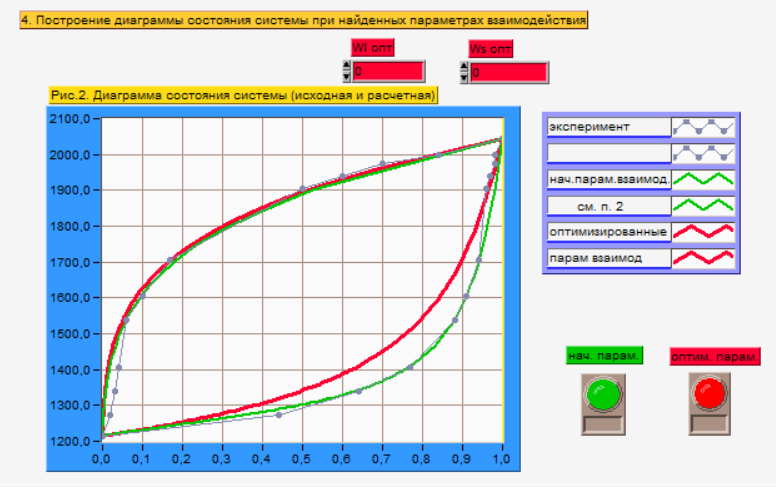
Рис.5 Т-х проекция диаграммы состояния системы InAs-AlAs, при параметрах взаимодействия, равных нулю (модель идеального раствора)
Расчет и построение концентрационных зависимостей термодинамических функций смешения
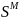 ,
,
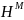 ,
,
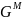 для твердого и жидкого растворов при
для твердого и жидкого растворов при
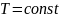 .
.
Пусть
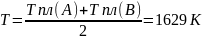 .
.
Расчетные формулы:
 ,
,
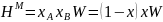 ,
,
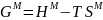 ,
,
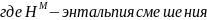 ;
;
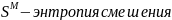 ;
;
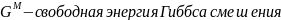 ;
;
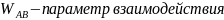 ;
;
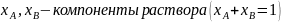 .
.
Пример
расчета при
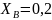 :
:
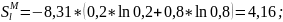
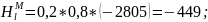
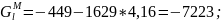
По
данным таблиц 3-4 построены графики
концентрационных зависимостей
 для жидкого и твердого растворов, которые
приведены на рисунках 6 и 7.
для жидкого и твердого растворов, которые
приведены на рисунках 6 и 7.
Таблица 3: Результаты расчета термодинамических функций смешения твердого р-ра
|
|
|
|
|
0 |
0 |
0 |
0 |
0 |
0,1 |
2,70 |
-252 |
-4653 |
-4400,64 |
0,2 |
4,16 |
-449 |
-7223 |
-6773,94 |
0,3 |
5,08 |
-589 |
-8858 |
-8269,26 |
0,4 |
5,59 |
-673 |
-9784 |
-9110,55 |
0,5 |
5,76 |
-701 |
-10084 |
-9383,13 |
0,6 |
5,59 |
-673 |
-9784 |
-9110,55 |
0,7 |
5,08 |
-589 |
-8858 |
-8269,26 |
0,8 |
4,16 |
-449 |
-7223 |
-6773,94 |
0,9 |
2,70 |
-252 |
-4653 |
-4400,64 |
1 |
0 |
0 |
0 |
0 |
Рис.6 Графики концентрационных зависимостей для твердого раствора
Таблица 4: Результаты расчета термодинамических функций смешения жидкого р-ра
|
|
|
|
|
0 |
0 |
0 |
0 |
0 |
0,1 |
2,70 |
-1787 |
-4267 |
-2479,95 |
0,2 |
4,16 |
-3178 |
-6999 |
-3820,96 |
0,3 |
5,08 |
-4171 |
-8837 |
-4665,98 |
0,4 |
5,59 |
-4766 |
-9901 |
-5134,42 |
0,5 |
5,76 |
-4965 |
-10256 |
-5290,56 |
0,6 |
5,59 |
-4766 |
-9901 |
-5134,42 |
0,7 |
5,08 |
-4171 |
-8837 |
-4665,98 |
0,8 |
4,16 |
-3178 |
-6999 |
-3820,96 |
0,9 |
2,70 |
-1787 |
-4267 |
-2479,95 |
1 |
0 |
0 |
0 |
0 |
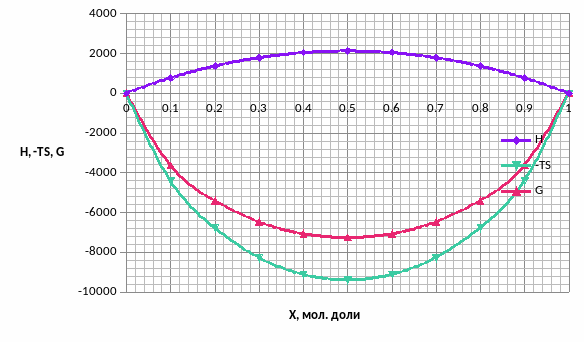
Рис.7 Графики концентрационных зависимостей для жидкого раствора
Таблица 5: Исходные данные для дальнейшего подсчета, построения графика
T, K |
TплА, К |
TплВ, К |
ΔHплА, Дж |
ΔHплВ, Дж |
SплА, Дж/К |
SплB, Дж/К |
GmА, кДж |
GmB, кДж |
1629 |
1215 |
2043 |
73600 |
142260 |
60,58 |
69,63 |
-25078,52 |
28828,02 |
Расчетные формулы и пример расчета:
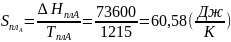
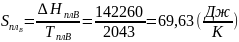
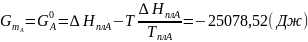
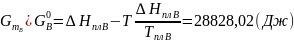
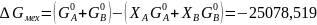
Таблица 6: Результаты расчета термодинамических функций для механической смеси
|
|
|
|
-25078,51852 |
0 |
-25078,519 |
0 |
-19687,86 |
-4653,09 |
-23320,72 |
0,1 |
-14297,21 |
-7222,74 |
-19706,19 |
0,2 |
-8906,56 |
-8858,31 |
-15384,31 |
0,3 |
-3515,90 |
-9783,75 |
-10579,02 |
0,4 |
1874,75 |
-10084,38 |
-5375,63 |
0,5 |
7265,40 |
-9783,75 |
202,29 |
0,6 |
12656,06 |
-8858,31 |
6178,30 |
0,7 |
18046,71 |
-7222,74 |
12637,73 |
0,8 |
23437,36 |
-4653,09 |
19804,51 |
0,9 |
28828,02 |
0 |
28828,02 |
1 |
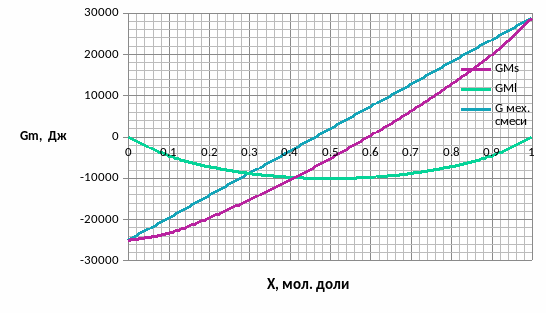
Рис.8 Зависимости свободной энергии Гиббса Gm от состава вещества для жидкого и твердого растворов
Расчет и построение концентрационных зависимостей коэффициентов активностей и активностей компонентов в твердом и жидком растворах при Т=const. Параметры взаимодействия используются те же, что и в пункте 3.
Пусть .
Расчетные формулы:
Активность компонентов:
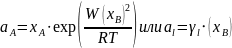
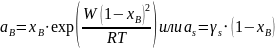
Коэффициент активности:
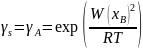

Пример
расчета для
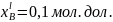 :
:
 ;
;
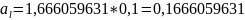 .
.
Таблица 7: Расчетные значения коэффициента активности в твердом и жидком растворах
, мол.доли |
|
|
0 |
1,877984599 |
1 |
0,1 |
1,666059631 |
0,997930045 |
0,2 |
1,496796975 |
0,991745853 |
0,3 |
1,361786715 |
0,981523913 |
0,4 |
1,25466889 |
0,967389954 |
0,5 |
1,170639049 |
0,949516373 |
0,6 |
1,106090658 |
0,928118734 |
0,7 |
1,058357233 |
0,903451445 |
0,8 |
1,025528375 |
0,875802724 |
0,9 |
1,006321891 |
0,845489002 |
1 |
1 |
0,812848916 |
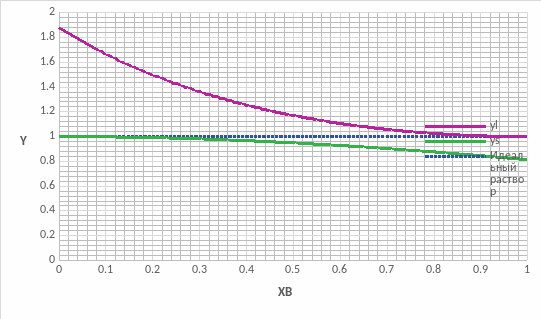
Рис.9 Концентрационные зависимости коэффициентов активностей компонентов в твердом, жидком и идеальном растворах
Таблица 6: Расчетные значения активностей для компонентов в твердом и жидком растворах
, мол.доли |
|
|
0 |
0 |
1 |
0,1 |
0,166605963 |
0,898137041 |
0,2 |
0,299359395 |
0,793396683 |
0,3 |
0,408536014 |
0,687066739 |
0,4 |
0,501867556 |
0,580433972 |
0,5 |
0,585319524 |
0,474758186 |
0,6 |
0,663654395 |
0,371247494 |
0,7 |
0,740850063 |
0,271035434 |
0,8 |
0,8204227 |
0,175160545 |
0,9 |
0,905689702 |
0,0845489 |
1 |
1 |
0 |
Для
идеальных растворов:
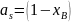 ;
;
 ;
;
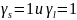 .
.
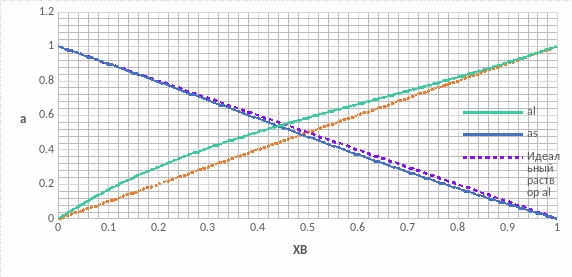
Рис.10 Концентрационные зависимости активностей компонентов для твердого, жидкого и идеального растворов
Расчет и построение температурной зависимости коэффициента активности компонентов А и В в твердом растворе для одного состава . Использовать формулы расчета из п.4 для коэффициента активности
Таблица 7: Расчетные значения для температурной зависимости коэффициента активности
T, K |
XsB, мол.доли |
(1/T)*1000, К¯ᶦ |
ϒА |
ϒB |
InϒА |
InϒB |
1687 |
0,2 |
0,592768 |
1,024640 |
0,879805 |
0,024341 |
-0,128055 |
1659 |
0,2 |
0,602773 |
1,025061 |
0,877905 |
0,024752 |
-0,130216 |
1629 |
0,2 |
0,613874 |
1,025528 |
0,875803 |
0,025208 |
-0,132614 |
1602 |
0,2 |
0,624220 |
1,025964 |
0,873847 |
0,025633 |
-0,134849 |
1578 |
0,2 |
0,633714 |
1,026364 |
0,872057 |
0,026023 |
-0,136900 |
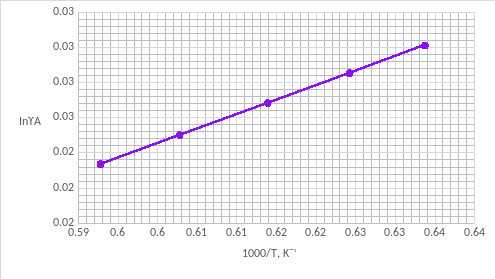
Рис.11 Зависимость коэффициента активности от температуры для компонента А в твердом растворе для состава XB=0,2 мол. доли.
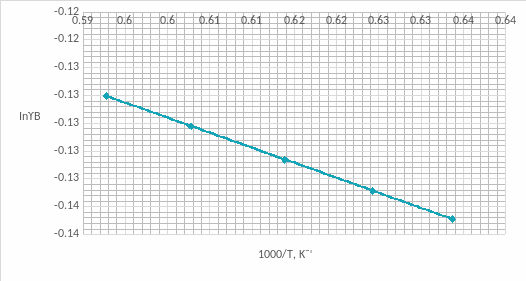
Рис.12 Зависимость коэффициента активности от температуры для компонента В в твердом растворе для состава XB=0,2 мол. доли.
Расчет равновесных коэффициентов распределения компонентов А и B при заданной температуре.
Заданная температура: .
По расчетной диаграмме состояния системы на рис.3 определяем, что при Т=1629 К:
Для компонента B:
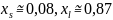 .
.
Для компонента A:
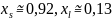 .
.
Расчетные формулы и сам расчет:
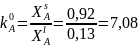
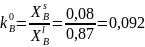
Вывод:
В данной лабораторной работе мы изучили фазовые равновесия в бинарных полупроводниковых системах с непрерывным твёрдым раствором методом компьютерного моделирования.
В качестве модели, описывающей экспериментальную Т-х-проекцию диаграммы состояния, была выбрана модель регулярного раствора. Она удобна по нескольким причинам: 1) энтропия смешения определяется только конфигурационной составляющей; 2) энтальпия смешения характеризуется как линейная функция числа различных пар связей; 3) параметр взаимодействия не зависит от температуры и состава раствора.
Нами было исследовано влияние изменения абсолютной величины (не равна исходной) и знака параметров взаимодействия (обратный исходному) на зависимость. Вследствие данных манипуляций ликвидус и солидус приобретают более явный изгиб с максимумом (минимумом) вблизи состава компонент А и В соответственно.
На графике зависимости коэффициентов активности компонента А(рис.11) наблюдается положительное отклонение от модели идеального раствора, а у компонента В(рис.12) - отрицательное. Это обосновано тем, что параметры взаимодействия имеют различные знаки.
Так же были рассчитаны равновесные коэффициенты распределения компонентов А и B при заданной температуре T = 1629 К:

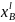 ,
мол.доли
,
мол.доли ,
Дж/К
,
Дж/К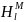 ,
Дж
,
Дж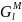 ,
Дж
,
Дж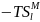
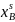 ,
мол.доли
,
мол.доли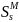 ,
Дж/К
,
Дж/К ,
Дж
,
Дж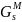 ,
Дж
,
Дж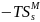
 ,
Дж
,
Дж
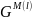 ,
Дж
,
Дж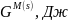
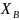 ,
мол. доли
,
мол. доли