
- •Вопрос 1.Дисперстные системы.Классификация дс.
- •Вопрос 2 Поверхностные явления: поверхностная энергия, поверхностное натяжение. Самопроизвольные процессы в поверхностном слое Поверхностные явления.
- •Вопрос 4. Адсорбция на границе «жидкий раствор - газ». Пав (ориентация молекул пав в поверхностном слое), пив. Уравнение адсорбции Гиббса. Теория мономолекулярной адсорбции Ленгмюра.
- •Вопрос 6. Адсорбция растворенного в жидкости вещества на твердом адсорбенте. Молекулярная адсорбция. Ионная адсорбция из растворов. Ионообменная адсорбция. Смачивание. Адгезия.
- •Вопрос 7. Получение и очистка коллоидных растворов. Оптические свойства коллоидных растворов.
- •8. Электролитические свойства коллоидных растворов: электрокинетические явления в гидрофобных золях, образование и строение дэс, дзета-потенциал. Факторы, от которых зависит дзета-потенциал.
- •10. Устойчивость коллоидных растворов: седиментационная и агрегативная.
- •11. Коагуляция. Правила коагуляции.
- •12. Факторы устойчивости лиофобных золей. Виды коагуляции электролитами. Коагуляция смесью электролитов. Защита коллоидных частиц.
Вопрос 6. Адсорбция растворенного в жидкости вещества на твердом адсорбенте. Молекулярная адсорбция. Ионная адсорбция из растворов. Ионообменная адсорбция. Смачивание. Адгезия.
Особенности:
Необходимо учитывать все виды взаимодействия в жидких растворах (растворитель-растворитель; вещество-растворитель; вещество-вещество)
Необходимо учитывать сложное строение поверхности твердого тела.
Явление адсорбции очень многообразно. Его обычно классифицируют в зависимости от природы адсорбтива: молекулярная, ионная, адс.коллоидных частиц.
Молекулярная адсорбция

- это адсорбция из растворов неэлектролитов или слабых электролитов. В-в адсорбируется в виде молекул.
Где C0 B C1 – начальная и равновесная концентрация адсорбтива, (мольл-1 ), V- объем растворителя из которого происходит адсорбция; m-кол-во адсорбента, г;
Факторы, влияющие на молекулярную адсорбцию:
Концентрация
Сs – равновесная концентрация
Описывается теорией Ленгмюра или БЭТ.
Природа р-ля
Тк молек. Р-ля конкурируют при адсорбции с молек. В-ва, то чем хуже адсорб. Р-ль, тем лучше адсорб. В-во
Правила:
Адсорбция идет лучше из водных р-ров, чем из органич.
Правило Шилова: чем лучше р-ль растворяет в-во, тем оно хуже адсорбируется.
Природа адсорбента
Влияют:
- полярность (полярные адс адсорбируют неполярные в-ва, неполярные – полярные.
- пористость (если молекулы малы, то при увеличении пористости идет увеличение адсорбции. Если молекулы большие, то понижение пористости).
Природа адсорбтива
Правило уравнивания полярностей Ребиндера:
Процесс адсорбции идет в ту сторону уравнивания полярностей фаз; он идет тем сильней, чем больше разность полярностей.
Температура
Чем выше температура, тем ниже адсорбция.
Ионная адсорбция
- адс растворов сильных электролитов, в-во адс в виде ионов.
Особенности:
Адс только ионы
Идет только на полярных адсорбентах
Всегда сопровождается образованием ДЭС
В основе лежат химические силы
Характерно явление ионно-обменной адсорбции
Влияют:
Природа адсорбента
Чем более полярен адсорбент, тем лучше он адс из водных растворов.
Природа иона
Чем больше заряд иона, тем лучше адсорбируется.
Чем больше радиус, тем больше адс.
Адсорбция ионов поверхностью кристаллов
Правило Паннета-Фаянса:
На кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и образ труднорастворимые соединения.
Ионно-обменная адсорбция
- процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из р-ра.
Особенности:
Специфична – только определенные ионы
По своей природе близка к хим явлениям
Не всегда обратима
Протекает более медленно
Может изменять Рн среды
Смачивание.
Смачивание – это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другими жидкими телами при наличии одновременного контакта с воздухом.
Существует 2 случая:
1) когда капля полностью растекается по поверхности - полное смачивание,
2) когда капля принимает почти сферическую форму - полное не смачивание.
Между этим случаями наблюдается частичное смачивания. Мерой смачивания является краевой угол .
Краевой угол – это угол, который образует капля с поверхностью твердого тела со стороны жидкости. Это угол между твердой поверхностью и касательной в точке соприкосновения фаз (угол всегда измеряют со стороны жидкости).
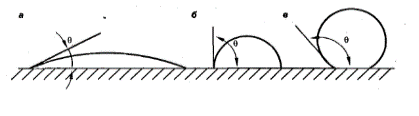
а) 90 - гидрофильная
б) = 90
в) 90 – гидрофобная
Адгезия.
Адгезия (прилипание) – это взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы.
Работа адгезии (Wа) – это работа обратимого разрыва адгезионной связи, отнесенная к единице площади, Дж/м2.
