
- •Вопрос 1.Дисперстные системы.Классификация дс.
- •Вопрос 2 Поверхностные явления: поверхностная энергия, поверхностное натяжение. Самопроизвольные процессы в поверхностном слое Поверхностные явления.
- •Вопрос 4. Адсорбция на границе «жидкий раствор - газ». Пав (ориентация молекул пав в поверхностном слое), пив. Уравнение адсорбции Гиббса. Теория мономолекулярной адсорбции Ленгмюра.
- •Вопрос 6. Адсорбция растворенного в жидкости вещества на твердом адсорбенте. Молекулярная адсорбция. Ионная адсорбция из растворов. Ионообменная адсорбция. Смачивание. Адгезия.
- •Вопрос 7. Получение и очистка коллоидных растворов. Оптические свойства коллоидных растворов.
- •8. Электролитические свойства коллоидных растворов: электрокинетические явления в гидрофобных золях, образование и строение дэс, дзета-потенциал. Факторы, от которых зависит дзета-потенциал.
- •10. Устойчивость коллоидных растворов: седиментационная и агрегативная.
- •11. Коагуляция. Правила коагуляции.
- •12. Факторы устойчивости лиофобных золей. Виды коагуляции электролитами. Коагуляция смесью электролитов. Защита коллоидных частиц.
Вопрос 1.Дисперстные системы.Классификация дс.
ДС – гетерогенная система, в которой одно вещество находится в раздробленном состоянии.
Разделяются по:
Гетерогенность – минимум 2 вещества
Дисперсность – одно раздробленное вещество
В дисперсной системе большая площадь раздела фаз, поэтому определяющим свойством является свойство поверхности.
Классификация ДС:
По размеру частиц ДФ – d, см
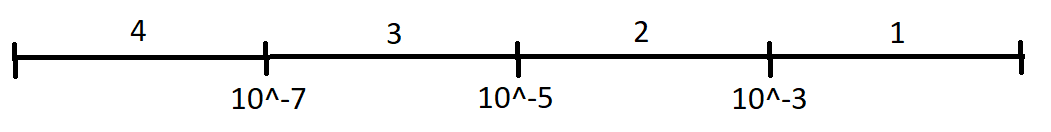
1. d ≥ 10^-3 – грубодисперсные
2. 10^-5 < d < 10^-3 – микрогетерогенные
3. 10^-7 < d < 1-^-7 – коллоидные
4. d ≤ 10^-7 - истинные
По соотношению ДФ – ДС
-
ДС
ДФ
Название
Пример
Г
Ж
Аэрозоль
Туман
Тв
Смог
Ж
Г
Пены
Пивная, мыльная
Ж
Эмульсии
Молоко, кровь
Тв
Суспензии (золи)
Краски, пасты
Тв
Г
Тв. пена
Керамика, хлеб
Ж
Гель
Желе
Тв
Тв. суспензии (золи)
Сплавы, стекло
По взаимодействию ДФ – ДС
Лиофобные – ДФ не взаимодействует с ДС.
Лиофильные – ДФ взаимодействует с ДС и в определенных условиях не растворяется (желе).
По межчастичному взаимодействию
Свободнодисперсные – частицы не взаимодействуют друг с другом и свободно перемещаются (желе).
Связанодисперсные – частицы связаны друг с другом межмолекулярными силами, образуя пространственную сетку-каркас (гель).
Вопрос 2 Поверхностные явления: поверхностная энергия, поверхностное натяжение. Самопроизвольные процессы в поверхностном слое Поверхностные явления.
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
С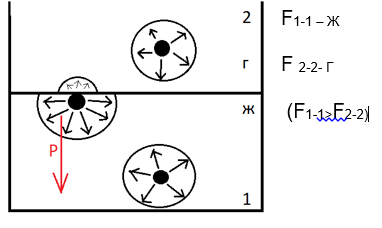 илы,
действующие на молекулы, находящиеся
на разделах фаз, не скомпенсированы
(сила F2-1(cила,
которая действует на молекулы со стороны
жидкости) > F2-2
(cилы,
действующие со стороны газа).
илы,
действующие на молекулы, находящиеся
на разделах фаз, не скомпенсированы
(сила F2-1(cила,
которая действует на молекулы со стороны
жидкости) > F2-2
(cилы,
действующие со стороны газа).
Поэтому на молекулу действует результирующая сила Р, которая старается перевести молекулу внутрь фазы Р= F1-1 - F 2-2
Чтобы образовать межфазную поверхность, нужно перевести часть молекул из объема на поверхность. Для этого необходимо совершить работу против внутреннего давления, поэтому все молекулы на поверхности раздела фаз обладают более высокой энергией. Эта энергия называется поверхностной энергией.
П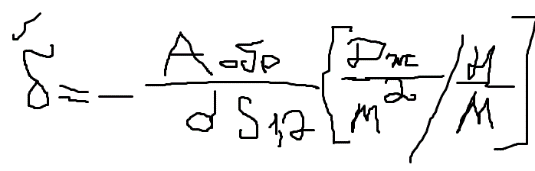 оверхностное
натяжение характеризуется избытком
поверхностной энергии, приходящийся
на 1 м2
межфазной
поверхности.
оверхностное
натяжение характеризуется избытком
поверхностной энергии, приходящийся
на 1 м2
межфазной
поверхности.
Поверхностное натяжение равно обратимой изотермической работе, которую надо затратить, чтобы увеличить площадь интерфазной поверхности на единицу.
1) U,Т= const
-![]() =-
df =>
=-
df =>![]() =
dF/ dS1,2
=> dF=
=
dF/ dS1,2
=> dF=![]() dS1,2
dS1,2
2) P,T=const
dG=
-
![]() A
=>
A
=>
![]() =
-
=
- => dG=
dS1,2
=> dG=
dS1,2
САМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ В ПОВЕРХНОСТНОМ СЛОЕ
1)V,T,n=const
F=![]() S
(1)
S
(1)
2)P,T, n=const
G=![]() S(2)
S(2)
Дифференцируем 1 и 2:
dF=![]() dS+Sd
dS+Sd![]()
dG=![]() dS+Sd
dS+Sd![]()
Самопроизвольно, когда:
dF<0, dG<0
![]() dS+Sd
dS+Sd![]() <0
<0
индивидуальных в-в
 =
const (d
=0)
=
const (d
=0)
![]() Пример:
слипание частиц, стремление капель к
сферической форме, рост кристалла.
Пример:
слипание частиц, стремление капель к
сферической форме, рост кристалла.
2)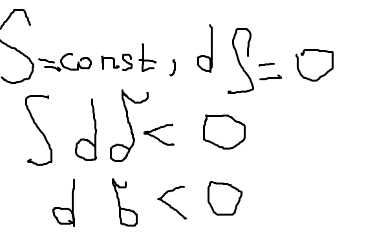 Адсорбция – процесс самопроизвольный.
Адсорбция – процесс самопроизвольный.
В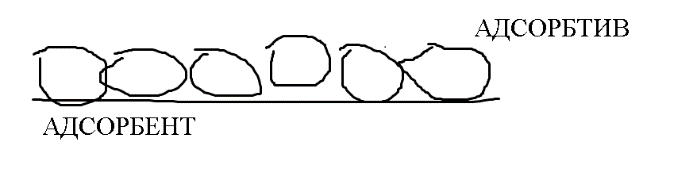 ОПРОС
3. АДСОРБЦИЯ: количественные характеристики
и классификация
ОПРОС
3. АДСОРБЦИЯ: количественные характеристики
и классификация
Адсорбция-это самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме.
Адсорбция ↔ десорбция
КОЛИЧЕСТВЕНЫЕ ХАРАКТЕРИСТИКИ АДСОРБЦИИ:
Избыточная или гиббсовская адсорбция (Гj) Гj =
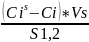 ,
где Cis
– концентрация на поверхности, Ci
– концентрация в объеме, V
– объем поверхностного слоя (считается
2-ухмерным), S1,2
– площадь
поверхности раздела фаз.
Так как
CmV
= ν,
то Гj=
,
где Cis
– концентрация на поверхности, Ci
– концентрация в объеме, V
– объем поверхностного слоя (считается
2-ухмерным), S1,2
– площадь
поверхности раздела фаз.
Так как
CmV
= ν,
то Гj= , [моль/дм2]
, [моль/дм2]Абсолютная адсорбция Cis >> Ci и νis >> νi – хорошо адсорбируется. Ai =
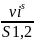 [моль/дм2]
[моль/дм2]Удельная адсорбция В тех случаях, когда поверхность трудно измерить, количество вещества относится к массе адсорбента αi =
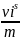 ,
αi
=
,
αi
=
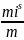 Для
адсорции газов вместо количества
вещества используют (ν
– V)
Различают
положительную и отрицательную
адсорбцию:
Г, А, α
> 0 и Г, А, α
< 0
Для
адсорции газов вместо количества
вещества используют (ν
– V)
Различают
положительную и отрицательную
адсорбцию:
Г, А, α
> 0 и Г, А, α
< 0
КЛАССИФИКАЦИЯ АДСОРБЦИОННЫХ ПРОЦЕССОВ
Физическая адсорбция Обусловлена силами межмолекулярного взаимодействия Молекула не полярна - дисперсионные взаимодействия Молекула полярна – индукционные, ориентационные, дисперсионные взаимодействия Особенности:
Обратимость Адсорбция ↔ десорбция C+CO2 = C*CO2,
(C+CO2 – адсорбент, C*CO2 – адсорбционный комплекс).
Малая специфичность На полярных адсорбентах адсорбируются полярные, на неполярных - не полярные.
Малая теплота адсорбции ΔHадс ≈ 8 – 40 кДж/моль
При повышении температуры адсорбция уменьшается T↑→адс↓
Химическая адсорбция Между адсорбентом и адсорбтивом силы взаимодействия химические (в результате хим. Реакции образуется новое хим. вещество) Особенности:
Необратимость 2C+O2 → C*CO2 C*CO2 → C+CO2
Специфичность - возможна тогда, когда есть химическая реакция
Высокая теплота адсорбции ΔHадс = 800 – 1000 кДж/моль
Повышение теплоты способствует адсорбции T↑→адс↑
