
Лекции / Лекция 7
.pdf
«Есть только одно благо – знание и одно только зло – невежество» (Сократ, древнегреческий философ, 471…399 г. г. до н. э.)
Лекция №7
МЕТАЛЛЫ В
СТРОИТЕЛЬСТВЕ
1.Определение и классификация
2.Строение металлов
3.Общие сведения о железоуглеродистых сплавах
4.Чугун
5.Сталь
6.Термическая обработка металлов
7.Цветные металлы и сплавы
8.Металлические изделия
9.Коррозия металлов и способы защиты
1. Определение и классификация
Металлами называют кристаллические вещества с закономерным расположением атомов в узлах пространственной решётки, обладающие непрозрачностью, характерным металлическим блеском и хорошей способностью проводить тепло, электрический ток и отражать световые лучи.
Для металлов характерны также:
плотная кристаллическая структура;
высокая прочность;
способность к значительным пластическим деформациям, что даёт возможность обрабатывать их давлением (прокатка, ковка, штамповка, волочение);
хорошие литейные свойства;
способность к образованию сплавов;
1
свариваемость;
выносливость ‒ способность работать при низких и высоких температурах и
др.
Наличие этих свойств и характеризует, так называемое, металлическое состояние вещества. Такими свойствами обладают три четверти всех элементов в периодической системе Д. И. Менделеева. Неметаллы не обладают вышеперечисленными свойствами и сильно отличаются по строению, физическим и химическим свойствам от металлов.
Условно (исторически) металлы подразделяются на две большие группы: черные и цветные (рис. 7.1). К черным металлам, имеющим темно-серый цвет, относятся железо и сплавы на его основе (сталь, чугун и ферросплавы). Все остальные металлы и сплавы составляют группу цветных (нежелезных) металлов. Характерной окраской для них является красная, желтая и белая. Однако наибольшее применение в строительстве имеют черные металлы. Стоимость их значительно ниже цветных. Вместе с тем цветные металлы обладают рядом ценных свойств, благодаря которым они тоже применяются в строительстве.
Из группы цветных металлов выделяют благородные и редкие. Благородные получили такое название благодаря очень высоким физико-химическим и механическим свойствам, как в чистом виде, так и в виде соединений с другими металлами. К ним относят золото, серебро и платиновые металлы.
Признаками редкого металла в технике считается малая распространенность в природе, сложная технология получения, сравнительная новизна практического применения и др. Поэтому важнейшими отраслями их применения являются ядерная энергетика, ракетная техника, радиоэлектроника. К ним относят галлий, индий, бериллий, цезий и др.
Различают технически чистые металлы и сплавы. Чистые металлы состоят из одного основного элемента и незначительного количества примесей других элементов. По степени чистоты различают металлы технической, высокой и особой чистоты. Однако чистые металлы находят ограниченное применение, как в строительстве, так и в других областях промышленности. В большинстве случаев они обладают недостаточно высокими физическими, механическими и химическими свойствами, имеют сравнительно высокую стоимость, достаточно сложную технологию получения и переработки и мало пригодны для технических целей. Их используют, как правило, только в тех случаях, когда к материалу предъявляются высокие требования в отношении тепло- и электропроводности, высокой температуры плавления и т. п. Например, провода, кабели, обмотки электрических машин и др.
Для изменения свойств металлов в требуемом направлении их сплавляют с другими элементами. Такие соединения или системы, состоящие из двух или нескольких металлов или металлов и некоторых неметаллов, называют сплавами, а элементы, входящие в их состав, – компонентами.
2

Металлы и сплавы
Черные металлы и сплавы |
|
Цветные металлы и сплавы |
|
|
|
|
|
|
|
|
|
|
|
|
Сталь |
|
|
Чугун |
|
|
Редкие |
Легкие |
Тяжелые |
Благородные |
Углеродистая |
Легиро- |
|
Ферро- |
|
Обыкновен- |
Галлий |
Магний |
Олово |
Золото |
Леги- |
|
Индий |
|
Платина |
|||||
нелегиро- |
ванная |
ро- |
сплав |
|
ный нелеги- |
Бериллий |
Цинк |
Серебро |
|
ванная |
|
ванный |
|
|
рованный |
Цезий |
Алюминий |
|
|
|
|
|
|
|
|
|
Свинец |
|
|
|
|
|
|
|
|
|
|
|
|
Низкоуглеродистая |
Среднеуглеродистая |
Высокоуглеродистая |
Дюралюминий |
Ртуть |
|
||||
|
|
||||||||
С 0,25% |
С = 0,25…0,5% |
|
С 0,6% |
|
|
Медь |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Силумин |
Бронза |
|
|
|
|
|
|
|
|
|
|
|
Низколегирован- |
Среднелегированная |
Высоколегированная |
|
|
|
|
|||
ная 2,5% |
|
2,5…10% |
|
10% |
|
Авиаль |
Латунь |
|
|
|
|
|
|
|
|
|
|
Медно-никелевые |
|
|
|
|
|
|
|
|
|
сплавы |
|
Белый |
|
Серый |
Ковкий |
Высокопрочный |
Чугун с особыми |
|
|
||
(передельный) |
(литейный) |
|
|
свойствами |
|
|
|||
|
|
|
|
|
|
||||
Рис. 7.1. Классификация металлов и сплавов
3
По числу компонентов сплавы делятся на двухкомпонентные (двойные или бинарные), трехкомпонентные (тройные) и многокомпонентные. Компонент, преобладающий в сплаве количественно, называется основным, а компоненты, вводимые в сплав для придания ему нужных свойств – легирующими. Совокупность компонентов сплава называется системой. Изменяя компоненты и соотношения между ними, получают сплавы с самыми разнообразными физическими, механическими или химическими свойствами.
Сплавы тоже обладают всеми характерными свойствами металлов, однако качественные характеристики их обычно резко отличаются от чистых исходных металлов и их можно регулировать. Например, сплав, содержащий 40% кадмия и 60% висмута, имеет температуру плавления 144ºС, а температура плавления составляющих его компонентов – соответственно 321ºС и 271ºС, т. е. намного выше.
Сплавы, как правило, превосходят чистые металлы по прочности, твердости, износостойкости, жаропрочности, обрабатываемости резанием, литейным свойствам и т. д. (табл. 7.1). Поэтому сплавы применяются значительно шире чистых металлов. Однако в технике, как чистые металлы, так и сплавы объединены под общим термином «металлы».
2. Строение металлов
Внутреннее строение металлов. Поскольку металлы в твердом состоянии в отличие от аморфных веществ имеют кристаллическое внутреннее строение, то образующие их элементарные частицы (атомы) в процессе кристаллизации из расплавленного (жидкого) состояния группируются в строго определенной последовательности. Для описания такого строения французским ученым О. Браве (Auguste Bravais) было введено понятие кристаллической (пространственной) решётки, т. е. математической системы точек в пространстве. Условно кристаллическая решётка представляет собой воображаемый элемент объёма, образованный минимальным количеством атомов, многократное повторение которого в пространстве позволяет построить весь кристалл.
Всего существует 14 различных типов кристаллических решёток. Металлы преимущественно кристаллизуются в одном из трёх типов структур: объёмноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Для изображения кристаллической решётки пользуются упрощенными схемами (рис. 7.2).
В объёмно-центрированной кубической решётке содержится девять атомов: восемь расположены в вершинах куба и один – в центре объёма. Такую решётку имеют молибден, вольфрам, ванадий и другие металлы.
4
Таблица 7.1. Физико-механические свойства металлов и сплавов
Металл |
Плотность, г/см3 |
Температураплавления, °С |
Теплопроводность, /(Втм∙К) |
Теплоемкость, /(Джг∙К) |
Коэффициентлинейного расширениятеплового , α,∙10-6, К-1 |
Удельное электросопротивление, ρ, мкОм∙м |
прочностиПредел при разрыве, МПа |
Относительное удлинение, % |
поТвердостьБринеллю, НВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алюминий |
2,7 |
657…660 |
218…237 |
0,87…0,96 |
21,0…24,8 |
0,026…0,029 |
75…180 |
30…40 |
16…25 |
|
|
|
|
|
|
|
|
|
|
Бронза |
7,5…9,1 |
955…1050 |
38…335 |
0,385 |
16…18 |
0.095…0,1 |
520…1350 |
3…50 |
35…250 |
|
|
|
|
|
|
|
|
|
|
Вольфрам |
19,32 |
3370…3420 |
153…173 |
0,13…0,14 |
4,3…4,5 |
0,053…0,055 |
2000…400 |
3 |
200…400 |
|
0 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дюралюминий |
2,6…2,9 |
650…750 |
160 |
0,91 |
22,6…23,8 |
0,022…0,025 |
120…540 |
12…24 |
44…64 |
|
|
|
|
|
|
|
|
|
|
Железо |
7,874 |
1535…1540 |
73…80 |
0,44…0,46 |
10,7…12,2 |
0,097…0,135 |
200…300 |
40…50 |
50…80 |
|
|
|
|
|
|
|
|
|
|
Латунь |
8,50…8,85 |
880…1070 |
75…245 |
0,37…0,39 |
17…20 |
0,031…0,108 |
350…850 |
5…65 |
53…170 |
|
|
|
|
|
|
|
|
|
|
Медь |
8,89…8,96 |
1083…1084 |
386…406 |
0,38…0,40 |
15,6…16,8 |
0,016…0,018 |
250…400 |
0,5…35 |
35…40 |
|
|
|
|
|
|
|
|
|
|
Никель |
8,88…8,90 |
1453…1455 |
75…92 |
0,44…0,47 |
11,7…13,5 |
0,068…0,087 |
600…720 |
35…50 |
68…100 |
|
|
|
|
|
|
|
|
|
|
Олово |
7,31 |
232 |
63…66 |
0,226 |
16,0…31,4 |
0,114…0,120 |
20…32 |
40 |
4…5 |
|
|
|
|
|
|
|
|
|
|
Свинец |
11,35 |
327…328 |
31…35 |
0,12…0,13 |
29,0…29,1 |
0,205…0,227 |
10…18 |
50…70 |
3,8…4,2 |
|
|
|
|
|
|
|
|
|
|
Серебро |
10,50 |
960,5 |
407…453 |
0,22…0,23 |
17,63…19,5 |
0,015…0,016 |
150…200 |
50…65 |
24…25 |
|
|
|
|
|
|
|
|
|
|
Сталь |
7,87…8,20 |
1400…1530 |
20…52 |
0,4815 |
11,0…16,0 |
0,10…0,14 |
330…3000 |
6…35 |
120…600 |
|
|
|
|
|
|
|
|
|
|
Титан |
4,52 |
1660…1680 |
16…22 |
0,47…0,55 |
8,15 |
0,42…0,80 |
240…670 |
50 |
73…160 |
|
|
|
|
|
|
|
|
|
|
Хром |
7,10…7,53 |
1830…1900 |
88,6…93,9 |
0,44…0,46 |
6,2…8,7 |
0,13…0,21 |
410 |
<3 |
70…114 |
|
|
|
|
|
|
|
|
|
|
Цинк |
7,14 |
419…420 |
113…116 |
0,34…0,35 |
29,0…35,0 |
0,0592 |
120…290 |
30…40 |
30…45 |
|
|
|
|
|
|
|
|
|
|
Чугун |
6,8…7,8 |
1147…1260 |
42,0…93,0 |
0,46…0,55 |
8,0…11,0 |
0,15…0,16 |
150…1200 |
0,8…22 |
100…550 |
|
|
|
|
|
|
|
|
|
|
5
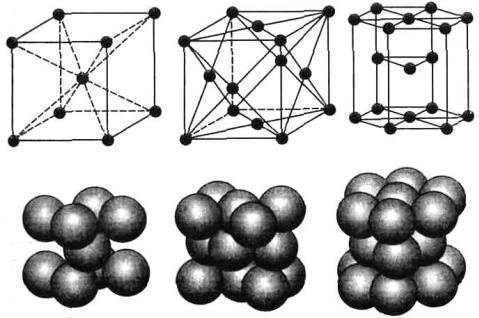
В гранецентрированной кубической решётке находится четырнадцать атомов, которые расположены в вершинах куба и в центре каждой грани. Такая кристаллическая решётка характерна для железа, никеля, меди, алюминия, свинца, золота, серебра и др.
а |
б |
в |
Рис. 7.2. Основные типы кристаллических решеток и схемы упаковки в них атомов:
а– объемно-центрированная кубическая; б – гранецентрированная кубическая;
в– гексагональная плотноупакованная
Вгексагональной плотноупакованной решётке содержится семнадцать атомов, которые расположены в вершинах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такой тип кристаллической решётки имеют магний, цинк, кадмий, альфа-цирконий и другие металлы.
При этом линии на схемах и точечное расположение атомов в узлах кристаллической решётки являются условными. В действительности атомы имеют определенные размеры, колеблются с большой частотой в узлах решётки и могут соприкасаться друг
сдругом внешними слоями электронных оболочек. Основными параметрами кристаллической решётки являются период, коэффициент компактности, координационное число и базис.
Полиморфные превращения в металлах. Сущность полиморфизма (от греч.
рolymorphos – многообразный) состоит в том, что под влиянием определенных процессов (изменение температуры, давления) некоторые вещества, в том числе и ряд металлов, способны изменять свою кристаллическую решётку при сохранении химического состава, т. е. существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия. С физической точки зрения превращение металла из одной формы в другую обусловливается внутренней перегруппировкой молекул, которая ведет к изменению его кристаллической структуры и свойств. При этом различ-
6
ные формы кристаллической решётки одного металла называют полиморфными модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определённого для данного металла интервала температур. Температура, при которой происходит превращение одной кристаллической модификации в другую, называется температурой полиморфного превращения.
Полиморфизм (аллотропия) характерен для железа, олова, кобальта, титана и некоторых других металлов. Медь, алюминий не претерпевают полиморфных превращений. Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз. Например, кобальт при разных температурах может иметь гранецентрированную или гексагональную кристаллическую решётку, железо – объёмно-центрированную или гранецентрированную кубическую решётку.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ и т. д. Низкотемпературную модификацию железа называют α-, при более высокой – β-, затем γ-модификацией. Температуры перехода одной модификации железа в другую (911ºС и 1392ºС) называются критическими точками (табл. 7.2). При этом углерод и другие компоненты и примеси меняют положение критических точек на температурной шкале.
В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму. Поэтому такое превращение называют ещё перекристаллизацией, и сопровождается оно скачкообразным изменением всех свойств металлов и сплавов: плотности, теплоемкости, тепло- и электропроводности, прочности и др. На практике полиморфизм используется в технологическом процессе при термической обработке металлов.
3. Общие сведения о железоуглеродистых сплавах
Определение и классификация. Термин «железо» (имеется несколько версий происхождения славянского слова «железо», в т. ч. и белорусского «жалеза») соответствует названию химического элемента, которым условно называют низкоуглеродистые стали и чистое железо. При этом под чистым железом понимается тяжелый металл серебристо-белого цвета с содержанием примесей не более 0,6%, в том числе углерода ≤0,04%. Чистое железо, которое может быть получено в настоящее время, содержит 99,999% Fe. Техническое железо содержит 0,1…0,2% примесей.
Следует также отметить, что технически чистое железо имеет сравнительно невысокие физико-механические характеристики: твёрдость по Бринеллю (80 НВ, т.е. 80 кгс/мм2), временное сопротивление – 250 МПа при достаточно высокой пластичности (относительное удлинение при разрыве – 50%). Кроме того, чистое железо в природе, за исключением метеоритного, практически не встречается. Это объясняется способностью железа сравнительно легко соединяться с другими элементами, особенно с кислородом.
7
В природе железо чаще всего встречается в составе железных руд в виде оксидов (Fe3O4, Fe2О3, 2Fe2O3∙3H2O) и других соединений. После извлечения железа из руд оно содержит в своем составе определенное количество углерода и небольшое количество примесей (сопутствующих металлов и газов). Соединения железа с углеродом называ-
ют железоуглеродистыми сплавами.
Таким образом, то, что в обиходе называют железом, является сплавом железа с углеродом в виде стали или чугуна, представляющими собой важнейшие материалы в различных отраслях промышленности. Сплавы, содержащие углерод в количестве
0…0,02%, называются техническим железом, 0,02…2,14% – сталями, 2,14…6,67% –
чугунами. Но это теоретическое определение чугуна. На практике содержание углерода в чугунах находится в пределах 2,5…4,5%.
Свойства железоуглеродистых сплавов, их назначение и способы обработки определяются количеством углерода. Углерод придает сплавам железа прочность и твердость, снижая пластичность и вязкость.
П р и м е ч а н и е ‒ Металлическим сплавом называют материал, полученный сплавлением двух или более металлов или металлов с неметаллами при их нагреве выше температуры плавления и обладающий металлическими свойствами. Углерод является неметаллическим элементом с температурой плавления 3500оС. В природе может существовать в двух полиморфных модификациях: алмаз и графит. В железоуглеродистых сплавах в свободном виде углерод находится в форме графита. Прочность и пластичность его весьма низкие. Растворим в железе в жидком и твердом состояниях, может образовывать химическое соединение «цементит».
Фазовые и структурные составляющие железоуглеродистых сплавов. В за-
висимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие фазы: жидкий раствор, твердые растворы (феррит и аустенит),
химическое соединение (цементит) и тонкие механические смеси фаз – эвтектическая
(ледебурит) и эвтектоидная (перлит).
П р и м е ч а н и е ‒ Фаза – однородная часть системы, отделенная от других частей границей раздела, при переходе через которую скачкообразно меняются строение и свойства.
Феррит (от лат. ferrum – железо) – твердый раствор внедрения углерода (и других примесей, например, Mn, Si) в α-железе. Имеет объёмно-центрированную кубическую решётку. Растворимость углерода в α-железе весьма мала. При комнатной температуре она составляет не более 0,005%, максимальная (при температуре 727ºС) – 0,02%. Поэтому феррит представляет собой почти чистое железо, но отличается от него тем, что в его кристаллической решётке, кроме атомов железа, имеется небольшое количество атомов углерода и других примесей. Феррит характеризуется низкой твёрдостью (80…100 НВ) и прочностью (σв=250 МПа), но высокой пластичностью (δ=40…50%) и ударной вязкостью. Чем больше феррита в сплавах, тем они мягче и пластичнее. Феррит хорошо поддается обработке давлением в холодном состоянии (волочению, штамповке).
8
Аустенит (по имени английского ученого W. Robertsa-Austena) – твердый раствор внедрения углерода (и других элементов) в γ-железе. В железоуглеродистых сплавах может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе при температуре 1147ºС – 2,14% (точка Е на рис. 7.3 и в табл. 7.2)
иминимальная (0,8%) при температуре 727ºС (точка S). При нормальной температуре (18…24ºС) аустенит в простых железоуглеродистых сплавах отсутствует и его увидеть нельзя. Кристаллическая решётка аустенита – гранецентрированный куб. Аустенит характеризуется достаточно высокой пластичностью (δ=40…50%) и сравнительно низкой твёрдостью (160…200 НВ), но более высокой, чем у графита. Хорошо поддается горячей обработке давлением.
Цементит – химическое соединение железа с углеродом (карбид железа Fe3C) при содержании железа 93,33% и углерода – 6,67%. Назван так за высокую твёрдость (легко царапает стекло). Эта самая твердая (более 800 НВ) и хрупкая составляющая железоуглеродистых сплавов. Пластичность практически нулевая. Чем больше цементита в железоуглеродистых сплавах, тем большей твёрдостью и меньшей пластичностью они обладают. Температура плавления цементита – около 1600ºС. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита.
Перлит (от франц. perle – жемчуг, указывает на перламутровый отлив шлифа) – механическая смесь феррита и цементита, содержащая 0,83% углерода. Является продуктом распада аустенита в процессе его охлаждения при 727ºС. Распад аустенита на перлит называется эвтектоидным превращением, а перлит – эвтектоидом. Эвтектоид
(от эвтектика и греческого eidos – вид) – аналогичная эвтектике структурная составляющая металлических сплавов, но в отличие от неё образуется не из жидкой, а из твердой фазы и поэтому имеет более тонкое внутреннее строение из двух и более фаз (перлит). Эвтектика (от греческого eutektos – легко плавящаяся) – тонкая смесь твердых веществ, одновременно начинающихся кристаллизоваться из расплавов при температурах менее температуры плавления отдельных компонентов или любых других смесей. В зависимости от формы частичек цементита (пластинки или зерна) перлит может быть пластинчатым или зернистым, что и определяет его механические свойства. Чаще всего перлит имеет пластинчатое строение и является прочной структурной составляющей (предел прочности достигает 800 МПа, относительное удлинение – 15%
итвердость – 160…220 НВ).
Ледебурит (по имени немецкого ученого А. Ледебура) – механическая смесь (эвтектика) аустенита и цементита, содержащая от 2 до 6,67% углерода. Образуется при кристаллизации расплава при температуре 1147ºС. При температуре 727ºС аустенит превращается в перлит, и после охлаждения ледебурит представляет собой смесь перлита с цементитом. Ледебурит обладает большой хрупкостью и высокой твёрдостью (600…700 НВ), хорошими литейными свойствами. Содержится во всех высокоуглеродистых сплавах, называемых белыми чугунами.
9
Cталь, содержащая 0,83% углерода, называется эвтектоидной. Если в стали углерода менее 0,83%, то её называют доэвтектоидной, а при содержании углерода более 0,83%, но не более 2,14% – заэвтектоидной. Структура доэвтектоидной стали состоит из феррита и перлита, эвтектоидной – только из перлита, заэвтектоидной – из перлита и вторичного цементита.
Чугун, содержащий углерода больше 2,14%, но меньше 4,3%, называют доэвтектическим. При содержании углерода 4,3% чугун называют эвтектическим, а при содержании углерода более 4,3%, но менее 6,67% – заэвтектическим. Доэвтектический чугун имеет структуру перлита, ледебурита (распавшийся) и вторичного цементита. Эвтектический чугун состоит только из ледебурита, заэвтектический – из первичного цементита, имеющего форму пластин, и ледебурита (распавшегося).
Помимо перечисленных структурных составляющих в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: оксиды, нитриды,
сульфиды, фосфиды и др.
Диаграмма состояния железоуглеродистых сплавов. Диаграммы состояния представляют собой графические изображения фазового состава сплавов в зависимости от температуры и концентрации химических компонентов в условиях равновесия. Строятся они в координатах «температура – состав сплава».
Диаграмма состояния железоуглеродистых сплавов может быть представлена в двух вариантах: метастабильном, отражающем превращения в системе «железо – карбид железа», и стабильном, отражающем превращения в системе «железо – графит». Наибольшее практическое значение имеет диаграмма состояния «железо – карбид железа», так как для большинства технических сплавов превращения реализуются по этой диаграмме. Карбид железа (Fe3C) называют цементитом, поэтому метастабильную диаграмму железоуглеродистых сплавов называют ещё диаграммой состояния «железоцементит» (Fe – Fe3C).
Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава. Определять оптимальную температуру жидкого расплава перед разливкой, оценить жидкотекучесть сплава и склонность его к получению химической неоднородности, объяснить зависимость структуры и, соответственно, свойств сталей и чугунов от содержания углерода, делать выводы о способности сплава пластически деформироваться, т. е. о возможности и условиях обработки давлением, определять режимы термической обработки.
На рис. 7.3 диаграмма состояния «железо – цементит» представлена в упрощенном виде и показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67%). На горизонтальной оси концентраций отложено не только содержание углерода от 0 до 6,67%, но и содержание цементита. Левая вертикальная ось соответствует 100% содержанию железа. На ней отложены температура плавления железа и температуры его полиморфных превращений. Правая вертикальная ось (6,67% углерода) соответствует 100% содержанию цементита. Буквенное обозначение точек диаграммы принято согласно международному стандарту.
10
