
- •Кислицын А.А. Физика атома, атомного ядра и элементарных частиц
- •Итак, с одной стороны, результаты опытов
- •При описании внутриатомных явлений мно- гие законы классической физики неприме- нимы или ограниченно
- •В основе теории Бора лежат два постулата Бора:
- •Правило квантования Бора
- •Правило частот Бора
- •Опыты Франка и Герца.
- •Опыты Франка и Герца. Схема установки.
- •Результаты опытов Франка и Герца
- •Обобщенная формула Бальмера (Balmer J.)
- •Комбинационный принцип
- •Комбинационный принцип и второй постулат Бора
- •Теорию Бора часто называют "полуклассической". В ее основе лежат два постулата, которые противо-

Кислицын А.А. Физика атома, атомного ядра и элементарных частиц
03. (0). Квантовые постулаты Бора.
Опыты Франка и Герца.

Итак, с одной стороны, результаты опытов
Резерфорда показывает справедливость планетарной модели атома и не допуска-
ют никакой иной интерпретации. С другой стороны, планетарная модель противоре-
чит законам классической электродинами-
ки. Из этого противоречия может быть сде-  лан только один вывод: построить теорию
лан только один вывод: построить теорию атома в рамках классической физики
атома в рамках классической физики 
невозможно.

При описании внутриатомных явлений мно- гие законы классической физики неприме- нимы или ограниченно применимы. В мик- ромире действуют представления и зако- ны, описываемые квантовой физикой.
Первой теорией, позволившей правильно описать многие важные свойства атомов, была теория Бора (Bohr N., 1913г, Нобе-  левская премия в 1922г). Благодаря своей
левская премия в 1922г). Благодаря своей
простоте и наглядности эта теория до сих пор используется для описания многих
внутриатомных явлений.

В основе теории Бора лежат два постулата Бора:
Первый постулат. Из бесконечного числа электрон- ных орбит, возможных с точки зрения классичес- кой физики, в действительности осуществимы то- лько некоторые определенные орбиты, на которых электрон, несмотря на движение с ускорением, во- преки классической электродинамике не излучает
энергию. На этих орбитах (или в этих состояниях)
атомные системы обладают энергиями, образую-
щими дискретный ряд: E1, E2,… , En. Все эти орби-  ты (или состояния) наз. стационарными. Та из
ты (или состояния) наз. стационарными. Та из
стационарных орбит, на которой энергия минима- льна, называется основной, остальные - возбуж- денными.
(В классической физике энергия движущегося элект- рона может быть любой). 

Правило квантования Бора
На вопрос о том, как выделить эти стационарные орбиты из
бесконечного множества орбит, разрешаемых класси- ческой механикой, отвечает правило квантования Бора: в
стационарном состоянии электрон, двигаясь по круго-вой
орбите, должен иметь дискретные квантованные
значения момента импульса L:
L = mevrn = n
где n - целое число (квантовое число n = 1, 2, 3, …),h / 2 - "приведенная" постоянная Планка (h - "обычная" постоянная Планка),
me - масса электрона, v - скорость электрона,
rn - радиус стационарной орбиты,  соответствующей квантовому числу n.
соответствующей квантовому числу n.

Правило частот Бора
 Второй постулат (правило частот Бора): при переходе электрона с одной стационарной ор-
Второй постулат (правило частот Бора): при переходе электрона с одной стационарной ор-
биты с квантовым числом n на другую стацио-
нарную орбиту с квантовым числом m излучает- ся (поглощается) один фотон с энергией:
hν = En - Em |
(3.2) |
Здесь - частота излучения, h - "обычная" посто- янная Планка (Planck M.), En и Em - энергии  электрона на n-й и m-й стационарных орбитах.
электрона на n-й и m-й стационарных орбитах.

Опыты Франка и Герца.
 Непосредственное экспериментальное подтверждение квантовых постулатов Бора было получено в опытах Франка и
Непосредственное экспериментальное подтверждение квантовых постулатов Бора было получено в опытах Франка и
Герца (Franck J., Hertz G., 1913 г., Нобе-
левская премия в 1925 г.). Идея этих
опытов заключалась в следующем: ато- мы разреженного газа “обстреливаются” электронами, и при этом регистрируется
характер соударения: упругое или  неупругое.
неупругое. 
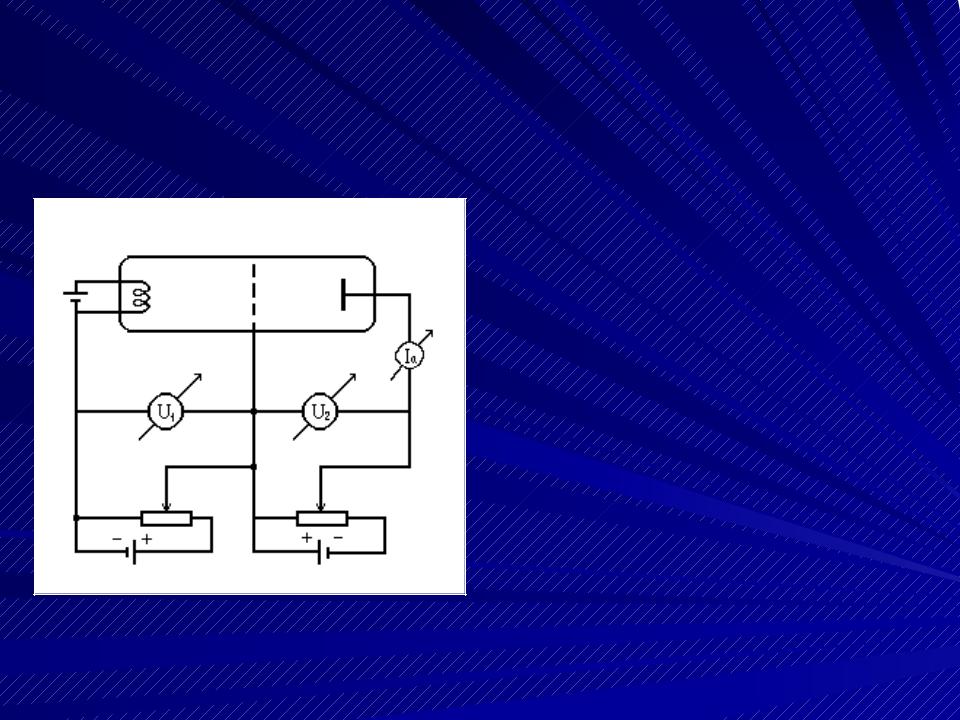
Опыты Франка и Герца. Схема установки.
Между катодом и сеткой трехэлектродной вакуум- ной лампы приложена разность потенциалов U1, ускоряющая электроны до энергии eU1. Между сеткой и анодом прило-  жена задерживающая разность потенциалов U2. В результате анода могут достигнуть только те электроны, энергия кото- рых eU1 > eU2.
жена задерживающая разность потенциалов U2. В результате анода могут достигнуть только те электроны, энергия кото- рых eU1 > eU2.
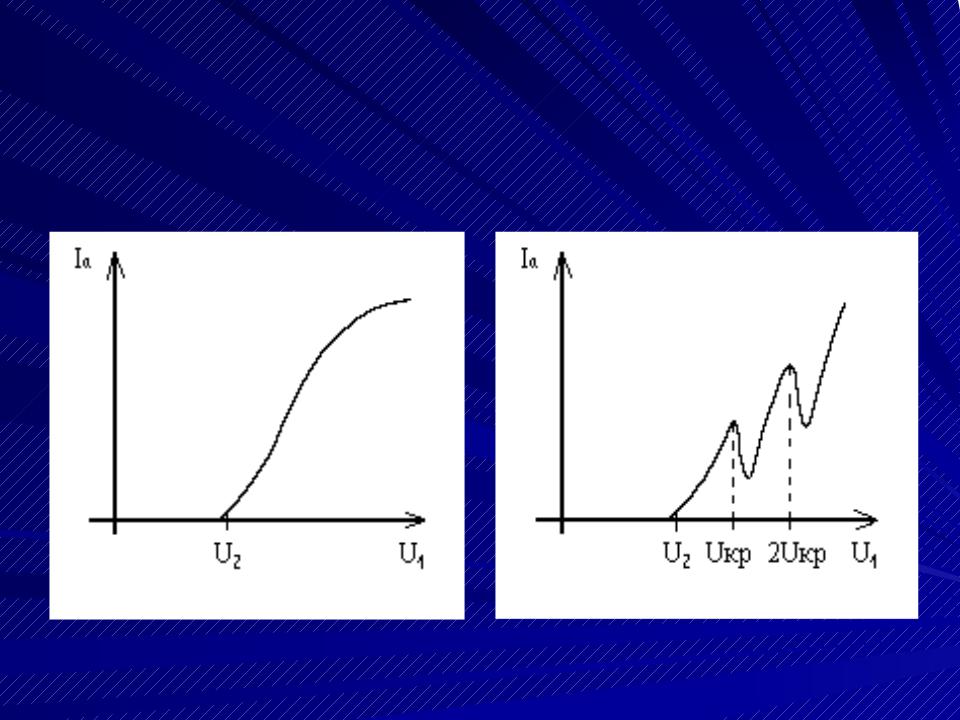
Результаты опытов Франка и Герца
В вакууме |
В разреженном |
|
газе |

Обобщенная формула Бальмера (Balmer J.)
|
1 |
|
1 |
|
1 |
|
|
||
k = |
|
= R |
|
|
- |
|
|
|
(3.3) |
|
n |
2 |
m |
2 |
|||||
|
|
|
|
|
|
|
|||
где R = 109677,6 см-1 - постоянная Ридберга (Rydberg J.).
Формулу Бальмера можно записать в другом виде:
k |
1 |
T (n) T (m) |
(3.4) |
|
|
||||
|
|
|
где T(n)=R/n2, T(m)=R/m2 - спектральные термы.
Другими словами, волновое число любой линии спектра водорода можно представить как раз-
ность двух спектральных термов.
