
задачи экз анал
.pdf
2. При гравиметрнческом определении меди в анализируемом образце в пяти параллельных анализах нашли массовую долю меди, равную (%): 10,2; 10,32; 10,35; 10,38; 10,42. Рассчитайте доверительный интервал среднего результата определения меди при доверительной вероятности
0,95.
3. В пяти параллельных определениях нашли следуюшее содержание примеси, %: 0,010; 0,010; 0,020; 0,020; 0,030. Рассчитайте доверительный интервал тыл и относительную ошибку определения среднего результата при доверительной вероятности Р = 0,95.

4. При стандартизации раствора НСl получены следующие результаты для молярной концентрации С(НСl) в пяти параллельных титрованиях, моль/л: 0,9957; 0,9962; 0,9968; 0,9972; 0,9980. Рассчитайте стандартное отклонение, доверительный интервал и относительную ошибку определения среднего результата при доверительной вероятности Р = 0,95.
5. При определении аммиака в пяти параллельных анализах получены следующие результаты для молярной концентрации аммиака С(NНЗ) в анализируемом растворе, моль/л: 0,0545; 0,0552; 0,0560; 0,0565; 0,0571. Рассчитайте для массы аммиака в анализируемом растворе объемом 25 мл стандартное отклонение, доверительный интервал темя и относительную ошибку определения средней массы й при доверительной вероятности Р = 0,95.

6. При перманганатометрическом определении массы железа в анализируемом растворе объемом 25 мл в пяти параллельных анализах была найдена в анализируемом растворе концентрация железа равная, моль/л: 0,0319; 0,032; 0,0322; 0,0324; 0,0326. Рассчитайте для массы железа(2) в анализируемом растворе стандартное отклонение, доверительный интервал ттт и относительную ошибку определения средней массы ііі при доверительной вероятности Р = 0,95.
7. При бромометрическом определении массовой доли салицилата натрия в анализируемом образце массой = 0,1000 г образец растворили в 50 мл воды. В пяти параллельных определениях

нашли молярную концентрацию эквивалента салицилата натрия, равную, моль/л: 0,0742; 0,0743; 0.0745; 0,0745; 0,0746. Рассчитайте для массовой доли салицилата натрия в анализируемом образце стандартное отклонение, доверительный интервал шыш и относительную ошибку определения средней массовой доли в при доверительной вероятности P = 0,95.
8. Контроль качества препарата пирацетама на содержание в нем суммы посторонних примесей (массовой доли w) дал следующие результаты в пяти параллельных определениях, %: 0,45; 0,48; 0,50; 0,52; 0,55. Истинное значение содержания посторонних примесей равно р = 0,50%.
Охарактеризуйте воспроизводимость полученных результатов, рассчитав доверительный интервал среднего при доверительной вероятности Р = 0,95, и наличие или отсутствие систематической ошибки.
9. При оценке правильности методики определения олова в реагенто, получены следующие результаты анализа: введено олова р = 10,00 мкг; найдено для доверительного интервала средней массы олова (п = 9; Р = 0,99) та.-Ай = 10,2 * 0,3 мкг; стандартное отклонение .: = 0,27. С использованием 1-критерия охарактеризуйте правильность методики анализа, вычислив tрассчит. если tтабл. = 3,36.

10. При спектрофотометрическом определении нитрита натрия №№, 3 анализируемом растворе содержание нитрита натрия найдено равным, мкг/мл: 0,1985; 0,1993; 0,200]. Охарактеризуйте сходимосгь результатов анализа при доверительной вероятности Р= 0,95 с использованием фактора, вычисленного по Пирсону.
Буферные системы, рН
83. Вычислите концентрацию ионов Н+, ОН- и рН растворе, образовавшегося при смешивании 40 мл 0,05 м раствора азотистой кислоты НNО2 и 10 мл 2,0 М раствора нитрита калия.
84.Сколько миллилитров 1,00 моль/л раствора НС1 надо прибавить к 1 л буферного раствора c рН = 7,11, чтобы изменить рн на 0,5? Буферная ёмкость раствора равна 0,51 моль/л.
85.Как изменится рН 0,100 моль/л формиатного буферного раствора, если к 20 мл его прибавить 5 мл 0,01 моль/л раствора соляной кислоты?
86.Рассчитайте рН и буферную емкость карбонатного буферного раствора, для пригоювления 500 мл которого взяли 21,198 г Na2С03 и 25,203 г NаНС03.
87.Сколько граммов формиата калия НСООК следует взять, чтобы при растворении в 25 мл 0,03 М раствора муравьиной кислоты получить смесь с рН = 4,0?
88.Сколько моль уксусной кислоты следует добавить к 1 л 1 Н раствора ацетата натрия СН3СООNа‚ чтобы раствор стал нейтральным?
89.4,9 г безводного ацетата калия растворили в 250 мл 0,2 М раствора уксусной кислоты. Определите рН раствора.
90.Сколько граммов хлорида аммония МН4Сl нужно растворить в 20 мл 0,5 М раствора гидроксида аммония, чтобы получить концентрацию гидроксид-ионов 5-10'4 моль/л?
91.Сколько миллилитров 0,5 М раствора хлорида аммония NH4Сl следует прибавить к 100 мл 0,5 Н раствора гидроксида аммония, чтобы получить буферную систему с рН, равным 9,25?
92.Сколько миллилитров 1,00 моль/л раствора NаОН надо прибавить к 1 л буферного раствора с рН = 10,12, чтобы его рн изменился не более чем на 0,2?
93.Сколько граммов твердого гидроксида натрия необходимо добавить к 100 мл 0,1 М раствОра NH4С1, чтобы полученный раствор имел рН = 9,75. Чему равна буферная емкость этого раствора?
94.Как изменится рН буферного раствора, содержащего 0,1 М нитрата аммония и 0,01 м гилроксида аммония, если его разбавить в 4 раза?
95.Рассчитайте буферную емкость и интервал изменения рН буферного раствора, содержащего 0,0500 М СН3СООН и 0,0500 М СНЗСООNа, если к 200,0 мл его добавили: а) 2,5 ммоль НС1; 6) 10,00 ммоль НС 1.
96.Определите рН и рОН раствора, если к 1 л воды прибавить 11,5 г муравьиной кислоты и 10,5 г формиата калия.
97.Определите рН раствора, полученного при смешивании 50 мл 0,1 М раствора КН2Р04 и 25 мл 0,2 М раствора КЗНРО4.
98.Рассчитайте концентрацию ионов водорода и рН раствора, который получили при сливании 15 мл 0,1 М раствора Nа2С03 и 8 мл О,1 М раствора NаНСОз.
99.Определите рН буферного раствора, содержащего 1,1 М NH4ОН и 1,1 М NН4Сl. Как изменится величина рН раствора, если к нему добавить 0,1 М раствор НСl;0‚1 М NаОН?
100.Рассчитайте состав и буферную емкость аммиачного буферного раствора, способного обеспечить постоянство рН 9,25+-0,05 при добавлении к 500,0 мл его 0,025 моль NаОН или НСl?
Гидролиз
101. В 0,5 л раствора содержится 4,1 г СНЗСООNа. Вычислите рН раствора и степень гидролиза соли.

102.В 200 мл раствора содержится 0,65 г КСN. Определите степень гидролиза h соли и рН данного раствора.
103.Определите степень гидролиза хлорида цинка по первой ступени и рН 0,01 М раствора соли.
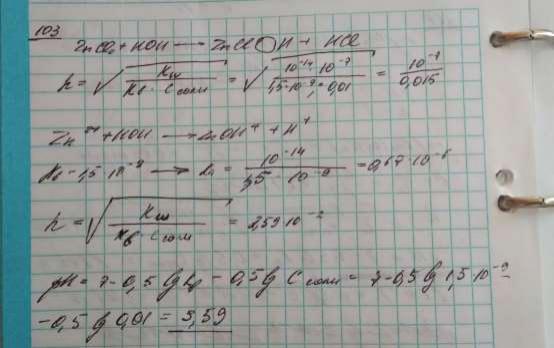
104.В 500 мл раствора содержится 1,07 г хлорида аммония. Определите степень гидролиза Ь соли и рН данного раствора.
105.Сколько граммов ацетата калия СНЗСООК следует растворить в 250 мл воды, чтобы получить раствор с рН, равным 8,5?
106.Сколько граммов нитрата аммония растворено в 1 л воды, если в результате гидролиза рН раствора оказался равен 5,6?
107.Рассчитайте константу гидролиза, степень гидролиза и рН 0,5 М раствора НСООNH4. Чему равен рН раствора, если его разбавить водой в 5 раз?
108.Рассчитайте константу гидролиза, степень гидролиза соли по первой ступени и рН 0,02 М раствора сульфида аммония (NH4)2S.
109.К 250 мл 0,4 М раствора НСN прибавили 250 мл 0,4 М раствора NаОН. Вычислите рН раствора и степень гидролиза соли.
110.При какой концентрации (моль/л) NH4NОЗ раствор имеет рН = 5,6?
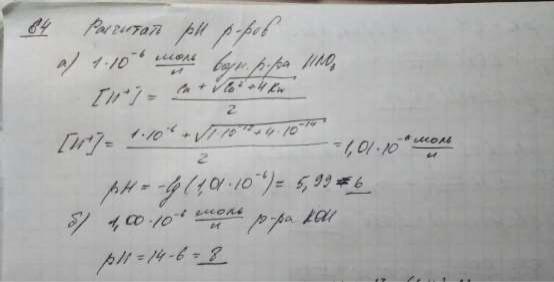
111.Рассчитайте константу гидролиза, степень гидролиза и рН 0,5 М раствора гидросульфита натрия NаНCОз.
112.Вычислите константу и степень тидролиэа соли фосфата калия К3Р04 по третьей ступени и рН для 0,12 М раствора этой соли.
113.К 10 мл 3 М раствора нитрита калия прибавили 50 мл воды. ВыЧИслите рН раствора и степень гидролиза соли.
114.Определите константу и степень гидролиза соли и рН в 0,05 М растворе сульфита калия 1980; при гидролизе (по первой ступени).
115.К 100 мл 0,2 М раствора НСООН прибавили 100 мл 0,2 М растВОра КОН. Вычислите рН раствора и степень гидролиза соли.
Кислотно-основные системы (рН)
64. Рассчитайте рН растворов:
а) 1-10'6 моль/л водного раствора азотной кислоты;
б) 1,00'10'6 моль/л раствора гидроксида калия.
65. Рассчитайте рН 0,1 М водного раствора тиомочевины.
