
- •1 Вопрос : предмет и задачи аналитической химии:
- •2 Вопрос : Классификация методов анализа:
- •3 Вопрос: Типы аналитических реакций и реагентов :
- •4 Вопрос : Чувствительность аналитических реакций :
- •5 Вопрос : Чистота вещества , ошибки анализа:
- •6 Вопрос : подготовка образца- аналитический сигнал :
- •7 Вопрос : Качественный анализ.Дробный анализ и систематический анализ:
- •8 Вопрос : Классификация катионов по группам :
- •9 Вопрос : Аналитическая классификация анионов по группам:
- •10 Вопрос: Органические вещества в аналитической химии . Идентификация органических веществ :
- •11 Вопрос: Здм в аналитической химии . Основные положения теории сильных электролитов :
- •12 Вопрос : Количественные характеристики процесса диссоциации:
- •14 Вопрос : Скорость реакций и химическое равновесие:
- •15 Вопрос : Термодинамическая и концентрационная констаты:
- •16 Вопрос : Гетерогенные процессы. Растворимость. Условия образования и растворения осадка . Осаждение и растворение осадков :
- •17 Вопрос: Влияние факторов на полноту осаждения и растворения осадка:
- •18 Вопрос: Влияние посторонних электролитов на растворимость малорастворимых электролитов:
- •19 Вопрос: Кислотно-основное равновесие . Водородный показатель.Теория кислот и оснований:
- •20 Вопрос: Ионное произведение воды.Константа кислотности и рН растворов слабых кислот. Константа основности и рН растворов слабых оснований:
- •21 Вопрос: Гидролиз. Количественные характеристики гидролиза .Совместный гидролиз:
- •22 Вопрос: Понятие о буферных системах .Буферная емкость:
- •23 Вопрос: Окислительно-восстановительное равновесие.Окислительно-восстановительные потенциалы редокс-пар:
- •24 Вопрос: Направление протекания овр .Влияние факторов на значение ов потенциалов.Глубина протекания овр :
- •25 Вопрос: Комплексообразование. Типы комплексов.Типы лигандов.Координационное число:
- •26 Вопрос: Равновесия в растворах комплекснх соединений.Влияние факторов на процесс комплексообразования:
- •27 Вопрос: Константы устойчивости и нестойкости комплексов:
- •28 Вопрос: Номенклатура кс:
- •29 Вопрос:Маскирование , разделение , концентрирование.Методы разделения и концентрирования :
- •31 Вопрос : Экстракция: Требования к органическим растворителям .Экстракционное равновесие:
- •32 Вопрос: Влияние факторов на процессы экстракции .Классификация..
- •33 Вопрос: Количественный анализ .Классификация методов анализа.Требования к реакциям.
- •34 Вопрос: Ошибки количественного анализа .Классификация ошибок источники систематических ошибок .Способы выявления ошибок.
- •35 Вопрос:Статистическая обработка результатов количественного анализа
- •36 Вопрос: Гравиметрический анализ .Классификация методов анализа:
- •37 Вопрос: метод осаждения .Расчет количества (обьема и массы) осадителя:
- •38 Вопрос: Требования к осадителю. Требования к осаждаемой форме .Требования к гравиметрической форме:
- •39 Вопрос : Получение осаждаемой формы.Условия получения кристаллических и аморфных осадков. Фильтрование .Аромывание осадка .Получение гравиметрической формы.
- •40 Вопрос: Титриметрический анализ .Требования к стандарту.Классификация методов.
- •41 Вопрос: Требования к реакциям .Виды титрования в титриметрическом анализе:
- •42 Вопрос: Установление ктт.Метод отдельных навесок.Метод пипетирования.
- •43 Вопрос: Кислотно-основное титрование:
- •44 Вопрос: Индикаторы кислотно-основного титрования.Теория кислотно-основных индикаторов .Классификация кислотно-основных индикаторов:
- •В тэ в растворе присутствует только соль. РН раствора определяется гидролизом Кt остатка слабого огня
- •46 Вопрос: Ошибки титрования .Влияние факторов на скачок титрования:
- •47 Вопрос: окислительно -восстановительное титрования.Классификация редокс -методов:
- •48 Вопрос: Условия проведения ов титрования .Виды титрованиея :
- •49 Вопрос:Индикаторы окислительно-восстановительного титрования.Классификация индикаторов ов титрования .Индикаторные ошибки:
- •50 Вопрос: Кривые окислительно-восстановительного титрования.Факторы влияющие на скачок кривой ов титрование :
- •51 Вопрос: Перманганатометрическое титрование.Условия проведения титрования .Применение: Перманганатометрия
- •Влияние среды:
- •Условия проведения титрования:
- •Применение:
- •52 Вопрос: Дихроматометрическое титрование.Применение: ихроматометрия
- •Недостатки:
- •Применение:
- •53 Вопрос: Йодиметрическое титрование .Способы фиксации ктт. Хлориодиметрическое титрование.Применение. Йодиметрия
- •54 Вопрос: Йодометрическое титрование .Йодаметрическое титрование .Применение: Иодометрия
- •55 Вопрос: Броматометрическое титрование.Бромаметрическое титрование .Применение:
- •56 Вопрос : Нитритометрическое титрование .Фиксация Ктт.Применение:Нитритометрическое титрование
- •57 Вопрос: Цериметрическое титрование .Применение:
- •58 Вопрос: Комплексиметрическое титрование .Классификация методов:
- •59 Вопрос : Комплексонометрия.Комплексоны.Применение комплексонометрия: Комплексонометрия
- •60 Вопрос: Индикаторы.Требования к металлохромным индикаторам:Индикаторы:
- •61 Вопрос: Виды комплексонометрического титрования .Кривые титрования .Влияние факторов на скачок титрования. Индикаторные ошибки комплексонометрического титрования.
- •37) Кривые титрования. Ошибки титрования. Применение комплексонометрии. Кривые титрования
- •Vтитранта
- •3.От рН. Меняя рН можно титровать одни катионы, при этом другие мешать не будут.
- •62 Вопрос: Осадительное титрование :способы титрования:
- •63 Вопрос: Кривые осадительного титрования : Влияние факторов на скачок титрование :
- •Факторы, влияющие на скачок:
- •64 Вопрос: Индикаторы метода.Условия применения адсорбционных индикаторов.Механизм адсорбционных индикаторов: Индикаторы метода:
- •Механизм действия адсорбционных индикаторов
- •Условия применения адсорбционных индикаторов:
- •Ряд адсорбционной способности анионов
- •65 Вопрос: Классификация методов осадительного титрования.Разновидность аргентометрии: Аргентометрия-метод, основанный на использовании в качестве осадителя AgNo3
- •66 Вопрос : Индикаторные ошибки осадительного титрования :
- •67 Вопрос : Кислотно-основное титрование в неводных средах.Растворители неводного титрования.:
- •68 Вопрос: Ниветирующее и дифференцирующее действие растворителей:
- •5)Растворители должны быть нетоксичными, дешевыми,доступными.
- •70 Вопрос : Инструментальные методы анализа. Классификация методов:
- •71 Вопрос : Оптические методы. Классификация. Закон светопоглощения.
- •72 Вопрос: Электронные спектры поглощения.
- •73 Вопрос :Абсорбционный анализ. Колометрия. Фотоколориметрия, Спектрофотометрия. Приемы спектрофотометрии.
- •74 Вопрос :Количественный фотометрический анализ. Нахождение концентрации вещества
- •75 Вопрос : Чувствительность и погрешности фотометрического анализа. Понятие о фотометрическом титровании.
- •76 Вопрос : Люминесцентный анализ. Классификация.
- •77 Вопрос : Флуоресцентный анализ. Характеристики люминесценции. Закон Стокса-Ломмеля. Правило зеркальной симметрии Левшина. Закон Вавилова.
- •78 Вопрос: Количественный флюоресцентный анализ. Условия проведения анализа.
- •79 Вопрос - Методы определения концентрации. Титрование с помощью флуоресцентных индикаторов. Применение флуоресцентного анализа.
- •80. Вопрос : Рефрактометрия. Методы нахождения концентрации. Применение.
- •81 Вопрос :Поляриметрия. Применение.
- •82 Вопрос : Инфракрасная спектроскопия. Использование ик-спектров. Природа ик-спектров поглощения.
- •83 Вопрос : Спектрофотометры. Подготовка образцов для снятия ик-спектров. Конечная идентификация. Применение.
- •84 Вопрос: Хроматография.Классификация.Применение
- •3. По технике выполнения
- •85 Вопрос: Бумажная хроматография. Методы определения кол-ва компонентов.
- •86 Вопрос : Тонкослойная хроматография. Сорбент. Требования к сорбентам.
- •87 Вопрос: Растворители тсх. Способы тсх. Расшифровка хроматограмм.
- •88. Ионообменная хромотография. Применение.
- •89. Катионный и анионный обмен. Иониты.
- •90. Методы ионообменной хромотографии. Ионообменное равновесие.
- •91. Газовая хроматография. Применение. Колонки.
- •92. Параметры удерживания. Параметры разделения. Обработка хроматограмм.
- •93. Электрохимические методы анализа. Классификация.
- •94. Потенциометрический анализ. Прямая потенциометрия.
- •95. Потенциометрическое титрование. Кривые титрования. Применение.
- •96. Кондуктометрический анализ. Прямая кондуктометрическия.
- •97. Кондуктометрическое титрование.
- •98. Полярографический анализ. Применение. Количественный полярографический анализ.
- •99. Амперометрическое титрование. Кривые титрования. Применение.
- •100. Кулонометрический анализ. Применение. Кулонометрическое титрование.

1 Вопрос : предмет и задачи аналитической химии:
Аналитическая химия — наука изучающая теоретические основы и методы химического анализа
Цель изучения: освоение современных методов анализа вещества и их применение для решения народнохозяйственных задач
Задачи:
1 установления химического состава неизвестного вещества
2 контроль качества сырья и готовой продукции
3 установлении технологических дефектов
4 установление характера преступления
5 выявление причин возникновения болезней
6 экологически мониторинг
Теоретическую основу аналитической химии составляет: периодический закон, закон действующих масс, закон сохранения масс, закон постоянства состава химическое равновесие, электролитические ассоциации, овр, комплексообразования
Значение аналитической химии:
1 разработка методов химического анализа
2. использования процессов на поверхности твердых тел в растворах газовой фазе и плазме
3 разработка теории пробоотбора и пробоподготовки
4 разработка математических методов для анализа
Предметом аналитической химии: является теория и практика химического анализа соверш. существующих и разработка новых быстрых и точных методов
2 Вопрос : Классификация методов анализа:
Метод анализа - это теоретически обоснованные способ определения состава вещества
Методика анализа — подробное описание всех действий которые обеспечивают правильность и воспроизводимость результатов анализа
Химический анализ — получение опытным путем данных о компонентах исследуемых образцах их количественного образца соотношений
В аналитической химии проводят:
1. элементный анализ определение элементов
2. функциональный анализ открытие и определение различных функциональных групп
3 молекулярный анализ определения молекулярного состава анализа вещества
4 фазовый анализ и открытия разных фаз входящих в анализируемой систему
Анализ может быть:
частичным то есть определять один или несколько веществ
полным определение всех веществ входящих в систему
С помощью химического анализа были открыты законы:
закон кратных отношений
определения атомных масс элементов
установление химической формулы химических соединений
Аналитическая химия способствует развитию геологии, геохимии, физики, химии, медицины, металлургии.
Классификация методов анализа
1. По объектам анализа неорганические и органические
2. По цели качественный
обнаружение отдельных элементов молекул и ионов входящих в состав анализируемого вещества
количественное определение количества содержания соответственно их частей анализируемого вещества
3. По способу выполнения
химический анализ данных получают на основе выпадение осадка выделение газа или изменение цвета
физические
Инструментальный физико химические
Требования к методам анализа
1. Правильность результатов близость полученных результатов к истинному значению
2. Воспроизводимость в получении одинаковых близких результатов при повторных проведение
3. Точность воспроизводимость определения от опыта к опыту
4. Экспрессность а быстрота и выполнение анализа
3 Вопрос: Типы аналитических реакций и реагентов :
Типы аналитических реакций аналитические реакции и реагенты подразделяют на:
1. Специфические или характерный позволяет обнаружить данное вещество или и он в присутствии других элементов
2. Селективные или избирательный позволяют обнаруживать несколько веществ или Ионов
3. Групповые позволяет обнаружить ионы определенный аналитической группы используют при систематическом анализе
4 Вопрос : Чувствительность аналитических реакций :
Чувствительность аналитических реакций мин. определенная концентрации вещества в растворе
Зависит:
от природы открываемого вещества и реагента
от температуры
от pH среды
от присутствия других веществ
Характеризуется:
1. Предельное разбавление максимальный объем раствора в котором может быть обнаружены 1Г вещества при помощи данной реакции
2. Предельные концентрации наименьшей концентрации при которой определяемое вещество можно обнаружить в растворе
3. Минимальный объем прядильного раствора наименьший объем раствора необходимые для обнаружения вещества с помощью данной реакции
4. Предел обнаружения или открываемый минимум не меньшей массы определяемого вещества открываемого данной реакции в минимальном объеме предельное разбавление
5. Показатель чувствительности
Реакции тем чувствительной Чем меньше ее предел обнаружения Чем меньше ее минимальный объем и чем больше предельное разбавление
5 Вопрос : Чистота вещества , ошибки анализа:
Ошибки анализа:
абсолютная ошибка разность между полученным значением и истинными результатами
относительная ошибка отношение абсолютной ошибки к истинному значению 100%
Чистота вещества для хим. в-в установленные квалификации
1. Чистый для лабораторных целей
2. Чистый для анализа
3. Химически чистый для исследовательских целей для приготовления стандартных растворов
Особо чистый В высоких технологиях
6 Вопрос : подготовка образца- аналитический сигнал :
Аналитический Сигнал это любое свойство вещества которые можно использовать для установления качества или количественного состава объектов
Классификация:
физические плавления кипения вращения поляризованного света
химические выпадение осадка выделение газа изменить цвет
Биологические
На основании зависимости между аналитическим сигналом и содержанием находящийся концентрации анализируемого компонента. При этом используют метод градуировочного графика метод стандартов или добавок.
При измерении аналитического сигнала нужно учитывать наличие аналитического сигнала фона которое обуславливает с применением а также шумами от измерительных приборов
Величина аналитического сигнала фона снижают при проведении холостого опытном когда через все стадии анализы проводят пробы не содержащие компонентом
Таким образом полезный a.с.=измеряемый а.с. - а.с. фона
Подготовка образца к анализу по июпак
Анализ по июпак это процедура получения опытным путем данных о химическом составе вещества
Перед началом анализа необходимо подготовить исследуемое вещество определить состав чистого вещества при этом подготовка вещества будет заключаться в его очистки от примесей
Стадии анализа
отбор пробы
подготовка пробы перевод и его раствор
проведение реакций
обработка результатов
Виды проб.
Проба это часть анализируемого материала отражающего его химический состав
- Генеральный или первичное отбирается на первом этапе исследования от анализируемого объекта
- лабораторная отбирается от первичной путем и о повторном деление дробления перемешивание
- аналитическая отбирается для непосредственного определения конкретного компонентом
- Арбитражный отбирается на первом этапе Наряду с генеральной но он хранится определённое время
При анализе гетерогенных смесей отбирают среднюю пробу небольшую часть вещества из которых берут аналитическую пробок меньше массы из неё отбирают аналитическую навеску и используют для единичного определения
Перед отбором пробы жидкости я не перемешивают и отбирают для анализа
Перед отбором пробы твердого вещества проводят визуальное исследование на цвет степень однородности формы и величины частиц
Однородные вещества измельчают растирают в порошок отбирают честь и проводят анализ
Отбор пробы не однородного твердого вещества включают в стадии измельчения, прогревание и деление на части
Для проведения анализа твердых пробы растворяют в подходящем растворителем после перевода пробы в растворе ее подвергают анализу.
7 Вопрос : Качественный анализ.Дробный анализ и систематический анализ:
Качественный анализ.
Заключается в установлении наличия определение компонента в исследуемом образце
Обнаружение это установление присутствии или отсутствии вещества в образце
Определение это установление количества или концентрации какого-либо компонента в образца
Качественный анализ аналитической реакции выполняется сухим или мокрым способом
Сухой способ это взаимоотношения сухих реактивов с образцом без добавления воды например получения сухих стекол о ресторане веществ окрашивание пламени
Мокрый способ аналитические реакции в пробирке
По технике выполнения различают реакции в пробирке капельный микрокристаллическая
При проведении реакции в пробирке в неё вносят несколько капель реагирующих веществ наблюдает за внешним эффектом при необходимости смесь перемешивают
Капельные реакции проводят на фильтровальной бумаги не наносит несколько капель раствора и реагент по каплям в результате наблюдается на бумаге видео красного пятна или концентрическая окружности
Микрокристаллические реакции проводят на предметном стекле о присутствии ионов судит по форме образования кристаллов
Требования к реакции в качественном анализе
1. Как ты должна протекать быстрый и до конца
2. Реакция должна сопровождаться заметным внешним эффектом
Классификация методов качественного анализа
1. Химический метод
+ По агрегатному состоянию
газовый
сухой или перохимический
мокрый
+По количеству вещества
макроанализ 1-10 г
полумикроанализ 0.01-0.5 г
Достоинства не требуется для анализа большого количества вещества экономия времени и реактивов проще микрометода которые требуют аппаратуру
микроанализ 10-³—10-6
ультрамикроанализ
субмикроанализ
2. Физические методы (спектральный, люминесцентные, рентгеноспектральный, а атомно-абсорбционный, радиометрический)
3. Физико-химические методы (электрохимические хроматографический фотоколориметрический)
4. Биологические методы
микробиологические определения витаминов и ферментов
и диффузионный определение антибиотиков
Систематический анализ.
Часто с реагентами взаимодействует несколько ионов добавляя разные продукты которые мешают идентифицировать каждую в отдельности.
Достоинства получения полной информации о составе образца
Недостатки длительности трудоемкости выполнения большие потери обнаруживаемых ионов из-за частого разбавления
При систематическом анализе широко используются групповые реагенты которые определяют из смеси отдельные группы катионов затем внутри каждой группы с помощью тех или иных реакции открывают индивидуальные ионы
Требования групповым реагентом
реагент должен отделить ионы почти полностью
полученный осадок должен легко переводиться в раствор
избыток группового реагента не должен мешать определение Ионов
8 Вопрос : Классификация катионов по группам :
Классификации катионов по группам
Задачи качественного анализа катионов и анионов является доказательством в присутствии или отсутствии того или иного Иона в исследуемом объекте.
I эта задача была бы решена если бы для каждого Иона имелось быть свои характерные реакции позволяющие открыть его в присутствии других ионов то есть использовать дробный метод анализа
Дробный метод анализа.
Был предложен академиком тананаева и основано определение ионов с помощью качественных реакций
В начале маскируют мешающие ионы а затем с помощью характерны реакции проводят определение искомого ионна.
Достоинства быстрота проведения около 10 минут простота выполнения и экономичность.
Недостатки трудно создать условия в которых реакция с данным ионным будет специфичным
Аналитическая классификация катионов.
В основе любой классификации катионов по группам положено растворимостью в воде и кислотах и щелочах окислительно-восстановительные свойства и способность к комплексообразованию.
С применением различных групповых реагентов сформировались различные классификации
Сероводородные или сульфидная созданным XIX веке все катионы делятся на 5 групп
аммиачно фосфатная основано на использовании в качестве групповых реагентов гидрофосфата аммония натрия все катионы делятся на 5 групп
кислотно-основное основано на использовании в качестве групповых реагентов в водных растворах кислот и щелочей все катионы делится на 6 групп достоинства не требует специфического оборудования затрат времени на полный анализ около 15ч
карбонатные классификация
софит на основное
устанавление присутствие тех или иных ионов в растворе облегчает обнаружение анионов.
9 Вопрос : Аналитическая классификация анионов по группам:
Аналитическая классификация анионов
Общепринятой классификации нет
1. Во внимание принимают растворимость солей бария и Серебра.
Все анионы делят на три группы
анион образующий малорастворимые в воде соли с барием
анион образующий малорастворимые соли с серебром
onions не образующий малорастворимых Солей
2. Во внимание принимается окислительно-восстановительные свойства
анионы окислители
анионы восстановители
onion не обладающий окислительно-восстановительными свойствами сульфаты фосфаты карбоната
Зависимость от присутствие тех или иных катионов и анионов схема анализа могут быть различными
10 Вопрос: Органические вещества в аналитической химии . Идентификация органических веществ :
Идентификация органических веществ проводится При установлении состава синтезируемых препаратов
элементарный анализ
функциональный
молекулярный
Трудности индефикация органических соединений огромное количество, разнообразной Строение и свойства, отсутствие характерных эффектов при их превращениях, малой реакционной способности многих функциональных групп
Для органических веществ специфичны реагенты встречающиеся крайне редко методы разделения характерны для неорганических веществ не подходит для органических веществ
Схема разделения по стасс-отто
Смесь веществ разделяет основываясь на различных летучести и растворимости
Легколетучие относятся вещества с точной кипением меньше 160 градусов к трудно летучим больше 160 градусам вещества разделяют по растворимости в воде и эфире Зачем применять групповые реагенты устанавливают присутствие различных классов соединений выбрать способ идентификации делают исходя из природы вещества а также методах его получения агрегатном состоянии.
Органические вещества в аналитической химии
Многие органические соединения с ионами металлов образует ярко окрашенный малорастворимые осадки действие многих из них основано на реакции комплексообразования
Алюминон с катионом алюминия образуется комплексное соединение красного цвета также образует комплексы с железом 3 и хлексы с железом 3 и хета также образует комплексы с железом 3 и хромом 3
ализарин обнаруживает алюминий с образованием алюминиевого лаком
Дифенилкарбазид дает реакции с солями ртути меди плюмбума и серебра
Дитизон был предложен в качестве реагента на катионы цинка с котором образуются комплекс малинового цвета раствор мый в хлороформе для определения ртути и кадмия меди и серебра Кобальта и никеля
диметилглиоксим или раствор Чугаева в аналитической среди Никель плюс два дает розовый красный осадок внутри комплекса также реагирует палладий комплекс и ферум2
Альфа метроза бета нафтол или раствор ильинского для определения Кобальта 2 образуется красный осадок нерастворимый в аш хлор и азотной кислоте всё о помощи определяет Никель и железо 3
8 оксихинолин катионы магния в аммиачной среде отдает зеленовато желтый осадок осаждает калий 2 цинк 2-2 Никель алюминий и железо 3, висмунт
дифениламин в кислой среде с нитратами и нитритами образует синюю краску
Для предотвращения суждения нежелательных Иванов применять маскирующий комплексообразователи лимонной кислоты лимонной кислотой
11 Вопрос: Здм в аналитической химии . Основные положения теории сильных электролитов :
Закон действующих масс в аналитической химии
Основные положения теории электролитов
Электролит вещества которые в растворе или расплавленном состоянии проводит электрический ток
Раствор электролитов обладает более низким значением температуры замерзания и более высоким температуре кипения по сравнению с чистым растворителем и растворами неэлектролитов
12 Вопрос : Количественные характеристики процесса диссоциации:
Диссоциация это процесс распада молекул на ионы под действием молекул растворителя
Теория диссоциации
1. Вещества растворы которых являются электролитами при растворении распадаются на отрицательные положительные ионы
2. Под действием тока у меня положительный Ион движется к катоду отрицательной К анаду
Механизм диссоциации
1. Ориентация молекул растворителя вокруг частиц растворенного вещества
2. Поляризация частиц растворенного вещества под действием молекул растворителя
3. Разрыв связи между частицами растворенного вещества с образованием сольватированных ионов
Количественные характеристики процессов диссоциации
Степень диссоциации Альфа показывает отношение числа молекул на ионы к общему числу молекул растворенного вещества зависит от природы растворителя и вещества от концентрации температуры
константа диссоциации отношения произведение концентрации ионов в растворе концентрация диссоциированных молекул зависит от природы растворителя от температуры
Для сильных электролитов не существует диссоциированных молекул
13 вопрос : Ионная сила. Коэффициент активности . Активность . Действие одноименного иона:
Действие одноименного Иона.
Если К раствору уксусной кислоты добавить йод соль то это приведет к нарушению равновесия при этом концентрация водорода понижается и кислота в присутствии своей соли ведет себя как еще более слабая кислота таким образом введении в раствор слабого электролита кого-нибудь сильного электролита с одноименным ионом будет понижать степень диссоциации этого слабого электролита.
Сильные электролиты.
Диссоциируют на ионы полностью Следовательно число ионов в них больше чем в растворах слабых электролитов в той той же концентрации каждый он окружён оболочкой из ионов в другом заряды уменьшающий подвижность Ионов.
В следствие этого ионы в растворе ведут себя так будто их концентрации меньше действительной. Значение степени диссоциации для сильных электролитов всегда оказывается заниженной и и называется кажущуеся степень диссоциации
Активность. Коэффициент активности
Для оценки состояния Иона в растворе используют величину называющийся активностью
Активностью они это и эффективной его концентрации соответственно которой и он действует химических реакциях
Активность веществ в стандарте состоит для чистых веществ применим равен 1.
Коэффициент активности характеризует степень отклонения свойства реальных растворов от идеальных.
Зависит от природы ионное величины Его заряда от природы растворителя от ионной силы
Ионная сила характеризует меру электростатического взаимодействия ионов которые присутствуют в растворе.
Ионная сила равна полусумме произведение молярных концентраций ионов на квадрат из заряда.
Законы ионной силы. Коэффициент активности одной и той же во всех разбавленных кислотах имеющих одинаковые ионную силу. Расчёт их применять использовать следующую коэффициент активности Ионов
Соотношение между коэффициентом активности ионная сила описывает уравнение дебая-хюккеля.
14 Вопрос : Скорость реакций и химическое равновесие:
Скорость химических реакций. Химическое равновесие.
Закон действующих масс зависит скорость химических реакции прямо пропорциональна произведению концентраций реагирующих веществ взятых в степенях равных стехиометрических коэффициентов уравнением.
Наиболее часто используют реакции первого и второго порядка с зависимость скорости химической реакции от температуры определяется правилом вант-гоффа при повышенной температуре на каждые 10 градусов скорость реакции увеличивается в 2-4 раза.
Зависимость скорости реакции и константы от температуры выражается уравнением аррениуса. Чем больше энергия активации тем меньше число активных молекул идти медленнее протекает реакция энергия активации равна нулю реакция протекает в мгновенном.
Химическое равновесие -состояние системы реагирующих веществ при которой скорости прямой и обратной реакции равны между собой
15 Вопрос : Термодинамическая и концентрационная констаты:
Термодинамическая Константа табличные константа равновесия которые используют для вычисления pH растворимости осадка при условиях отсутствия электрических и конкурирующих реакций
Концентрационная Константа. Если вещества не вступают в конкурирующей реакции концентрирующий константу выражают через равновесную концентрацию и называют реальный константой.
Если посторонний и он уступает в конкурирующей реакции с образованием модифицированных малорастворимых соединений то состояние равновесия характеризуется условной константы которые выражают через общей концентрации.
Равновесные концентрации любой формы в зависимости от условия составляет ту или иную частью общей концентрации.
Необходимо помнить что в растворе устанавливается равновесие между всеми и химически активными формуле вещества с ума концентрации всех равновесных формы равна общей концентрации это вещества уравнение материального баланса.
16 Вопрос : Гетерогенные процессы. Растворимость. Условия образования и растворения осадка . Осаждение и растворение осадков :
ЗДМ и гетерогенные процессы.
Соли трудно растворимого в воде являются электролитами. Между насыщенным раствором и осадком устанавливается равновесие то есть в единицу времени в растворе происходит столько ионов сколько их вновь возвращается в осадок.
Концентрация осадков можно считать величиной постоянной.
Константа равновесия осадок раствор называется произведением растворимости и выражается через активность зависимо от температуры и природы растворителя.
Константа равновесия садик раствора выражается через равновесные концентрации называется реальными произведением растворимости также зависит от температуры природы растворителя и ионной силы
Если он осадка в растворе вступает в конкурирующей реакции комплексообразования то равновесие осадок раствор характеризуется условным произведение растворимости и выражается через общее произведение концентраций.
Правило произведения растворимости использовать для разделения веществ по величине Пр определяют растворимости вещества.
Растворимость веществ.
Это способность вещества растворяться в воде или другом растворителем
Ты в центр истории - это масса вещества в которой можно рассчитать в 100 г растворителя при данной температуре.
Если он и сил равна нулю инет конкурирующих реакций растворимость осадка рассчитывают по величине РС.
Если влияние ионной силы нельзя пренебречь то есть присутствует посторонний электролит а она отсутствует конкурирующей реакции это растворимость А вычисляют по величине ks если конкурирующими растворителями пренебречь нельзя растворимость вычисляет по ks.
Растворимость осадка складывается из концентрации всех форм в которых Это вещество находится в растворе нейтральные молекулы сольватированные ионы и продукты конкурирующих реакций
При увеличении концентрации одноименного Иона на растворимость осадка уменьшается.
При Очень большом избытке одноименного Иона на растворимость может повышаться в следствии целевого эффекты и из-за взаимодействие с образованием растворимых комплексов зная молекулярную растворимость вещества можно идти его растворимость в грамм на литр.
Осаждения и растворения осадков.
Сравнивать значения P и растворимости можно объяснить явление избирательного растворения того или иного малорастворимого сильного электролита находящихся в смеси с осадками других малорастворимых электролитов.
Чем больше различие между значениями пр
Одноимённых малорастворимых электролитов чем лучше можно провести селективное осаждение или растворении
Твердый сульфат и переходит в ка карбоном в карбонаты процесс повторяется несколько раз каждый раз сливай раствор образование карбоната растворяются в уксусной кислоте при этом кальция 2 и стронций 2 переходит в раствор из которого их открывают с помощью различных реакций.
17 Вопрос: Влияние факторов на полноту осаждения и растворения осадка:
Влияние факторов на полноту осаждения и растворения осадков.
природа создай ему вещества растворителей осаждение
температура
концентрация реагентов
присутствие посторонних веществ
характера осадка кристаллические или аморфные
условия осаждения быстрое или медленное образование осадка
применении побочных реакций
время выпадения осадка
Остаточное содержание осуждаем вещества не должно быть больше 10 в минус 6 моль на литр
18 Вопрос: Влияние посторонних электролитов на растворимость малорастворимых электролитов:
Влияние посторонних электролитов на растворимость малорастворимых электролитов.
Введение в раствор электролита содержащего одноимённой с осадком он и не образующего с ним растворимые комплексы о соединении понижают растворимость малорастворимого электролита увеличивается полнота осаждения.
Если Вадима и одноименный с осадком One образуют растворимые комплексное соединение нити при Очень большом избытке села Ивановка будет наблюдаться растворение осадка.
Введение в системы постороннего электролита приводит к изменению растворимости малорастворимого электролита так как изменение коэффициента активности ионов солевой эффект.
А при небольших значениях ионы села введенье посторонних электролитов обычно повышает растворимость осадков а при больших значениях ионной силы возможно уменьшение осадков.
19 Вопрос: Кислотно-основное равновесие . Водородный показатель.Теория кислот и оснований:
1. 1 консультация кислот и оснований а а теория аррениуса в основе которой электростатическое диссоциация.
Согласно этой теории кислоты это вещества образующие при диссоциации В водном растворе H+, основания образуют гидроксид ионы
2. Протолитическая теория бренстеда. Кислоты это молекулы или ионы способны отдавать протоны.
Основание - это молекулы или ионы способны присоединять протон.
Теория Льюиса согласно которой кислота это соединение способно присоединять электронную пару с образованием связи, а основание - это соединение способное предоставлять электронную пару.
20 Вопрос: Ионное произведение воды.Константа кислотности и рН растворов слабых кислот. Константа основности и рН растворов слабых оснований:
Ионные произведения воды.
H2O это слабый аморфные электролит может быть и кислотой и основанием.
К(равн.)=[H+][OH-]/[HOH]=1,8*10(-16)
От константы равновесия Можно перейти к ионному произведение
К(в.)=[H+][OH-]
c(мол.)=1000/1*18=55,55 моль/л
Ионное вроизведение К(в.)=1,8*10(-16)*55,55=1*10(-14)
Для любого разбавленного раствора произведение концентрации водорода на гидроксид-ионы есть величина постоянная.
Для нейтральных растворов равно 10 (-7)
Для кислых растворов больше 10 (-7)
Для щелочных растворов конц. меньше 10(-7).
Для оценки кислоты кислые и щелочные среды используется величина PH.
Константы кислотности pH растворов слабых кислот.
Сила кислоты или основания в любым растворителем можно охарактеризовать
константы кислотности или константы основности.
Для многих слабых кислот числовые значения константы очень мало И поэтому вместо
величины кислотности принимают числовой показатель pK(a.)
Чем больше константы кислотности и тем сильнее кислота.
Для много основных кислот произведение всех констан ступенчатой диссоциации
равно полный константе диссоциации этой кислоты.
Константа основности.
pH растворов слабых основаниях в соответствии кислот и оснований бренстеда
B+HOH → HB+ + OH-
Константа основности
К(в.)=[HB+][OH-]/[B] для слабых оснований
Между константой кислотности константы основности одной и той же кислоты новые
пары в одном и том же растворители существует зависимость
К(sh)=К(а.)*К(в.)
pH+pOH=14
21 Вопрос: Гидролиз. Количественные характеристики гидролиза .Совместный гидролиз:
ЗДМ и процессы гидролиза.
Гидролизу может подвергаться жиры белки углеводы соли.
Гидролиз соли - это обмен взаимодействующих ионов соли с водой приводит к
образование слабого электролита изменению PH.
Случаи гидролиза:
1 Соли образующейся сильным основанием и сильной кислотой гидролизу не
подвергаются ph≈7
2 Соли образованные слабым основанием и сильной кислотой гидролизу
подвергается pH меньше 7
3 Соль образованная сильным основанием и слабой кислотой гидродизируются ph
больше 7
4 Соли образованные слабым основанием и слабой кислотой гидролизуются
Реакция среды зависит от степени диссоциации продуктов гидролиза
Если кислота сильнее среда кислая
Соли образованной катионом сильно подвержены гидролизу бериллий или олово
удаётся р-ть только при добавлении кислоты, Так как при реакции в воде этих солей
образуются основные соли, выпадающие в осадок.
Бинарные соединения не могут существовать В водном растворе так как подвергается
полному необратимому гидролизу.
Необходимо избегать контакта с бинарных соединений с воздухом.
Количественные характеристики гидролиза.
Количественные характеристики гидролиза.
Степень гидролиза это отношение числа молекул подвергшегося гидролизу к общему
числу молекул зависит от:
1 Температура. при повышении степень гидролиза увеличивается
2 Концентрация соли и продуктов гидролиза
3 Постронние вещества: только в том случае если Эти вещества реагируют соли или
продуктом гидролиза
4 Степени разбавления
С увеличением разбавления степень гидролиза увеличивается
Чем больше Константа гидролиза тем в большей степени он протекает. Константа и
степень гидролиза связаны между собой.
Чтобы подавить гидролиз нужно растворять соль на ходу и разбавлять ее
соответствующий кислотой для смещения равновесия.
Совместный гидролиз.
При совместном гидролиза степень его протекание значительно выше что может
привести к полному гидролизу.
Для полного протекания гидролиза нужно чтобы соль была образована очень слабой
кислотой (например H2СО4) и очень сильным основанием (карбиды ацетилениды
фосфиды)
Полностью гидролизующихся соли — сульфиды и карбонаты нельзя получить реакцию
обмена в водном растворе.
Вместо отдельных продуктов будет получаться продукты гидролиза.
22 Вопрос: Понятие о буферных системах .Буферная емкость:
Понятие о буферных системах.
Значительную роль в поддержании гомеостаза биосистем играют буферные растворы
(БР)
БР — это растворы pH который меняется незначительно при разбавлении или при
добавлении небольшого количества кислоты или щелочи
Ацетатная буферная смесь
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa + HCl → CH3COOH + NaCl
Буферные растворы с нужным значением pH можно получить смешиванием
рассчитанного количество соответствующих веществ или их готовят из фиксаналов.
Пр. Играют большую роль в жизни орг., при определении Ba(2) используют ацетатный
буфер при определение никеля с диметилглиоксимом или аммиачная буферная смесь.
Буферная смесь.
Любое буферная смесь сохраняет постоянство pH при добавлении определенного
количества вещества кислоты или щёлочи то есть обладает буферной емкостью.
Буферная емкость это число моль эквивалентов серной кислоты или сильного
основания которой нужно добавить чтобы изменить величину pH буферного раствора
на единицу.
Чем больше концентрация компонентов буферного раствора тем больше буферной
емкости с разбавлением буферной емкостью уменьшается.
Чтобы действия буферного раствора было эффективно концентрации одного
компонента не должна превышать концентрацию другого более чем в 10 раз.
23 Вопрос: Окислительно-восстановительное равновесие.Окислительно-восстановительные потенциалы редокс-пар:
С помощью окислительно восстановительных реакций в качественном анализе
открывают катионы анионы нейтральные молекулы. Один из разделов
количественного анализа полностью основан на овр.
Овр является сочетанием двух полуреакций которые должны быть записаны в форме
восстановителя.
Вещества которые в зависимости от природы реагенты и условия протекания овр в
одних случаях являются окислителями в других восстановительным называют редокс
амфотерный H2O2.
Совокупность окислительных и восстановительных форм называют редокс парой.
В любое VR участвовать не менее двух редокс пар и для характеристики окислительно
восстановительные способности редокс пары используют величину окислительно-
восстановительного потенциала.
Электронный потенциал связан со стандартным потенциалом актив. окисл. и
восстановительной формой (уравнение Нернста)
Е° — стандартный электродный потенциал это потенциал когда все участники ВВР
находятся в стандартном состоянии то есть их активность =1.
При подстановке всех значений в это уравнение замена натур. погар. На десятичный
t=23.
Уравнение нернста описывает реальный потенциал.
Реальная или условная относительный окислительно-восстановительный потенциал
это потенциал редокс пары когда все участники ОВР находится в реальных условиях.
Чем больше значение электронного потенциала тем сильнее выражены
окислительные свойства Чем меньше значение стандартного электродного потенциала
тем сильнее выражены восстановительные свойства.
Окислительно-восстановительный потенциал редокс пары.
Редокс пара этой системы из окислительно-восстановительными форма вещества где
окислитель является акцептором электронов, а восстановителем является донором
электронов.
Потенциал редокс пары определяется с помощью окислительно-восстановительным в
электронном.
Окислительно-восстановительные Электрон это электрод состоящий из инертного
материала погруженного в водный раствор в котором присутствует окислительные и
восстановительные форма данного вещества.
Применяют два вида окислительно-восстановительных электронов
1 Электродный потенциал которых не зависит от активности ионов водорода
2 Электродный потенциал которого зависит от активности ионов водорода
ОВ потенциал отсчитывают от потенциал стандартного водородного электрода
потенциал которого принимают равным нулю.
Потенциалы отсчитываемый от потенциала стандартного водородного электрода
называют условными относительными потенциал по водородной шкале
Стандартный водородный электрод состоит из платиновой пластины покрытый
платиновой Черни погружены в раствор h2s so4 где концентрация ионов водорода и 1
моль на литр давлении 1 АТМ и температуре 25 градусов.
Стандартный водородный электрод не является ОВЭ он относится к к первому ряду
потенциал которого зависит от активности соответствующих компонентов ионов
водорода.
А вы потенциала редокс пары и от электродвижущая силаи от электродвижущая
силатенциала редокс пары и от электродвижущая силаи от электродвижущая сила
полифонический цепи составленной из данного ОВЭ и стандартного водорода.
В схеме гальванического элемента стандартных водородных электродов занимают
слева а овэ с правa
Pt , H2 / H+ // Pt / Fe+3 , Fe +2
24 Вопрос: Направление протекания овр .Влияние факторов на значение ов потенциалов.Глубина протекания овр :
Факторы влияющие на величину о.в. потенциала
1) концентрации реагентов уравнение нернста позволяет рассчитать Как влияет
изменение концентрации на окислительно-восстановительный потенциал.
2) pH среды влияет на потенциал и ее направление протекания овр тогда когда в
реакции участвуют ионы водорода изменением pH среды можно повлиять на
протекание овр.
3) температура тем больше температура тем выше величина на потенциале
4) давление
5) посторонние ионы изменяет ионную силу раствора изменяет активность ионов а
следовательно изменяют потенциал
6) образование малорастворимых соединений окислительные или восстановительные
формы
7) комплексообразование окислительно-восстановительные формы
Есть ли в комплекс связывается окислительные Format окислительные способности
редокс пары изменяется А если связывается восстановительные форма окислительная
способность вычислительные способности возрастает
Направление протекания овр
Учет знака потенциала овр позволяет определить направление протекания реакции в
заданных условиях
Глубина протекания овр.:Степень превращения исходного вещества продуктов реакции определение значением
К равновесия.
Для VR константа равновесия связан с потенциалом редокс пары
Глубина протекания O V R определяется разностью стандартного окислительно-
восстановительного потенциала редокс пары и учитывается в реакциях
Чем больше стандартный потенциал реакции тем больше константа равновесия тем
глубже протекает реакция
25 Вопрос: Комплексообразование. Типы комплексов.Типы лигандов.Координационное число:
Комплексные соединения распространены в природе.
Хлорофилл соединяет магний гемоглобин, инсулин (Zn), витамин B12 (Со).
Многие комплексные соединения являются катализаторами
Свойства комплексных систем малорастворимых имеет окраску Летучий устойчивым
используют для получения информации о качественных и количественных состояниях
пробы.
Признаки по которым комплексные соединения объединяют в особый классы
1 Сложность состава
2 Диссоциация в растворе
3 Способности сост. частей К самостоятельным существованием
4 Наличие определённой расположения легандов вокруг к.о.
Основные положения теории вернера
1 Молекула комплексного соединения состоит из комплексообразователя
Центральный ион вокруг которого координирует ионы с противоположным зарядом
или полярные молекулы лиганды или аденды.
2 Лиганды непосредственно связаны с центральным атомом, обо внутри сферу, а не
связан — внешн. стр-ра К.С. эксп. по устанавл. спектрально и рентгеностр. анал-ми.
В зависимости от природы центрального атома легенды внешней сферы Различают
следующие конфигурацией линейн., треугольн., квадрат., Тетраидич.
Типы комплексов 1) ком.с. может быть
-катион. типа
-анион. типа
-неэлектролитами
2) по характеру связи между составными частями комплексы выделяют
1 Внутри сферный когда Центральный атом непосредственно связан с лигандами
-однороднолегандные
-смешаннолегандные
2 Внешность верный комплексы могут присоединить дополнительные он и не
связанные непосредственно с центральным атомом. Такие легенды удерживаются за
счет электрической статических сил
3) в зависимости от числа центральных атомов
-многоядерные
-полиядерные
Типы лигандов.
Атомы лигандов, поср-м кот. осущ. св. С компл. обр-м, назыв. донорными. (Кислород
азот сера фосфор)
Легенды о предоставляют собственные анионы (полярные молекулы)
Дентатность лигандов это число связей образуемых одним лигандом с одним
металлом к о
Зависит от числа и расположение функциональных групп и о от координационного
числа центра атома.
Образует только одну связь лиганды называются монодентатными, несколько
полидентатные.
К монодентатным относят OH-, Cr-, Br-, H2O.
Полидентатные лиганды не всегда реализуется связь частоты и могут занимать меньше
числа место во внутренней сфере
Полидентатные лиганды так с кислотными группами могут образовывать внутренний
комплекс соединений
Особенности хелатов их повышенной уст-ть по сравнению с нециклич. свойствами
Натбольшей устойчивости комплексы образ. тогда когда в состоянии цикл входит 5 или
больше.
Координационное число —
Это число координационных свойств образуемых атомов металлов к. о. с лигандами
Наибольше распространена К.Ч. проявляется 2,4,6 реже 3,7,8,9.
Координационное число определяет конфигурацию комплекса
2— линейная
3— равносторонний треугольник
4— квадрат
6— шестиугольник
Различают:
1) характерист. К.Ч. число свойства образующих с лигандами определенного типа
зависит от пр. лиганда кч
2)Макс. К.Ч. максимально возможное для данного центрального атома число связей не
зависящих от природы Легенда определяющие электронным строением
26 Вопрос: Равновесия в растворах комплекснх соединений.Влияние факторов на процесс комплексообразования:
Факторы влияющие на к.о.
1 pH влияет в том случае когда в реакции участвуют ионы водорода
2 концентрация причем концентрация лигандов больше тем лучше металл
связываются в комплексе
3 температура влияет на константу уст-ти и нестойкости комплексов
4 посторонний ионы могут привести к разрушению комплекса
Равновесие в растворах комплексных соединений
Ме 4 — металлич. легандов
Ме +4 = Ме4¹
Ме4¹ + 4= Ме4²
При константе равновесия назып. К образ. выраж. я/з активности, назыв К
термодинамич., А выр. ч/з концентрации — концентрационными.
Для расчета концентраций ионов металлов 4 и подобных равновесных форм к.с.
использует уравнение материального баланса
Лиганды внешнего сор. с окончанием "о", если их ч. больше единиц, кто отбавляй
числительные дети 33 А затем называют нейтральные лиганды H2O аква, Затем
называют металлы комплексообразователя, в последнюю очередь ионы внешней
сферы
Не меньше атом металла составляет из корня латинского названия с характерным
окончанием в зависимости от степени окисления окислителя
1 А 2 о 3 и 4 е 5 ап 6 оп 7 ип 8 ен
Комплекс анион
Сперва называют отрицательно Элегант соответствующим числительным затем
нейтральные молекулы ОАО которые металлы с комплексообразователем в
соответствии с окончанием добавляют суффикс АТ в конце внешней сферы.
В нейтральных комплексах к металлам комплексообразователи не добавляют Ни каких
окончаний
Функция образование среднее число лигандов проходящих на один центр Ион
металла.
Степень образования комплекса
Если известны К установлены К.С., а также равновесной концентрации лиганда, то
можно рассчитать степень образования КС молярная доля.
27 Вопрос: Константы устойчивости и нестойкости комплексов:
К.С. катион и анион типа наиболее часто растворимы в воде, компл. неэлектр-в в воде
мало растворимы.
Каждую ступень диссоциации внутренней сферы характеризуется своей константы
равновесий которая называется константы нестойкости.
Чем меньше Константа нестойкости тем устойчивее комплекс он
Чем больше Константа устойчивости тем комплекс прочнее и тем лучше металл связан
в этом комплексе
Термодинамические константы нестойкости Константа устойчивости зависит от
природы растворителя реагентов температуры и не зависит от концентрации
Концентрация константы устойчивости константы нестойкости зависит от
концентрации реагентов
Значение константы устойчивости позволяет рассчитать равновесную концентрацию
частиц а также провести оценку прочности комплексом
28 Вопрос: Номенклатура кс:
Номенклатура комплексных соединений
1 Традиционные по комплексу присваивают Ист.слож. название
Например Красная кровяная соль и желтая кровяная соль
2 Номенклатура Вагнера
-катион комплекс
3 ИЮПАК
В начале название катиона, потом называет отрицательные лиганды , Заием
нейтральные с соответствующим числами, затем Ме к.о. указывают его степень
окисления римскими цифрами.
Если комплекс является анионом то к названию центрального атома добавляют
суффикс ат.
29 Вопрос:Маскирование , разделение , концентрирование.Методы разделения и концентрирования :
Применяемый метод обнаружения в-в иногдане дает надежный результат без предварительного устранения влияния мешающих в-в. Маскирование — перевод меш. Комп-в в такую форму, которой не оказыв. Мешающее действие. Демоскирование — перевод замаскированного вещества в форму, способную вступать в свойственную ему реакцию.
Группы маскир.веществ: 1) вещества , образующие с мешающ. Веществами более устойчивые соединения, чем с определяемыми.
вещества , предотвращающие кислотно-основныи реакции с образованием малорастворимых гидроксидов.
3) вещества изменябщие степень окисления мешающего иона
вещества осаждающие мешающие ионы.
Маскирующие вещества : комплексоны(трилон-б), оксикислоты(винная, лимонная) , глицерин , тиомочевина , аммиак, цианид ионы .
Смеси веществ (KI в смеси с аммиаком )
Маскирование не удается при анализе многокомпонентных смесей.
Необходимость разделения и концентрация — 1) проба содержащая комплексы мешающие определению, 2) концентрация определяемого вещества ниже предела обнаружения метода ., 3) определение вещества неравном.распределении в пробе .
пробы токсичны.
Распределение -процесс в результате которого комплекты составляющие исходную смесь , определяются один от другого. Индивидуальное расделение: за олдин прием отделяется несколько компонентов. Концентрирование — процесс, в результате которого повыш.отношение количества микрокомл-в к количеству макрокомп-в.
Абсолютная концентрирование — перевод синкрокопм. Из большей массы или обьема образца в малую массу или обьем. При этом концентрация микроком. Повысится. Относит. Концентрирование -увеличивается отношением между кол-ми микроком-та и макрокомпонента .
Методы разделения и концентрирования — 1) метод испарения — упаривание или выпаривание
Озоление — метод при котором вещество путем термической обработки превращ. В золу.
3 ) метод кристаллизации
Экстракция
Сорбированные методы- основаны на различии способности разделяемых компонентов поглощается веществами носителями . Адсорбция — поглащение поверхностью . Абсорбция — поглощение в обьеме. Хемосорбция — поглощение при протекании реакции . В качестве сорбентов используют активированный уголь , селикаель, алюминий oh3, синтетические полимерные вещества.
6) Электрохимические методы : Электрофорез основан на различных скоростях движения заряженных частиц в электронном поле. Используется для разделения белков .
7) Хроматографич.методы — совокупность методов основанных на различие в сродстве разделенных комплексов которые перемещаются с подвижной фазы к неподвижной фазе( или вдоль)
30 вопрос Характеристики разделения и концентрирования . Соосаждения.:Большинство методов разделения основана на распределение вещества между двумя фазами 1)коэффициент концентрирования показывает во сколько раз изменится отношение абсолютного количества микро и макро компонентов Концентрате по сравнению с этим же отношениям новый сходный смеси 2)коэффициент распределения это отношение общей концентрации вещества в общих фазах три степени извлечение эффективность излечения вещества из одной фазы в другую для полного излечения R к 100 процентам 4)коэффициент разделения разделение вещества а и Б для которого установлено равновесие между двумя фазами Осаждения из осаждения в основе всех разделение метод осаждения лежит различия в растворимости определяемых других веществ в условиях успешного разделения определяется величина произведения растворимости для осаждения использует O и Hсоединение специфичность осаждения можно увеличить изменяя pH раствора одновременно со осаждения и осаждения растворимы микроб кто с выпадением осадков макро комплекс сам. Достоинства выделяют микро примеси из раствора второе полнота выделения того или иного вещества из раствора вместе с осадком недостаток а в результате осаждения происходит загрязнение осадка что плохо влияет на точность осадка осадка так макро комплекса называют кола лектором коллектора малорастворимые о или Н вещества которые должны полностью захватывать нужны или не захватывать мешающие металлов компоненты типа коллекторов первая неорганические второе органические

Причины соса жде не может быть выпадения в осадок смежных кристаллов то-есть кристаллов образующихся двумя или более веществами которые кристаллизуются в одной форме вещества способные к образованию смешанных кристаллов называют из аморфными различают изоморфные соса рождения и адсорбционная соса рождения при из аморфном соса рождения комплекс распределяется между жидкое и твёрдые фазы при адсорбционного соосаждении примесь находится на поверхности осадка . поверхностное соосаждение вещества адсорбционного на поверхности коллектора и удаление из раствора характерноДля аморфного осадка в первую очередь на поверхности осадка а сорбционные ионы входят в состав осадка имеет в растворе в избытке
31 Вопрос : Экстракция: Требования к органическим растворителям .Экстракционное равновесие:
Экстракция процесс распределения вещества между двумя не смешивающимися жидкими фазами Экстрагент- извлекает вещество из водной фазы. Экстракт - отделяет жидкую органическую фазу содержащие экстрагирования вещество из водной фазы. 1825-м году была описана Экстракция Бромма с помощью бензола в 1867-м году была описана Экстракция железо кобальта платина ещё из Тиоцианат ных комплексов в двадцатых веках в начале использовали дитизон для извлечения металлов. Полное распределение вещества методом экстракции не верно так как небольшая часть экстрадирована вещества всегда остается в исходной фазе достоинства доступность простота быстрое выполнения недорогое оборудования не происходит соосаждения . В лабораториях экстракцию проводит с помощью воронки в неё помещают водный раствор содержащий растворимая вещество которая подвергается экстракции он же с ней смешиваются с водой органическими растворителями. Требования к органическим растворителем способные извлекать экстрагируют щие вещество из водного раствора растворитель должен не гидролизовать сам не летучий должен отличаться по плотности от воды органические растворители это Gekson циклогексан Толуол спирт хлороформ ацетон . Экстра генная равновесия константы распределения зависит от температуры природы вещества и жидкой фазы чем больше константы распределения тем больше экстрагировать нова вещества излечиться из водного раствора в органическую фазу. Второе коэффициент распределения третья константа экстракции четвёртое степень извлечением пятое фактор распределения
32 Вопрос: Влияние факторов на процессы экстракции .Классификация..
Экстракция- это процесс распределения вещества между 2-мя не смешивающимися жидкими фазами.
Экстрагент-это органический растворитель, извлекающий вещество из водной фазы.
Экстракт-отдельная органическая фаза, содержащая извлеченное веществою 1825 г. -экстракция брома с помощью бензола.
1842г-экстракция урана. методы экстракции стали развиваться после 2 мировой войны.
Достоинсва: 1) Возможны работы с большим и малым объемом, быстрота операции, дешевое оборудование. 2) Возможно разделение веществ, которые сложно отделить друг от друга.
Экстракцию проводят с помощью делительной воронки, в котрую помещен раствор с веществом, которое нужно экстрагировать и органический растворитель.( несмешив.) При этом извлеченное вещество из водной фазы переходит в органическую. Требования: 1) Избирательное извлечение вещества из водной фазы 2) Малая растворимость в воде 3) Не летучесть 4) быть высококипящей 5)сильное отличие по плотности с водой 6) не токсичны 7) дешевыми, не огнеопасными При экстракции используют растворитель: хлороформ, амиловый спирт, изоамиловый спирт, эфиры, бензолы. Экстракционное равновесие 1) Закон распределния Нернста. Краспределения Аводн=Аорг
1)Кравнов=а(орг)а(водн)
Величина К, называется Краспределения, и обозначается Р. 2)Р=?(орг)∗[?]орг?(водн)∗[?]водн
1 и 2 уравнение-з. Нернста
Р зависит от: 1) от природы 2) от жидкой фазы 3) от температуры. Чем больше Р, тем лучше извлечение. Коэффициент распределения –это отношение концентрации вещетсва в органич.фазе к концентрации вещества в водной фазе.
D==С(орг)С(водн)
Зависит от: 1) температуры 2)концентрации 3)природы вещества 4) рН Степень извлечения(R)-отношение количества экстрагируемого вещества в органической фазе к количеству вещества в обеих фазах. R=?(орг)?(орг)+?(водн)*100%=С(орг)∗?(орг)С(орг)∗?(орг)+С(водн)*100%
R связано с D: R=?ンミᄋ+?(водн)?(орг)*100%
Чем больше R, тем лучше экстракция Константа экстракции( Кэктр) Фактор распределения-большее отношение к меньшему. SА/В Если фактор(SА/В=1), то разделение веществ А и В невозможно. Факторы, влияющие на экстракцию: 1) влияние объема на число экстракций(n). чем больше число экстракций, тем больше степень извлечения вещества. чем больше объем органической фазы, тем больше степень извлечения вещества. 2) рН влияет на степень извлечения веществ, если вещество участвует в кислотно-основных реакциях. дитизонаты металлов экстрагируют с хлороформом при разных рН. при рН=6-экстрагируют катионы меди, ртути, олова. при рН=3-только олова. 3)Маскирующие вещества( серебро, свинец, никель, кобальт) Классификация: 1) Молекулярные вещества с ковалентной связью( хлор, бром) 2)Внутрикомплексные соединения(дитизол, карбоновые кислоты) 3) Координационно-сольватированные комплексы( комплекс со смешанной внутренней сферой, которая включает лиганд, экстракционные реагент) 4) Минеральные кислоты ( соляная, серная, азотная)экстаргируемые растворители, обладающие основными свойствами.
металлы, кислоты и их соли. Экстрагируемые органические растворители. Ионы ассоцианты: соединения из больших катионов и больших анионов(тетрофенилфосфоний [PC6H5]4+)
33 Вопрос: Количественный анализ .Классификация методов анализа.Требования к реакциям.
Количественный анализ-совокупность химических, физико-химических и физических методов определения количественного соотношения компонентов, входящих в состав анализируемого вещества. -получение данных, в результате изменения окраски, выделения газа, осадка. Химические методы: 1) Гравиметрические методы Весовые-основаны на измерении массы определяемого вещества, отделяемого от остальных веществ в виде соединения с точно известным составом. Достоинства: 1)простота выполнения 2) Точноть 3)Выспроизводимость
Недостатки: 1) Очень продолжительный 2) Тетраметирические(объемные) методы. Основаны на измерении объема или массы реагента(тетр) затраченного на реакцию с определенным веществом. Достоинства: 1)простота 2) точность 3)воспроизводимость 4) быстрота. 1)Должны протекать быстро и при комнатной температуре 2) Вещества должны реагировать стехиометрически, без побочных реакций. Параллельное отпределение- это получение нескольких результатов для
одной пробы в одних условиях. Однократное определение всей последовательности операций предусматривается методикой. Правильность-это качество анализа Воспроизводимость-это близость результатов в единичных определениях Классификация ошибок:
1) Систематические-это разность между средним и истинным значением. d =х͞ -а, где а-действ.значение 2) Процентно-систематические х͞−аа*100% 3)Грубые Если не соблюдать методику. Их можно устранить путем повторного проведения анализа. 4)Случайные Причины установить невозможно. Источники ошибок: 1)Особенности методики 2)Вызваны несовершенством приборов 3) Индивидуальные(качества человека) Выявление ошибок: 1) Использование стандартных образцов 2) Метод добавок(метод удвоения) Исследуем образец по методике. Затем удваивают массу вещества, а затем снова находят содержание компонента в новой пробе и снова сравнивают. Проводят исследование вещества другими методами. Статистика. Статистическая обработка. При обработке результатов анализа используют выборку, которую описывают распределением Стьюдента. Выборка- это совокупность результатов измерения. Объем выборки- это число вариант(n) Варианта-это отдельное значение.
1) Среднее значение: х͞=х1+х2+х3…+х?ンムロ
2)Отклонение d1-случайное отклонение i варианты от среднего d1=xi-x͞ 3)Дисперсия V(S2) показывает рассеивание вариант относительно среднего и характеризует воспроизводимость анализа V=∑?ンムヨ2?=∑(?ンムヨ−?ᅪ゙)2?¬ネメ1 где f=(n-1)-число степеней свободы 4) Дисперсия среднего: Vx͞=?ンムロ 5) Стандартное отклонение S-корень квадратный из дисперсии, взятый со знаком (+). S=+√?=+(∑?12?¬ネメ1)0,5
6) Стандартное отклонение среднего: Sx͞=?¬ネレ?=√?ンムロ 7)Относительное стандартное отклонение Sr-это отношение стандартного отклонения к среднему значению Sr=?ンムᆬ͞ 8)Доверительный интервал x͞± ?x͞ 9) Доверительная вероятность Р-вероятность нахождения истинного значения Р=0,95=95% 10) Полуширина доверительного интервала ?x͞=?ンムン∗? ∗?¬ネレ? tр*f-коэффициент Стьюдента, функция Стьюдента, критерий Стьюдента tр*f зависит от Р и числа n проведенных определений. 11)Относительная (%) ошибка среднего резальтата ?ᅪ゙=?x͞?ᅪ゙*100% Выборка не должна содержать грубых проб. Если V выборки 5≤n≤10, то исключение грубых промахов проводят с
помощью Q-критерия(Q-теста). Для этого варианты хi располагают в порядке возрастанияих численных значений. Затем для краевых вариант-минимальный, и так вычисляют величину Q Q1=?2−?1? R-различные варьирования R=xn-x1 xn-максимальное значение x1-минимальное значение При проведении Q теста Р равен 90% Если n>10,то рассчитывают среднее значение, отклонение для всех вариантов и стандартное отклонение. /di/≤3S Сравнение двух методов (1,2) Пусть V1>V2 n>10 Для оценки того значимое или незначимое расхождение между дисперсией используется критерий Фишера. Fрассчит.=?1?2
Fрассчит. Сравнивают с табличным F Если Fрассчит. <F, то различие между значениями V1 и V2 cлучайные. Для оценки правильной методики проводят анализ стандартного вещества. Для этого tрасч. ( критерий Стьюдента ) Если tрасч > tтабл,, то между средним и истинным значением ошибка. Если tрасч < tтабл,, то расхождение е значимо и метод не содержит ошибки
34 Вопрос: Ошибки количественного анализа .Классификация ошибок источники систематических ошибок .Способы выявления ошибок.
Количественный анализ
Классификация:
I. Химический – получение данных в результате изменения окраски, выделение газа, осадка.
1. Гравиметрический метод (весовые). Основаны на изменении массы определяемого вещества, отделенного от остальных веществ, измерение массы в виде соединения с точно известным составом.
Достоинства: простота выполнения, точность, воспроизводимость
Недостатки: очень продолжительный
2. Титриметрические методы (объемные). Основаны на измерении объема или массы реагента (титранта), затраченных на реакцию с определяемым веществом.
Достоинства: простота, точность, воспроизводимость, быстрота
Недостатки: требует использования индикатора
Требования к реакциям:
1. Должны протекать быстро, до конца, при комнатной температуре.
2. Вещества должны реагировать стехиометрически без побочных реакций.
3. Присутствие примесей не должно мешать анализу.
Ошибки анализа
Если при проведении анализа допущено отступление от методики, анализ нужно повторить. Для выявления ошибок анализ повторяют несколько раз.
Параллельное определение – получение нескольких результатов для одной пробы в одних условиях.
Единичное определение- однократное определение всей последовательности операций, предусмотренной методикой.
Правильность – качество анализа
Воспроизводимость – близость результатов единичных определений
Классификация ошибок:
1. Систематические – разность между средним и истинным значением
δ = х – а, а = истинное значение
2. Процентная систематическая
δ (%) = (х - а) / а х 100%
3. Грубые – если не соблюдаются методики, их можно устранить путем повторного проведения анализа
4. Случайные (причину определить невозможно)
Источники ошибок
1. Методические – обусловлены особенностью методики
2. Инструментальные – вызваны несовершенством приборов/оборудования
3. Индивидуальные – обусловлены качествами экспериментатора
Выявление ошибок
1. Использование стандартных образцов.
2. Метод добавок ( метод удвоения) – используются тогда, когда нет стандартных образцов
* исследуют образец по методике, затем удваивают массу вещества и затем снова находят содержание определяемого компонента в новой пробе и снова удваивают результат анализа
Исследуют вещество другими методами.
35 Вопрос:Статистическая обработка результатов количественного анализа
36 Вопрос: Гравиметрический анализ .Классификация методов анализа:
- метод количественного анализа, основанного на измерении массы определяемого вещества путем взвешивания массы конечного вещества.
Классификация:
1. Метод отделения – самый распространенный 2. Метод отборки
3. Метод выделения 4.Термогравиметрический метод Метод осаждения
Вещество переводят в раствор, определяемый элемент опускают в виде малорастворимого соединения, осадок отфильтровывают, прокалывают, высушивают, взвешивают.
По массе осадка и его формуле определяет соединение элемента определяемого вещества путем взвешивания массы конечного вещества.
Метод отборки
Выделяют в виде газа, масса отогнанного вещества (для определения массы Н2О), масса остатка (для определения летучих веществ)
Метод выделения
Определяемый компонент выделяют при электролизе, нейтрод с веществом промывают, высушивают, взвешивают. По увеличению массы электрода с веществом определяют массу этого вещества.
Термогравиметрический метод
Основан на изменении массы исследуемого вещества при непрерывном нагревании в заданном интервале. Измерения проводят по дериватографе.
Выбор массы навески
Оценит не больше 0,2%
Массу навески берут такой, чтобы масса удаляемых летучих веществ и масса остатка не > 0,1г.
m = m(x) x 100% / ώ(x)
m(x) – масса летучих веществ
ώ(x) – массовая доля летучих веществ
Метод осаждения
1. Расчет массы навески и объем
2. Взвешивание навески
3. Растворение навески
4. Определение осаждаемого компонента
5. Фильтрование
6. Промывание осадка
7. Высушивание
8. Прокаливание до получения гравиметрической формы (ГФ)
9. Взвешивание ГФ
10. Расчет результата
Если взять навеску очень большой, то получится большая масса осадка, что будет затруднять его фильтрование и промывание, а также способствует со осаждению примесей; увеличению продолжительности анализа, расход реактивов. Если масса навески очень мало, то потеря при последующих операциях приведут к большой ошибке анализа.
При расчете массы навески учитывают:
1) массовую долю определяемого компонента в исследуемом веществе и в ГФ
2) массу ГФ
3) ошибку взвешивания на аналитических весах (не > 0,0002г) и характер осадка (аморфный, кристаллический).
Относительная ошибка взвешивания определяется и формула
E = ▲m/m *100%
Е = 0,0002
m – масса навески
то m(навески) = (0,0002/0,02)/100 = 0,1 г (оптимальная масса)
Относительная масса ГФ
Тип осадка Масса осаждаемой формы, г
Аморфные
Кристаллический (легкий)
Кристаллический (тяжелый)
Кристаллический (очень тяжелый)
(кр, ВаSO4) 0,05 – 0,1 0,1 – 0,2 0,2 – 0,4 ≤ 0,5г
Зная массу ГФ, ее состав и примерное содержание навески
m(навески) = m(ГФ) x F x 100% / ώ(x) , где F – гравиметрический фактор
F = n x M(x) / M(ГФ)
Пример найти F для получения Аl в виде Аl2O3
F = M(Al) x 2 / M(Al2O3) (n = 2, т.к. Al2O3)
Расчет количества осадителя
Если осадитель летуч (удаляется при нагревании осадка – Hcl),
то берут 2-3х кратный его избыток по сравнению с рассчитанным.
Если осадитель нелетуч (Bacl2) – берут 1,5 кратный его избыток.
Требования к осадителю:
1) должен быть специфичным и селективным по отношению к осаждаемому иону
2) должен быть летучим (удаляется при увеличении температуры, и прокаливании)
Неорганические осадители: Hcl, Bacl2, H2SO4, H3PO4, NaOH, AgNO3.
Органические осадители: диметилглиоксим, карбоновые кислоты, щавелевая кислота.
Получение осаждаемой формы:
Осадительная форма – соединение, которое определяется при взаимодействии с осадителем.
Веловая форма – соединение, взвешивают для получения конечного результата.
Иногда осаждаемая и веловая форма совпадают (BaSO4).
Требования к осаждаемой форме:
1) малая растворимость осадка (ПР ˂ 10-8)
2) осадок не должен содержать примесей
3) осадок должен быть удобным для промывания и фильтрования
4) Осаждаемая форма должна полностью переходить в гравиметрическую форму.
5) Крупнокристаллические легко фильтруются, промываются, малоадсорбируют посторонние вещества.
Мелкокристаллические осадки менее удобны: т.к. содержат примеси и могут проходить через фильтр.
Аморфные медленно фильтруются, имеют большую плотность, поэтому адсорбируют много примесей, медленно и трудно промываются.
Получение кристаллических осадков:
1) осаждение ведут из разбавленного исследуемого раствора, разбавленного раствором осадителя.
2) из горячих разбавленных растворов, прибавляя по каплям горячий разбавленный раствор осадителя.
Получение аморфных осадков:
1) осаждение ведут из горячих концентрированных растворов, быстро прибавляя горячий концентрированный раствор осадителя.
Фильтрование (Ф)
1) Ф кристаллических осадков после созревания
2) Ф аморфных сразу после осаждения
Фильтры с синей лентой: для фильтрования мелкокристаллических осадков, с белой лентой – для крупнокристаллических осадков, фильтры с черной (красной) – для фильтрования аморфных
Промывание осадков
1) кристаллические осадки – дистиллированной водой или разбавленным раствором осадителя
аморфные – водным раствором сильного электролита
37 Вопрос: метод осаждения .Расчет количества (обьема и массы) осадителя:
Метод осаждения
Вещество переводят в раствор, определяемый элемент опускают в виде малорастворимого соединения, осадок отфильтровывают, прокалывают, высушивают, взвешивают.
По массе осадка и его формуле определяет соединение элемента определяемого вещества путем взвешивания массы конечного вещества.
Получение ГФ
– Путем высушивания в сушильном шкафу или прокаливания в печи до постоянной массы
Требования к ГФ
1) состав должен соответствовать формуле
2) не должен окислятся
3) массовая доля определяемого компонента в ГФ должна быть небольшой
Зная массу ГФ и значения F рассчитывают массу определяемого компонента:
m(x) = m(ГФ) х F
1. Расчет массы навески и объем
2. Взвешивание навески
3. Растворение навески
4. Определение осаждаемого компонента
5. Фильтрование
6. Промывание осадка
7. Высушивание
8. Прокаливание до получения гравиметрической формы (ГФ)
9. Взвешивание ГФ
Расчет результата
38 Вопрос: Требования к осадителю. Требования к осаждаемой форме .Требования к гравиметрической форме:
39 Вопрос : Получение осаждаемой формы.Условия получения кристаллических и аморфных осадков. Фильтрование .Аромывание осадка .Получение гравиметрической формы.
40 Вопрос: Титриметрический анализ .Требования к стандарту.Классификация методов.
Достоинства
1) доступность оборудования
2) быстрота определения
3) погрешность определения – 0,1
Применение
1) в анализе органических и неорганических соединений
2) в водных и неводных средах
Титрование – процесс постепенного приливания раствора с известной концентрацией к определенному объему другого раствора.
По объему и концентрации раствора реагента определяют содержание исследуемого вещества С1V1 = C2V2
Титр – количество вещества, содержащегося в 1мл раствора (Т)
Т = m/ 1000
Раствор, титрования которого известен называется титрованным.
Титриметрическая система – смесь веществ образовавшихся при взаимодействии титранта и титруемого вещества.
Титрант – раствор, который приливают (имеет точно известную концентрацию).
Титруемый раствор – раствор, к которому приливают титрант.
Стандарт – используемое для приготовления раствора с точно известной концентрацией.
Стандартизация – определение точной концентрации титранта.
Фиксанал – запаянная ампула, в которой находится определяемое количество вещества с известной концентрацией.
Точка эквивалентности (ТЭ) – момент титрования, когда число эквивалентов титранта равно числу эквивалентов определяемого вещества.
Индикатор - вещество, применяемое для установления конечной точки титрования (КТТ).
Степень оттитрованности ƒ – отношение количества эквивалентов титранта к числу эквивалентов определяемого вещества
ƒ = [CН (титранта) х V (титранта)] / [CН (Х) х V(Х) ]
CН (Х) – нормальная концентрация определяемого вещества.
Классификация методов
1. Кислотно-основное титрование
- титрование, основанное на переходе протонов от первой частицы к другой
Различают
а) алкалиметрия – определение веществ титрованием раствором сильного основания
б) ацидиметрия – определение веществ титрованием раствором кислоты
2. ОВ титрование (редоксиметрия)
- определение веществ титрованием, сопровождаемое переходом электронов от восстановителя к окислителю
3. Осадительное титрование
- титрование, когда титруемое вещество при взаимодействии с титрантом выделяется в виде осадка
4. Комплексиметрическое титрование
- титрование вещества, раствором соединения, которое образует с нитруемым веществом слабо диссоциирующий комплекс
Разновидность комплексиметрического титрования является комплексокометрическое титрование ( – титрование, когда титруемое вещество с титрантом образуют комплексонаты металлов)
Требования к реакциям
1. Должна протекать по уранению без побочных прцесов
2. Должна протекать до конца
3. Должна протекать быстро
4. Должна позволять КТТ вблизи ТЭ
Если реакция не удовлетворяет хотя бы одному требованию ее нельзя использовать в титриметрическом анализе
Виды титрования
1. Прямое титрование
- когда определяемое вещество непосредственно титруется раствором титранта:
СтVт = CхVх
Т(Х) = [CН(Х) х МЭ(Х)] / 1000
2. Обратное титрование
- титрование не прореагировавшего вещества, которое прибавлено в избытке к исследуемому раствору
Используются, когда скорость реакции очень малы, сложно подобрать индикатор и идут побочные процессы
3. Косвенное титрование
- титрование, когда определяемое вещество не реагирует с титрантом, а определяется в результате использования реакции с образованием другого вещества, которое реагирует с титрантом
Установление КТТ
1. Визуальные методы
- КТТ устанавливают по появлению, исчезновению, изменению окраски, по образованию или растворению осадка
2. Инструментальные методы
КТТ устанавливают по изменению физико-химических свойств (оптическая плотность, сила тока, электропроводность)
41 Вопрос: Требования к реакциям .Виды титрования в титриметрическом анализе:
42 Вопрос: Установление ктт.Метод отдельных навесок.Метод пипетирования.
43 Вопрос: Кислотно-основное титрование:
– метод анализа, основанное на взаимодействии кислот и оснований
Различают:
1) ацидиметрия
Для определения сильных и слабых оснований, основных солей, солей слабых кислот (титрантом является кислота)
2) акалиметрия (титрант основание)
Для определения сильных и слабых кислот, кислых солей, солей слабых оснований
Титранты: растворы Hcl, H2SO4, KOH, NaOH c Cм = 0,1 н
Примечание
- более концентрированные растворы нежелательны из-за повышения ошибок титрования
- разбавленные растворы не удобны из-за слабого действия индикатора
Стандарты: тетраборат натрия Na2B4O7; Na2CO3 (с их помощью уравнивают титрование растворов (концентрацию) кислот), щавелевая кислота H2C2O4 (используют для установления концентрации щелочей)
44 Вопрос: Индикаторы кислотно-основного титрования.Теория кислотно-основных индикаторов .Классификация кислотно-основных индикаторов:
Индикаторы
КО - индикатор – органическое вещество (слабое кислота / основание), степень диссоциации и цвет которого зависит то рН
Индикаторы характеризуются:
Показателем титрования (рТ) и интервалом перехода окраски (ИП)
ПТ – значение рН, при котором заканчивается титрование с данным индикатором
ИП – область концентрации Н+, в пределах которой можно обнаружить изменение интенсивности окраски индикатора
На величину ПТ и ИП влияют:
1) концентрация индикатора
2) ионная сила
3) температура
4) концентрация растворимости СО2
5) неодинаковая интенсивность окраски кислой и основной формы
Требования к индикаторам:
1) окраска должна быть интенсивной, различаться в кислой и щелочной средах
2) окраска должна меняться быстро в узком интервале изменения рН
3) индикатор должен менять окраску при минимальном избытке кислоты и щелочи
4) индикатор должен быть стабильным, не разлагаться на воздухе и в растворе
Теория кислотно-основных индикаторов
1) ионная
2) Хромофорная
3) Ионно-хромофорная
Ионная теория
Теория объясняет различие окрасок кислотной и основной форм
Недостатки:
1) не объясняет природы наличия и изменения самой окраски
2) не связывает окраску индикаторов с их строением
3) переходы одной формы в другую должен происходить мгновенно, но в ряде случаев изменение цвета не мгновенно
Хромофорная теория
N=N – ; – C=S – ; – N=O – хромофорные группировки
Функциональные группы (амино, гидрокси, метоксипиридины): влияют на свойства (изменяют оттенок или интенсивность)
Индикаторы в разных растворах происходят в разных формах
– Высшей формы – доминирующая одна
– В основной форме – доминирующая другая
Классификация индикаторов
I. По строению
а) азоиндикаторы - производные п-аминобензола и п-диметиламиноазобензола (метилоранж, метиловый красный)
б) трифенилметановые индикаторы – производные трифенилметана (фенолфталейн, тимоловый синий, метиловый фиолетовый)
в) нитропроизводные (п-нитрофенол)
г) индикаторы, не относящиеся к вышесказанным (лакмус, нейтральный красный)
II. По способу применения
а) внутренний индикатор (добавляется в раствор)
б) внешний индикатор (находятся вне раствора, индикаторная бумага, например, онгокрасный)
III. По составу индикатора
а) индивидуальные (т.е. состоящие из 1-го соединения)
б) смешанные (смесь двух индикаторов, либо индикатора с красителем)
IV. По цветности
а) одноцветные – окрашены по 1 стороне, не окрашены по другой – (например Ф/Ф) (в нейтральной , в кислой бесцветен, в щелочной - малиновый)
б) двухцветные (большинство) – имеет разные окраски по каждой стороне интервала перехода.
Ошибки титрования
1. Обусловлен неточным измерением объема
2. Индикаторные ошибки (не должна быть > 0,2%)
Индикаторные ошибки подразделяются:
1. водородная
2. гидрооксидная
3. кислотная
4. основная
Водородная (протонная) ошибка Н+ вызвана присутствием избытка Н+ в конечной точки титрования ( КТТ ) вследствие недотитровывания раствора силой кислоты (отрицательная ошибка), либо перетитровывания раствором сил кислоты (ошибка «+»)
ХН+ = +| – (a’ х 100%) / а
где а’ и а – количество эквивалентов избыточных ионов Н+ в КТТ и общее количество эквивалентов сил кислоты, введенных в раствор
Гидрооксидная ошибка ХОН – возникает при наличии избытка ОН- в КТТ вследствие либо недотитровывания раствора сильного основания кислотой (отрицательная ошибка), либо перетитровывания раствора кислоты раствором сильного основания (положительная ошибка)
ХОН = +| – (b’ x 100%) / b
где b’ и b – количество эквивалентов избыточных ионов ОН- в КТТ и общее количество эквивалентов сильного основания, введенных в раствор
Кислотная ошибка Ха вызвана присутствием некоторого количества недотитрованной слабой кислоты в КТТ
Ха = (n’ x 100%) / n
где n’ и n – количество недотитрованной слабой кислоты HA и общее количество слабой кислоты HA.
45 вопрос: Кривые кислотно-основного титрования . Титрование сильной кислоты сильным основанием .Титрование сильного основания сильной кислотой.Титрование слабой кислоты сильным основанием .Титрование слабого основания сильной кислотой .Титрование солей.
Кривые кислотно-основного титрования
- графики отражают изменения рН титруемого раствора от объема прибавленного титранта или от степени оттитрованности ( ƒ )
построение кривых
Кривые кислотно-основного титрования
- графики отражают изменения рН титруемого раствора от объема прибавленного титранта или от степени оттитрованности ( ƒ )
построение кривых
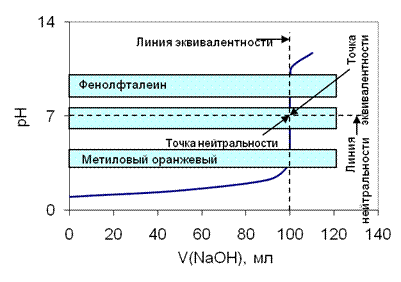
Кривая титрования 100,0 мл 0,1 М HCl 0,1 М раствором NaOH
Анализ кривых позволяет определить скачок титрования и подобрать индикаторы (чтобы значение рТ индикатора укладывалась внутри скачка титрования)
Для построения кривой необходимо рассчитать рН для исходного раствора, для раствора до точки эквивалентности (ТЭ) в ТЭ, и после ТЭ.
До ТЭ в растворе приливает избыток титруемого вещества Х, концентрация которого рассчитывают:
СН (Х) = [С’Н (Х) х V(X) x С’Н (T) х V(T)] / VР-РА = С’Н (Х) х (V(X) / VР-РА ) х (1 – ƒ)
где ƒ - степень оттитрованности
Концентрация определения соли С3
С3 = [СН (T) х V(T)] = СН (Х) х (V(X) / VР-РА ) x ƒ
В ТЭ растворе присутствует только образовавшаяся в результате реакции соль, концентрацию которого можно определить по формуле
С3 = [СН (Х) х V(X)] / VР-РА
после ТЭ в растворе имеется образовавшаяся соль и избыток титранта
Концентрация титранта:
СН (Т) = [С’Н (Т) х V(Т) – С’Н (Х) х V(Х) ] / VР-РА = С’Н (Т) х (V(Т) / VР-РА ) х (1 – ƒ)
Титрование сильной кислоты сильным основанием
До ТЭ рН титрованного раствора определяется СМХ сильной кислоты, рН ˂ 7 рН = - lg [H+]
В ТЭ среда нейтральная, рН = 7
после ТЭ рН титрованного раствора определяется С избытком титранта, рН > 7 рН = рКW + lgC (T)
Кривая титрования 100,0 мл 0,1 М HCl 0,1 М раствором NaOH
Титрование сильного основания сильной кислотой
Для исходного раствора сильного основания и титруемого раствора величина рН до ТЭ определяется концентрация щелочи в растворе:
рН = 14 – рОН = 14 + lgC’ (X)
до ТЭ:
рН = 14 + lg {[С’(X) х V(X) – С’(T) х V(T)] / [V(X) + V(T)]}
В ТЭ раствор нейтральный, рН = 7
После ТЭ величина рН раствора обусловлена присутствием избыточного титранта рН = - lgС (Т)
pH
Титрование слабой кислоты сильным основанием
НАr + ОН– ̶˃ Аr – + H2O
рН раствора до ТЭ определяется присутствием в растворе … смеси НАr + Аr –
состоящей из неоттитрованной … и ее оси (СА и Сb):
рН х рКа – lg СА / Сb
В ТЭ в растворе присутствует тоьлько соль сильного основания и слабой кислоты
рН = (рКw / 2) + (½) х (рКа + lgCb)
рКw / 2 = 7
После ТЭ в растворе присутствуют соли сильных оснований и слабой кислоты и избыток основания – титран…
рН = рКw + lgC (T)
Титрование слабого основания сильной кислотой
B + H3O+ ˂ = ˃ H2O + BH+ до начала титрования
рН = рКw –1/2 (pKb+lgCa)
рН раствора до ТЭ определяется присутствием
B + BH+ состоящей из неоттитрованного слабого основания и его соли
рН = рКw + lgKb (Cb / СА), где Cb и СА – молярные концентрации основания
B и его …
Kb – константа ионизации слабого основания
В тэ в растворе присутствует только соль. РН раствора определяется гидролизом Кt остатка слабого огня
рН = (рКw / 2) – (½) х (рКb + lgCa); C = [С(Х) х V(X)] / VР-РА
После ТЭ присутствует только соль и избыток титранта
рН = - lgС (Т)
С(Т) = [C’(T) x V(T) x C(T) x V(T)] / VР-РА
Титрование солей
Если соль образована анионом многоосновной кислоты, то процесс титрования протекает в несколько стадий
Пример Na2CO3 раствором Hcl
В ТЭ присутствует … смесь Na2CO3 и NaНCO3
Кривая титрования 0,1 моль/л раствора Na2CO3 сильной кислотой имеет 2 скопка, соответствующих 2 ТЭ при рН 8,32 и 3,88
46 Вопрос: Ошибки титрования .Влияние факторов на скачок титрования:
Ошибки обусл. Нетоностью измерения обьема
Если раствор отбирается с помощью бюретки , то проводят 2 измерения обьема
Случ. Обибка каждого измерения ± 0,01-0,02 мл. Максим.относительная ошибка измерения обьема сс помощью бюретки составляет 0,2 процента.
Если раствор отбирается с помощью градуированной пипетки , то измерения проводятся один раз , то ошибка определения обьема изменяется в 2 раза. При проведении титрования часто приб.избыток кол.титранта , т.е р-р перетитровавыют . Суммарно максимальная относительная ошибка измерения обьема титранта — 0,45 процента.
Влияние факторов на скачок титрования
1) концентрация титруемого раствора и титранта должны быть одинаковыми или близкими друг к другу
Чем больше С титруемого растворов титруемого вещества и титранта, тем больше скачок на кривой титрования
2) посторонние вещества
Для титрования следует использовать чистые растворы, не содержащие примесей
3) сила титруемых кислот и оснований
Чем больше Ка слабой кислоты или слабого основания, тем больше скачок на кривой титрования (чем больше скачок, тем лучше правильнее выбрать индикатор для титрования)
Слабые кислоты и основания, у которых рК ˃ 5- 6 титровать … (трудно подобрать индикатор)
4) температура
С ростом температуры меняются изменения Ка , что сказывается на величине скачка.
При росте температуры уменьшается скачок титрования отсюда сложно подобрать индикатор
47 Вопрос: окислительно -восстановительное титрования.Классификация редокс -методов:
Окислительно-восстановительное титрование
- титрование, сопровождается переводом электронов от восстановителя к окислителю
Титрантом является окислители, ОВ у которых ОВ- потенциал (Е0) имеют высокое значение
Н/Р , Е0 (Cr2O72- | Cr3+) = 1,3 В; а также восстановители, у которых Е0 имеет минимальное значение
I. По характеру титранта
1) Оксидиметрия – определение восстановителя титрантом окислителя
2) Редуктометрия – определение окислителя титрантом восстановителя
II. По природе реагента
1) перманганатометрия
2) дихраматометрия
3) йодиметрия
4) йодометрия
5) йодатометрия
6) бромометрия
7) броматодиметрия
8) нитритометрия
Условия проведения ОВ титрования
1) реакция должна протекать до конца (чем больше КР , тем полнее идет ОВР);
2) реакция должна идти быстро;
3) не должно быть побочных реакций или процессов;
4) КТТ должна определятся либо с индикатором или без;
если реакция протекает медленно, то раствор нагревают (недостаток)
48 Вопрос: Условия проведения ов титрования .Виды титрованиея :
Виды ОВ титрования
1. Прямая( определения железа 2)
2. Обратная( йодометрическое определение сульфидов)
Заместительное( титрование перекиси)
49 Вопрос:Индикаторы окислительно-восстановительного титрования.Классификация индикаторов ов титрования .Индикаторные ошибки:
Индикаторы ОВ титрования
1. Индикатор – вещество или реагент, участвующий в ОВР ( КМnO4)
2. Индикатор – вещество, вступающее в специфическое взаимодействие с окислителем или восстановителем с образованием окрашенных продуктов (крахмал)
3. Индикатор – вещество, которое при определенном потенциале окисляется или восстанавливается с изменением окраски (ОВ индикатор)
Классификация индикаторов
1. Обратимые (меняют окраску обратимо при потенциале раствора в ТЭ или вблизи ее), при этом не разрушаются : например , дифениламин
2. Необратимые ( меняют окраску при достижении определенного потенциала (Е), при этом разрушаются, например , м/о, в ТЭ или вблизи
Индикаторные ошибки
Ошибки обусловлены несовпадением потенциалов титруемого раствора в ТЭ и в конечной титрования (КТТ).
Если ЕР-РА в КТТ меньше Е в ТЭ то раствор недотитрован, индикаторная ошибка отрицательная
Если ЕР-РА в КТТ больше Е в ТЭ то раствор перетитрован, индикаторная ошибка положительная
Х(ошибки) = (▲n / n) x 100%
Где ▲n – избыток / недостаток , а n – общее количество
Кривая титрования – изменение потенциала раствора в зависимости от V прибавленного титранта

Уравнение ОВ – реакции
nTXRed + nX TOX ̶˃ nXTRed + nTXOX
Х – определяемое количество, Т – титрант
nT – число электронов, применяемых титрантом
nX – число электронов, отдаваемых одной молекулы определяемого вещества
Из уравнения Нернста:
(1) Е (XOX | XRed) = Е0 (XOX | XRed) + (0,059/ nX) lg[XOX] / [XRed]
(2) Е (TOX | TRed) = Е0 (TOX | TRed) + (0,059/ nT) lg[TOX] / [TRed]
До ТЭ потенциал системы рассчитывается по формуле (1)
В растворе присутствует ОХ и Red формы определяющего вещест
50 Вопрос: Кривые окислительно-восстановительного титрования.Факторы влияющие на скачок кривой ов титрование :
Факторы, влияющие на скачок кривой ОВ титования
1) природа титруемого вещества и титранта;
2) с окисленной и восстановленной форм редокс пар ;
3) рН среды;
4) температура;
5) присутствие посторонних веществ;
процессы комплексообразования
Кривые ОВ титрования: Это графическое представление изменения потенциала равтвора в зависимости от обьема прибавленного титранта
Наибольшее изменение потенциала раствора наблюдается в точке эквивалента и вблизи ее.
Поэтому в этой области и обнаруживается скачок титрования.
Кривые ОВ титрования строят для того,чтобы опред.скачок титрования и подобрать индикатор.Если при титровании не использовалось жид., то построение кривой титрования смысла не имеет.
51 Вопрос: Перманганатометрическое титрование.Условия проведения титрования .Применение: Перманганатометрия
Перманганатометрия -это метод определения восстановителей, а также веществ не обладающих ОВ свойствами с применением титранта КМnO4.Титрант КМnO4 с нормальной концентрацией 0,1 моль/л. Растворы КМnO4 не устойчивы. Разложение МnO4 ускоряется на свету под действием кислот и оснований, поэтому стандартизованный раствор КМnO4 приготовить по точной навески нельзя. Стандартизацию раствора КМnO4 проводят по щавелевой кислоте. Стандартизованный раствор КМnO4 хранят в темном месте, в темной склянке. Концентрацию раствора переодически проверяют.
Влияние среды:
1.В кислой среде МnO4 восстановливается до Мn2+, Е0=1,51В. С ростом Н+ потенциал возрастает, поэтому эффективность МnO4- в кислой среде повышается.
2.В нейтральной среде МnO4 восстановливается до МnO2 (осадок), Е0=0,6В. МnO2 затрудняет фиксацию КТТ, что увеличивает ошибку анализа, поэтому КМnO4 как титрант в нейтральной среде не используется.
3.В щелочной среде МnO4- восстанавливается до МnO42- (зеленый цвет) Е0= 0,56В. В щелочной среде КМnO4 менее эффективен.
Условия проведения титрования:
1.Влияние среды. Титрование проводят в серно-кислой среде. Азотная кислота, как окислитель сама может окислять определяемое вещество. Соляная кислота, так как Сl2- окисляется до Сl2-. Серно-кислая среда.
2.Влияние температуры. Титрование при комнатной температуре, исключение МnO4- с щавелевой кислотой.
3.Фиксация КТТ. КМnO4 обладает интенсивной окраской, поэтому при титровании индикатор не используется.
4.Ход титрования. К раствору определяемого вещества медленно по каплям добавляется титрант, чтобы не протекали побочные процессы. Бюретки должны быть со стеклянным экраном.
Применение:
Для определения карбоновых кислот, железа, Н2О2, окисляемости воды и почвы.
52 Вопрос: Дихроматометрическое титрование.Применение: ихроматометрия
Дихроматометрия – это определение веществ, основано на реакции окисления их дихроматоионнами. Е0(Cr2O72-/Cr3+) =1,36В. Фактор эквивалентности 1/6.
Е0 возрастает с повышением концентрации Н+, поэтому окислительная способность повышается с понижением рН. Кислую среду создают прибавляя фосфорную кислоту. Титрант K2Cr2O7 c Cн=0,1 моль/л. Раствор готовят по точной навески. При хранении раствор стабилен, не меняет концентрацию в течении 2-х дней. Титрование проводят в присутствии индикаторов (дифениламин).
Недостатки:
1. меньший потенциал, чем у перманганатометрии.
2. необходимость использования индикатора.
Применение:
Определяют сульфиты, иодиды, Fe2+, аскорбиновую кислоту, нитраты(обратное титрование).
53 Вопрос: Йодиметрическое титрование .Способы фиксации ктт. Хлориодиметрическое титрование.Применение. Йодиметрия
Йодиметрия – это определение восстановителей стандартным раствором йода. В основе метода лежит реакция.
J3- + 2е 3J-. Е0=0,5В
Окислителем является J2- плохо растворяется в воде, хорошо в KJ. J2- + J- J3-
Фактор эквивалентности 1/2. Титрант метода раствор J2- в KJ с нормальной концентрацией 0,1 или 0,01. Титрант готовят по точной навески, в качестве титранта применяется стандартный раствор тиосульфата натрия, в присутствии крахмала.
Недостаток:
1.раствор J не устойчив.
2.меняет титр (концентрацию) при хранении(окисление кислородом воздуха, летучесть).
Стандартные растворы хранят в темных склянках, в темном месте, на холоду.
Условия йодометрического титрования:
1.Титрование проводить на холоду
2.Титрование часто проводят в присутствии веществ, которые связывают продукты в прочный комплекс (трилон Б).
3.Титрование проводят в слабокислых, нейтральных, слабощелочных средах.
Фиксация КТТ:
1.Безиндикаторный.
2.Индикаторный (1% крахмал)
Применение:
Для определения Аs, сульфитов, тиосульфатов, аскорбиновую кислоту, формальдегид, воду в различных объектах (в организме, неорганических соединениях).
Хлорйодиметрическое титрование
Хлорйодометрия – это определение восстановителей, с применением раствора JCl.
JCl + 2e J- + Cl-. Фактор эквивалентности 1/2. Е0=0,8В.
Более устойчив, чем J2-. Титрант – раствор JCl, Сн=0,1.
Получают: 2KJ + KJO3 + 6HCl 3JCl + 3KCl + 3H2O
Стандартизация JCl по раствору тиосульфата натрия. Хранят в темном месте, в темной склянке. Индикатор – 1% крахмал. Титрование в кислую, нейтральную, щелочную среду.
Применение: Pb, Sn2+
54 Вопрос: Йодометрическое титрование .Йодаметрическое титрование .Применение: Иодометрия
Йодометрия – это определенный окислительный заместитель титрованием йода раствором Na2S2O3.
2J- J2 + восстановитель
Титрант раствор Na2S2O3, Сн=0,1 или 0,01. Растворы Na2S2O3 при хранении изменяют титр. На свету разлагается и в кислой среде разлагаются. При рН=9,10 в щелочной среде раствор устойчивый. Стандартизацию проводят по K2Cr2O7 и по KBrO3. Индикатор – свежеприготовленный 1%-ный раствор крахмала.
Применение:
Пероксиды, медь, окислитель K2Cr2O7.
Иодатометрическое титрование
Йодатометрия – это определение восстановителей раствором KJO3. В основе реакция:
JO3- + 6е + 6Н+ J- + 3H2O. Фактор эквивалентности 1/6, Е0=1,2В.
Титрант KJO3, Сн=0,1. Хранят в темном месте, в темной склянке. Индикатор - 1%-ный раствор крахмала.
Применение:
Олово, мышьяк, железо, сульфиды, тиосульфаты прямое титрование;
Пероксиды - обратное титрование.
55 Вопрос: Броматометрическое титрование.Бромаметрическое титрование .Применение:
Броматометрическое титрование
Броматометрия – это определение восстановителя путем титрования бромата калия KBrO3.
BrO3- + 6е +6Н+ Br-- + 3Н2О. Е0=1,4В. Фактор эквивалентности 1/6. Титрант KBrO3, Сн=0,1.
Хранят в темном месте, в темной склянке. Титрование ведут в присутствии метилового оранжевого, метилового красного. Индикаторы бромируются, раствор обесцвечивается.
Необходимо учитывать:
1.Кислотность. С понижением рН, ОВ потенциал увеличивается, поэтому лучше проводить в кислой среде.
2.Температура (реакция с BrO3-). Раствор подогревают.
3.Катализатор. Реакция ускоряется в присутствии солей ртути.
Применение:
Мышьяк, пероксиды, нитриты, щавелевую кислоту, олово.
Бромометрическое титрование
Бромометрия – это определение восстановителей с применением Br2.
Br2 + 2е 2 Br-. Е0=1.1В
Раствор Br не устойчив, токсичен, поэтому как титрант не применятся. Источник Br, это бромат- бромидная смесь (KBrO3 + КBr). Определяемое вещество бромируется в первую очередь, затем после точки эквивалентности бромируется индикатор и изменяется окраска.
Применение:
Для определения анилина, фенола, резорцина, стрептоцида, салицилата.
56 Вопрос : Нитритометрическое титрование .Фиксация Ктт.Применение:Нитритометрическое титрование
Нитритометрия – это определение веществ с использованием NaNO2.
NO2- + е + 2Н+ NO + Н2О. Е0=1В. Фактор эквивалентности 1.
Потенциал увеличивается с повышением кислотности. Титрант – это раствор NaNO2, Сн=0,1. Раствор готовят с приблизительной концентрацией, проводят стардитизацией (по КМnO4, сульфаниловой кислоте).
Необходимо учитывать:
1.Раствор NaNO2 + к кислому титруемому раствору.
2.Нитрит натрия перед титрованием не подкисляют.
Индикаторные методы:
1.трилеолин-00
2.нетрально красный
3.иодокрахмальную бумагу
Применение:
As3+, новокаин, стрептоцид, парацетамол, Fe2+.
Фиксация КТТ
Тролиалин нейтральный красный внутрн.индикатор!
Внешний индикатор-1.крахмальная бумага.
Применение: Для определения SN(2), Железа 2, ароматич.нитропроизводных, парацетамола, стрептоцид, уротропин, анестезин.
57 Вопрос: Цериметрическое титрование .Применение:
Цериметрическое титрование
Цериметрия – это определение веществ сульфатом церия (Се).
Се4+ в водных растворах присутствует в виде комплексных соединений, используется в кислых растворы.
Окраска желтая.
Се4+ + е Се3+ (бесцветный). Е0=1,4В. Фактор эквивалентности = 1.
Титрант Ce(SO4)2, Сн=0,1 или 0,01. Растворы Се долю сохраняются. Растворы готовят приблизительной концентрацией, затем стандартизуют (йодометрический):
Се4+ + J- Ce3+ + J2 - (оттитровывают раствором Na2S2O3).
Применение:
Олово(II), As3+, Fe2+, H2O2, щавелевую кислоту, амины, фенол.
Недостатки:
1.Непригодный для титрования (нейтрального и щелочного).
2.Высокая стоимость.
58 Вопрос: Комплексиметрическое титрование .Классификация методов:
Комплексиметрическое титрование
Комплексиметрическое титрование – это метод анализа основанный на реакциях комплексообразования между определяемым веществом и титрантом.
Требования к реакциям:
1.Должен образовываться один продукт определенного состава.
2.Реакция должна идти до конца (99,99%).
3.Должна реакция протекать быстро и обеспечивать четкую фиксацию КТТ.
4.Бобочные процессы должны отсутствовать.
Классификация метода:
1.Меркуриметрия. Основана на образовании растворимых, устойчивых, слабодиссоциированых комплексов (НgHCN). В водных растворах присутствует в виде комплексных соединений. Титрант – Hg(NO3)2, Hg(ClO4)2. Сн=0,5 моль/л. Окончание ведут по изменению окраски индикатора или появления осадка. Сначала раствор готовят приблизительной концентрацией, затем стандартизуют по NaCl в присутствии нитропруссида натрия.
Применение: для определения хлоридов (реже бромиды, йодиды, цианиды).
Достоинства: указанные анионы можно определить в кислой среде, нитрат Hg дешевле нитрата Ag.
Недостатки: соединения Ag ядовиты.
2.Цианометрия. Основана на реакциях образования устойчивых, растворимых цианидных комплексов (Zn, Co, Ni).
3.Фторометрия. Основана на реакциях образования фторидных комплексов.
4.Комплексонометрия. Основана на реакциях образования комплексонатов.
59 Вопрос : Комплексонометрия.Комплексоны.Применение комплексонометрия: Комплексонометрия
Комплексоны – это многоосновные амино-поликарбоновые кислоты и их соли, анионы которых образуют с катионами металлов растворимые устойчивые комплексы (комплексонаты).
Комплексон 1(нитрилотриуксусная кислота) N(CH2COOH)3
Комплексон 2(этилендиаминтетрауксусная кислота (ЭДТУК))
(HOOСCH2)2N-CH2CH2-N(CH2COOH)2.
Комплексон 3, Na2H2Y*2H2O – двунатриевая соль ЭДТУК, а также !!!! ЭДТА (этилендиаминтетраацетат), трилон Б, хелатон III.
Комплексон 4 (диаминциклогексантетрауксусная кислота)
CH2
H2C CH N(CH2COOH)2
H2C CH N(CH2COOH)2
CH2
Катионы щелочных металлов образуют малостойкие комплексонаты, поэтому комплексонометрические их не определяют. Многозарядные катионы образуют стабильные комплексонаты, поэтому их можно определить.
Титрант – раствор ЭДТА, Сн=0,01; 0,05;0,1 моль/л.
60 Вопрос: Индикаторы.Требования к металлохромным индикаторам:Индикаторы:
1.Бесцветные органические вещества (редко), которые образуют с определенными катионами окрашенный комплекс (салициловая кислота).
2.Металлохромные индикаторы – это органические красители, которые обратимо меняют окраску, при образовании комплекса.
Требования:
1.Индикатор должен образовывать прочный, окрашенный, растворимый комплекс.
2.Комплексы катионов с индикатором должны быть менее устойчивыми, чем комплексы с комплексоном.
3.Окраска должна быть четкой.
Известны десятки металлохромных индикаторов:
- эриохром черный Т, для определения: магния, цинка, олова.
- кселеновый оранжевый, используется для определения: меди, железа, кобольта.
- мурексид, для определения: серебра, кальция.
пирокатехиновый фиолетовый, для определения: Al, Fe2+, Fe3+, Co, Ni.
61 Вопрос: Виды комплексонометрического титрования .Кривые титрования .Влияние факторов на скачок титрования. Индикаторные ошибки комплексонометрического титрования.
1.Прямое
2.Обратное
3.Заместительное (описание смотреть ранее в лекции).
37) Кривые титрования. Ошибки титрования. Применение комплексонометрии. Кривые титрования
рМ
Кривые титрования строят, чтобы подобрать индикатор
Vтитранта
рМ= - lg[Mn+] – показатель равновесной концентрации катионов Mn+ в растворе или
рМ – f, где f – степень оттитрованности раствора.
До ТЭ в исходном растворе до начала титрования рМ= - lg[Mn+] = - lgс(х)
В ТЭ все катионы М2- оттитрованы с образование комплекса MY2-
рМ=[pc(x) + lgβ]/2
Часть комплекса MY2- диссоциирует: MY2-=М2+ + Y4-
После ТЭ рМ=pc(x) + lg[β] + lg[Y4-], где [Y4-]= c(T)*v(T) – c(X)*v(X) / v(X) – v(T)
Факторы, влияющие на скачок титрования:
Чем больше скачок на кривой, тем легче фиксировать КТТ.
Протяженность скачка зависит:
1.От устойчивости комплесоната (чем больше константа устойчивости, тем больше величина скачка).
2.От концентрации (чем больше концентрация реагентов, тем протяженнее скачок) – концентрация меньше 10-5 использовать НЕЛЬЗЯ.
3.От рН. Меняя рН можно титровать одни катионы, при этом другие мешать не будут.
Индикаторные ошибки:
Обусловлены не совпадением величины рМ в точке эквивалентности и в КТТ.
Ошибка титрования Х (комплексонометрическое) рассчитывается:
Х= 10-pH*[v(X) + v(T)]*100% / c(X)*v(X)
Применение комплексонометрии:
Для определения катионов металла, для анализа препаратов (лактат), для определения жесткости воды, для определения фосфатов, хроматов.
62 Вопрос: Осадительное титрование :способы титрования:
Осадительное титрование. Требования к реакциям. Классификация методов.
Основано на применении титрантов, образующих с определенным веществом малорастворимые соединения.
Требования к реакциям:
1.Определенное вещество должно растворяться в воде и содержать ион, вступающий в реакцию осаждения с титрантом.
2.Осадок должен выпадать быстро при комнатной температуре.
3.Реакция должна протекать до конца.
4.Без побочных процессов.
Способы титрования:
1.Прямое
2.Обратное
63 Вопрос: Кривые осадительного титрования : Влияние факторов на скачок титрование :
Кривые титрования:
рCl рCl= - lg[Cl-]
Vтитранта
NaCl + AgNO3 AgCl +NaNO3
Расчет рCl для исходного раствора: рCl= - lg[Cl-] = - lg0,1=1
Раствор рCl до ТЭ: [Cl-]= C(x)*V(x) –C(T)*V(T) / V(x) + V(T), затем рCl= - lg[Cl-]
Растворы в ТЭ все Cl- оттитрованы, т.к [Cl-]=[Ag+]
[Cl-]= K0s(AgCl) , затем рCl= - lg[Cl-].
Рассчет рCl после ТЭ: С(Cl-) определяется избытком ионов Ag+
K0s(-lgCl) = [Ag+][Cl-]
C(Cl-)= K0s(AgCl) / C[Ag+]
[Ag+] = C(T)*V(T) –C(X)*V(X) / V(x) + V(T), затем рAg, pCl.
Различия между рассчитанной и реальной кривой незначительны.
Факторы, влияющие на скачок:
1.Концентрация (не должны быть очень маленькими и очень большими).
2.Растворимость осадка – чем меньше растворимость, тем протяженнее скачок.
3.Температура, титрование проводят при комнатной температуре.
64 Вопрос: Индикаторы метода.Условия применения адсорбционных индикаторов.Механизм адсорбционных индикаторов: Индикаторы метода:
1.Осадительные – осаждают определенное вещество в виде осадка (K2CrO4).
2.Металлохромные – образуют с титрантом окрашенные комплексы.
Например, железоаммонийные квасцы.
3.Адсорбционные. Адсорбция и десорбция этих индикаторов при титровании сопровождается изменением окраски.
Например: эозин, флуоресцеин.
Механизм действия адсорбционных индикаторов
Ag+ + Cl- AgCl
HIhd H+ + Ihd-
До ТЭ в растворе неоттитрованные Сl-, которые адсорбируются на поверхности AgCl. В результате чего поверхность AgCl заряжается отрицательно. Отрицательный заряд препятствует адсорбции анионов Ihd-, которые останутся в растворе.
После ТЭ в растворе избыток Ag+, которые адсорбируются на поверхности осадка (положительный заряд) и вследствие чего будут адсорбироваться анионы Ihd-
и происходит окрашивание. Таким образом, после ТЭ произошло изменение цвета (из желтого в красный).
Условия применения адсорбционных индикаторов:
1.Концентрация.
2.Чем больше поверхность осадка, тем отчетливее изменение цвета индикатора (избегать больших концентраций)
3.Скорость титрования (вблизи ТЭ титруют медленнее)
4.Кислотность: - для иозина от 2 до 10
- флуоресцеин от 6 до 10
5.Титрование проводят в рассеянном свете (так как возможно фотохимическое разложение соединений Ag.
Ряд адсорбционной способности анионов
при рН=7 на поверхности AgCl
J>CN>SCN>Br>анион эозина>Cl->анион
Флуоресцеина> NO3-,ClO4-
Каждый предшествующий анион ряда адсорбируется на поверхности осадка AgCl раньше предыдущего аниона.
65 Вопрос: Классификация методов осадительного титрования.Разновидность аргентометрии: Аргентометрия-метод, основанный на использовании в качестве осадителя AgNo3
Ag+ + A- AgA(cтрелка вниз) (A=Cl-,I-,Br-,SCN-)
Титрант р-р AgNo3 См=0,01 или 0,1
Титрант гоовят приблизительной концентрации ,затем стандартизуют его KCl в присутствии K2CrO4,хранят в темном мечте(темной склянке)
Разновидности аргентометрии
1)Метод Гей-Люссака-титрование галогенид-ионов р-ром AgNO3 без индикаторов.Окончание титровани фиксируют по прекращению образования осадка и просветлению р-ра.Метод продолжителен,требет навыка.Используется редко.(1832г)
2)Метод Мора(1856г)-определение галогенид-ионов кривыми титрования AgNO3 в присутствии K2CrO4.
Определению мешает Pb2+, Bi2+,Ba2+),которые образуют осадок с CrO4-/
Используется для определения Сl,Br в слабощелочной и нейтральной среде.(Ag2CrO4 растворяется в кислотах. I- определить нельзя, т.к.происходит его соосаждение Ag+.
3)Метод Фаянса(Фишера и Хоранова)1923 г.-определение галогнид-ионов р-ром AgNO3 в присутствии адсорбционных индикаторов(эозин,флюросцеин)
4)Метод Фольгарда(1870г.)-обраимое титрование избытка Ag+ раствором NH4SCN. KSCN -родонид в присутствии железоаммонийных квасцов.(индикатор).
Метод проводят в сильнокислой среде , определяют Cl-,CO32-,S-,C2O42- -оксалат.
66 Вопрос : Индикаторные ошибки осадительного титрования :
67 Вопрос : Кислотно-основное титрование в неводных средах.Растворители неводного титрования.:
Кислотно-основное титрование-это титрование,при котором средой служит неводный растворитель(минимум воды).
Ограничения титрования в водной среде:
1)В водных растворах слабые основания и кислоты не тируются(отсутствует скачок).
2)Если в растворе есть смесь кислот, у которых разница в pK< 4, то их раздельно определить нельзя.
3)Сильные кислоты(основания), присутствующие в растворе,отдельно не титруются.
4)Многие вещества незначительно растворяются в воде, но хорошо в других растворителях.
В качестве неводных растворителей используют: ацетон, муравьиная и уксусная кислота, метанол.
Классификация растворителей неводного титрования.
По способности отделить или присоединить протоны, растворители делят:
1)Апротонные-не проявляют кислотно-основных свойств,мало влияют на свойства растворимых в них веществ.(бензол,толуол)
2)Протонные-обладают кислотно-основными совйствами,(жидкий аммиак,безводная уксусная кислота).
а)Протогенные-Преобладает способность отдавать протоны(безводн.муравьиная,уксусная кислоты),такие растворители повышают силу растворимых в них оснований и понижаюи силу растворимых в них кислот.(например:HNO3,HCl,в водном растворе сильные,а в ледяной уксусной кислоте-слабые)
б)Протофильные-преобладает способность принимать протоны(жидкий NH3,амины)Эти растворители понижают силу растворенных в них оснований и повышают силу растворенных в них кислот.(нарпимер уксусная кислота в водной растворе слабая, в жидком аммиаке-сильная).
в)Нейтральные растворители-обладают приблизительно одинаковой способностью принимать и отдавать протоны(метанол,этанол,ацетон).
2)Амфипротные-растворители,обладающие способностьюотдавать и принимать протоны.
Они подвергаются автопротеолизу:
SH+SHSH2++S-
SH-молекула растворителя(условно)
KSH=[SH2+][S-]/[SH]2
[SH2+]-лионий
[S-] -лиат
KsH=константа автопротеолиза-произведение равновесных концентраций ионов лиония и лиола в чистом растворителе.она зависит от природы растворителя и температуры.
Для воды KSH –ионоое произведение воды.
KB=[H3O+][OH-]
Ka=aSH2+aА/aHA
KB=aSH+aS/aB
Cила кислотности увеличивается при растворении в более основной растворителе, а сила основности-в более кислотном растворителе.
Между константими одной существует зависимость:
KSH=Ka*Kb
Если водный раствор,седа нейтральная,pH=7,а в этаноле(неводный)=9,5
Серная кислота=1,81;метанол=8,35;этанол=9,55
Для неаодных растворителей вводят величину pSH2+=-lg[SH+]
68 Вопрос: Ниветирующее и дифференцирующее действие растворителей:
Нивелирующее действие растворителей-проявляется в выравнивании силы растворимы в нем(растворителе)веществ.
Например:HCl в водной растворе сильная, CH3COOH-слабая
В растворе NH3 обе кислоты сильные,
KOH в водном растворе сильная, NH3 в водном растворе слабое основание,а в водном H2SO4 оба основания сильные.
Дифференцирующее действие растворителей-проявляется в увеличении различий в силе растворимых в нем веществ(электролитов,протлитов и др).
Такие растворители используют для раздельного титрования смеси кислот и оснований.
Например: HClO4 в водном растворе сильная, в безводном CH4COOH –слабая.
Сила кислот в безводном CH3COOH
HClO4 HBr H2SO4 Hcl HNO3
Наиб.сильная сила кислот усиливается наиболее слабая
69 вопрос: Выбор протолитического растворителя .Титрант метода .Определение конца титрования:\
Выбор протеолитического растворителя
1)Чем меньше KSH,тем выше полнота протекания реакции
2)Определяемое вещество должно хорошо растворяться вданном растворителе.
3)Для титрования иснований используют протогенные растворители.Для титрования кислот-протофильные.
4)Растворитель не должен вступать в побочные процессы
5)Растворители должны быть нетоксичными, дешевыми,доступными.
Титранты
При титровании оснований в кслых растворителях(муравьиная кислота,уксусная кислота), в качестве титранта используют HClO4 в ьезводном CH3COOH в концентрации 0,1 Cм.
При титровании кислот в основных растворителя(бутиламин,этилендиамин),в в качестве титрантов используют KOH,NaOH,метилат лития в метаноле)
Титранты хранят в осудах с поглотительными трубками.
Определение конца титрования
-используется либо индикаторный метод, либо потенциометрическое титрование.
При титровании веществ основного характера в кислых растворителях используют: судан(III),тропиолин 00,кристаллический фиолетовый.
(Для определениядимедрола ,кофеина,папаверина,кокаина).
При титровании веществ кислотного характера в основных растворителях используют:бромтимоловый синий, тимолфталеин.
70 Вопрос : Инструментальные методы анализа. Классификация методов:
Инструментальные методы основаны на зависимости между измеряемыми свойствами веществ и их качественным и количественным составом.
Классификация:
Оптические методы
Хроматографические
Электрохимические
Радиометрические — основаны на измерении рабиоактивных веществ
Термические — измерение тепловых эффектов
Ультразвуковые
Масс-спектрометрические
Достоинства методов.
Низкий предел обнаружения до 10-9 мкг, предельная концентрация 10-12 г/мл.
Высокая чувствительность
Малая продолжительность анализа
Возможность компьютеризации
Недостатки
Иногда воспроизводимость результатов хуже, чем в титрометрии или гравиметрии
Погрешность определения до 5%, иногда до 20%
Высокая стоимость аппаратуры.
71 Вопрос : Оптические методы. Классификация. Закон светопоглощения.
Оптические методы основаны на измерении оптических свойств вещества
Поглащение, отражение, преломление, рассеяние света, поляризация.
Классификация
по изучаемым объектам
атомно-спектральный анализ
молекулярно-спектральный анализ
2. по характеру взаимодействия электро-магнитного излучения
атомно-абсорбционный анализ
Спектральный анализ — измеряет интенсивность света
пламенная фотометрия
молекулярный абсорбционный анализ
люминесцентный анализ
нефелометрический анализ
турбидиметрический анализ
рефракто-метрический анализ — измеряет показатель светопреломления
поляриметрический
ядерномагнитный резонанс ЯМР
Электронный парамагнитный резонанс ЭПР
3. по области использованного электро-магнитного спектра
спектроскопия в ближней и уф-области спектра 200-400 нм, и в видимой области 400-600 нм.
ИК спектроскопия
рентгеновская спектроскопия
микроволновая спектроскопия
4. По природе энергетических переходов
электронные спектры — возникают при изменении энергии эл. Состояний
колебательные спектры — охватывают ИК и спектры комбинационального рассеивания света. Возникает при изменении энергии колебательных состояний 2х многоатомных ионов, радикалов, молекул.
Вращательные — охватывают дальний ИК область и микроволнов. Возникают при измерении энергии вращении молекул, ионов, радикалов.
Закон Бугера-Ламберта-Беера.
поглощение света пропорционально числу молекул вещества, через которое проходит пучок излучения
72 Вопрос: Электронные спектры поглощения.
Спектры поглащения вещества видимой области 400-700 нм, а так же его цвет, воспринимаемый глазом связанный между собой. Отдельные узкие участки спектра дают цветовые ощущения 7 основных и множества оттенков. Фазы вещевтва избирательно соглащающих свет опред. «γ » поэтому спектр состав. сета прошедшего через разные прозрачные вещества будут неодинаковы. Это воспринимается глазом как различия в окраске.
При поглощении энергии электро-магнитное излучение атомы, молекулы или ионы увеличивают всою энергию, т. е. Переходят в более высоколежащее энергетическое состояние. Для каждой частицы существует индивидуальный набор энергетических уравнений.
Самый низший уровень — основной. Все остальные — возбужденные. Переход части электронов с основного уровня на 1 возбужденный называется осн-ои уравнением, все атомы — составные.
Энергетические переходы возможны ток. Сист. Опред-ми уравнениями. Это определяется правилами отбора.
Электроны энергетического уровня молекул и многоатомных ионов им. Колебат. Подур.
Каждый электронный переход с нижнего уровня на более высоколежащий отв-т полоса в эл. спектре поглащения.
Интенсивность этой полосы поглащения зависит от «с» светопоглащения частиц, а так же от вер-ти и перехода из одного электронного состояния в другое. Чем больше вероятность перехода, тем больше ε поглащения и интенсивность полосы.
Электроны в молекуле или ионе находятся на молекулярных орбиталях: связывающих, несвязывающих, разрыхляющих.
Любая система самопроизвольно стремится к минимальной энергии, поэтому в основном состоянии электрон занимает низколежащую орбиту, затем — высоколежащую.
Низволежащей является сигма-связывающая орбиталь, затем Пи-связи. Далее несвязыв-ие [п] , П-разрых. и τ-разрых. Переходы сигма-связей на сигма возбужденая разрых. Требует наибольшей энергии, величина которой соответствует энергии дальней уф-области.
Поэтому вещества, им. Ток. Сигма-связей не поглащают свет в ближнем уф и дальней области — вещества бесцветны.
Переходы с «n” на возбужденную сигма-разррыхленную характерны для соелинения им свободной электронной пары. Требуют больше энергии, которая соответствует ближней уф-области.
Переходы с П на п-разрыхленный возбужденый требует меньше затрат энергии.
Энергия так переходит соответственно ближний уф и водимого спектра
Смещеные в спектре полосы в коротковолновое ст. называется гипсохромным смещением. Полосы смещения в длинноволновой области называются батохромным смещением.
73 Вопрос :Абсорбционный анализ. Колометрия. Фотоколориметрия, Спектрофотометрия. Приемы спектрофотометрии.
К методам анализа относятся:
колориметрия
фотоколориметрия
спектрофотометрия
Основан на визуальном сравнении окраски жидкости. При проведении измерений используют фотометры и колориметры.
Методы используют для определения окраски жидкостей.ю примесей тяжелых Ме, гемоглобина, определение рН растворов по окраске индикаторов.
Методы колориметрии:
1) метод стандартных серий
В одинаковых колориметрических пробирках готовят серию из 10 стандартных растворов, с постепенно увеличивающийся концентрации вещества. Интенсивность окраски анализируемого раствора д.б. промежуточной между растворами с меньшей и большей концентрацией.
Если интенсивность окраски анализируемого раствора совпадает с окраской одного из стандартных растворов, то делают вывод о приблизительном равенстве концентраций этих растворов.
Достоинства:
простота выполнения
не требуется сложная аппаратура
Недостатки:
большая ошибка определения до 10%
используется для приблизительной оценки концентрации
2) метод уравнивания окраски
осуществляется разными способами:
а) интенсивность окраски анализируемого раствора визуально уравнив с интенсивностью окраски раствора сравнения, который содержит так же компонент, но без определенного вещества.
К раствору сравнения добавляют известное количество определенного вещества до тех пор, пока интенсивность окраски раствора сравнения становится равной интенсивности окраски анализируемого раствора.
Зная количество определенного вещества, введенного в раствор сравнения, находится концентрация определяемого вещества в анализируемом растворе.
б) Измеряя толщину поглощающего слоя анализируемого и стандартного раствора до совпадения интенсивности окраски — необходимо выполнение закона светопоглощения
в) Интенсивность светопоглощения можно проводить с помощью фотометров, где уравнивание окраски осуществляется путем перекрывания части светового потока
Недостаток: ошибка определения до 10%
3) Метод разбавления
Сводится к выравниванию интенсивности окраски стандарта и анализируемого раствора путем разбавления р-сия
ошибка определеия до 10%
Фотоколометрия
Основана на измерении интенсивности светового потока, прошедшего через анализируемый раствор с помощью фотоэлектронов в фотоколориметрах и в фотоэлектроколориметрах.
Чем больше светопоглащение анализируемого раствора, тем меньше энергия светового потока, попадающего на фотоэлемент.
Светофильтры — стекла разного состава и окраски, пропускающие излучение шириной 20-50 нм.
Концентрация определяеного вещества в анализируемом растворе находят, используя закон светопоглащения, либо методом градуировочного графика.
Достоинства: метод обладает высокой чувствительностью, селективностью; простота выполнения измерения оптической плотности; не сложность аппаратуры.
Недостатки: ошибка определения до 3%.
Используют: при анализе лекарственных средств — новокаин, стрептомицин.
Спектрофотометрия
Основана на использовании спектрофотометров, регулирующих световые потоки 180-1100 нм.
Используются два вида спектрофотометров, работающи по однолючевой и двулучевой схеме.
В качестве источника излучения используются лампы накаливания для работы в видимой области, дейтериевые для работы в уф области.
При работе в видимой и ближней ИК области используют стеклянные линзы, призмы, кюветы.
При работе в уф области исполюзуют кварцевую оптику, т. к. стекло поглащает уф лучи
Достоинства: обладает большой точностью и чувствительностью, чем фотоколометрия; можно проводить анализ многокомпонентной смеси без разделения; широкий спектральный диапозон
Недостатки: ошибка не более 2%
Приемы спектрофотометрии
1. прямая
2. дифференциальная
3. производная
4. спектрофотометрическое титрование
Концентрация определяемого вещества находят с использованием закона светопоглощения, либо методом градуировочного графика.
74 Вопрос :Количественный фотометрический анализ. Нахождение концентрации вещества
Для получения оптимальных результатов проводят а фото метрическую реакции а затем подбирают:
1. Длину волны при которой проводят фотометрические измерения
2. концентрацию раствора и толщину поглощающего слоя
Подбирают чтобы оптическая плотность была около 0,2 - 0,6
d=0,4 l=1 c= - 0,4/E
При такой концентрации отклонения от основного закона светjпоглощения не наблюдается
3. раствор сравнения должен представляет собой либо чистый растворить, либо растворитель с добавлением всех компонентов, содержащихся в растворе без определяемого вещества.
Все остальные измерения проводят по отношению к раствору сравнения.
Все измерения проводит сразу после приготовления растворов и быстро, т.к.кюветы могут нагреваться, что искажает результаты.
Нахождения концентрации вещества
1. метод градуировочного графика
по результатам измерения оптической плотности измеряют 5-6 эталонных растворов с разной, но точно известной концентрацией. Строят графики в координатах d от c, затем измеряют оптическую плотность анализируемого раствора в тех же условиях и по найденным значениям d находят концентрацию измеряемого вещества
2. метод стандарта
используют, когда выполняется закон светопоглощения
готовят стандарт, измеряют его оптическую плотность. Затем в той же кювете, в тех же условиях измеряют оптическую плотность анализируемого раствора с неизвестной концентрации вещества
3. определение концентрации по малярному или удельному коэффициенту поглощения.
должен выполняться закон цветопоглощения
Значение малярного или удельного коэффициента поглощения должно быть известно
4. метод добавок к стандартам
закон светопоглощения выполняется
Готовят 2 раствора
1)анализируемый раствор с неизвестной концентрации
2) анализируемый раствор к которому добавили точно известное количество определяемого вещества
Затем измеряют оптическую плотность 1ого и 2ого раствора в одной и той же кювете.
Концентрацию определяемого вещества расчитывают по формуле.
75 Вопрос : Чувствительность и погрешности фотометрического анализа. Понятие о фотометрическом титровании.
Чувствительность характеризуются минимальной концентрации определяемого вещества.
Ошибки анализа зависит от:
1) не точности определения d
2) неправильной установке кювет
3) неправильной фиксации нуля на шкале
4) нестабильность рабочего прибора
Понятие о фотометрическом титровании метод основан на определении конца титрования по резкому изменению светопоглощания титруемого раствора в точке эквивалентности или вблизи ее. титрование проводят последовательно измеряя светопоглощение титруемого раствора при добавлении к нему тетранта. В результате измерения светопоглощения строят кривую титрование в координатах d от V. Конец титрования находят экстраполяцией линейного участка на кривой титрования . Точка пересечения прямых отвечает концу титрования.
достоинства: обладает большой селективностью, чувствительностью, точностью; можно использовать реакции с небольшими константами равновесия
используют: при фотометрическом титровании перманганат ионов
Атомно абсорбционной анализ
Метод основан на селективном поглощении электромагнитных излучений определенной длины волны нейтральными атомами. Спектральной линии поглощения атомов впервые были обнаружены в начале 19 века при изучении спектра солнца Волластоном. Связь между видами спектров атомного поглощения и испускания и химического состояния была установлена в середине 19 века Бунзеном и Кирхгофом. с этого момента спектроиспускание атомов стали испускаться в качественном и количественном определении. Спектры поглощения (абсорбции) атомов в аналитических целях стали применяться с 30 годов 20 века для идентификации эл. в атмосфере звезд.
В 1962 году выпущен атомно-абсорбционный спектрометр
Достоинства: предел обнаружения 10 - 14 грамм, по скорости выполнения анализа превосходит тетрометрические и электрохимические методы.
можно определять элементы в одном растворе. процесс полностью автоматизирован
недостатки: необходимость перевода вещества в раствор, на каждый элемент нужно иметь отдельный источник излучения; высокая стоимость
Для проведения атомно абсорбционного анализа:
1) проводят пробу — отбор
2) от твердой пробы отбирают определеную навеску, растворяют подходящим растворителем
от жидкой пробы отбирают аликвоту и приготавливают раствор для анализа
3) готовят серию рабочих градуировочных растворов
4) подготавливают к работе спектрометр, в оптимальных условиях адсорбция исследуют эл.
5)анализируемое вещество вводят в атомизатор
6) последовательно вводят в атомизатор градуировочные растворы и получают зависимость между аналитическим сигналом и концентрацией эл. в градуировочном растворе
7) определяют концентрацию элемента в исходной пробе
Атомизатор
Источник высокой температуры для перевода определенного вещества в пар Существует 2 метода атомизации:
1.пламенный
2.электротермический
в пламенной атомизации источником температуры является пламя.
Атомизатор представляет собой горелку, в которую подают горючие газы:
1) светильный газ — воздух
2)ацетилена — воздух
3) ацетилен — закиси азота
метод электротермической атомизацией был разработан Львовым в 50 годах 20 века Сконструировал не пламенный авто — графитовая Печь, нагревается электрическим током.
применение. метод позволяет определить около 70 элементов периодической системы в основном металла
этим методом определяют сплавы, продукты переработки руды, используют в клинических и биологических анализах
76 Вопрос : Люминесцентный анализ. Классификация.
Люминесцентный анализ основан на явления люминесценции.
Люминисценция —Это свечение вещества, возникающее при его возбуждение разными источниками энергии.
Достоинства: предел обнаружения 10- 8% Метод позволяет определить 10 - 12 до 10 - 15 грамм/литр вещества
недостатки: погрешность определения до 5 или даже 10%
Классификация
1)по способу возбуждения выделяют
• фотолюминесценция — свечение вещества под действием излучения в уф и видимой области
•хемилюминесценция — свечение вещества за счет энергии химических реакций
•рентгенолюминесценция — свечение вещества под действием рентгеновских лучей
•катодолюминисценция — свечение вещества при бомбардировке его потоком электронов
•Термолюминесценция — свечение вещества при его нагревании
•сонолюминесценция — под действием ультразвука
•триболюминисценция — под действием механизма возбуждения
• радиолюминесценция — радиоактивное возбуждение
2)по длительности после свечения
° Флуоресценция — сечение которое прекращается сразу после прекращения действия источника возбуждения
° фосфоресценции — свечение которое некоторое время продолжается после прекращения действия возбуждения
77 Вопрос : Флуоресцентный анализ. Характеристики люминесценции. Закон Стокса-Ломмеля. Правило зеркальной симметрии Левшина. Закон Вавилова.
Основан на использовании флюоресценции определенного вещества, возбужденного энергией в УФ и видимой области.
При обычной температуре молекулы и ионы находятся в невозбужденном состоянии.
При поглощении частицей кванта элекромагнитной энергии она повышает свою энергию и переходит в верхнее электроколебательное состояние.
Время жизни возбужденого состояния мало, частица быстро теряет поглощенную энергию.
Возвращение молекулы в невозбужденное состояние происходит по-разному:
1. Возбужденная частица излучает всю поглощенную энергию в виде кванта и возвращается в основное состояние
2. Молекула теряет часть поглощенной энергии в виде теплоты в результате столкновений с другими частицами
Энергия люминесценции меньше энергии поглощенного излучения. Вещества, поглощающие уф свет, люминесцируют в видимой области.
Характеристики люминесценции:
1) спектр люминесценции
Это распределение интенсивности излучения по длине волны или частотам.
Спектр люминесценции веществ связан со спектрами поглощений и подсинен законам
Закон Стокса-Ломмеля
Спектр люминесценции смещен в сторону большей длинны волны по ср-ию со спектром поглощения того же вещества.
Правило зеркальной симметрии Левшина:
спектр поглощения и люминесценции приблизительно зеркально симметричны относительно прямой, проходящей перпендикулярно этих спектров. Это правило выполняется для молекул, имеющих один. стр-ру колебательных подуровней основного и возбужденного состояния. Расстояние между положительными max-в в спектре поглощении и люминесценции называют Стоксовым смеженцем.
Чем больше величина Стоксивого смежения, тем лучше можно разделить световые потоки при регистрации спектров и лучше определить люминесцирующие вещества.
2) Энергетический выход люминесценции
Это отношение энергии люминесценции к энергии поглощения света. Образует поглощение энергии в энергию люминесцирующие излучение.
3)Квантовый выход
Это отношение числа излученых квантов люминесценции к числу квантов поглощенного излучения.
Закон Вавилова:
Квантовый выход постоянен, если γ возбуждающегося света меньше λ люминесценции.
Из этого закона следует, что в определенном спектральном диапазоне спектр люминесценциине зависит от того, каким участком спектра возбуждается люминесценция.
Лучше всего вызывает люминесценцию уф излучение — больше стоксового смещения.
78 Вопрос: Количественный флюоресцентный анализ. Условия проведения анализа.
Количественный люминесцентный анализ основан на использовании пропорциональной зависимости между интенсивностью люминесценции и концентрации определяемого вещества.
Зависимость выполняется, если справедлив закон Вавилова.
Условия проведения анализа
1. Квантовый выход должен быть постоянным. Чем больше разница между λабс. и λлм, тем больше стоксово смещение.
2. раствор должен быть разбавлен. Если концентрация высокая, то в начале растет Iлм, потом резко падает и квантовый выход снижается. Концентрационное тушение - уменьшаюшие Iлм при увеличение концентрации.
3. не должно быть посторонних веществ. При их наличии может происходить ослабление, усиление и тушение люминесценции. Усиление люминесценции - присутствие растворенного кислорода. Растворы, которые используются при проведении анализа д.б.особой чистоты.
4. температура во время проведения анализа д.б. постоянной, так как при повышении Температуры Происходит тушение люминесценции
5. если вещество не обладает собственной люминесценцией, то можно проводить люминесценцию р-ию, прот. р-ия будут сопровождаться возникновением, исчезновением люминесценции, либо изменением ее цвета./Для проведения анализа используют спец. фото-электро флуориметры.
Все измерения проводят быстро, для избежания нагревания раствора.
79 Вопрос - Методы определения концентрации. Титрование с помощью флуоресцентных индикаторов. Применение флуоресцентного анализа.
1. метод градуировочного графика
готовят 5-6 эталонных растворов вещества с постепенно возрастающей концентрацией. Если необходимо,проводят люминесцентную реакцию измеряют Iлм каждого такого раствора и по полученным данным строят график I от с.
Затем измеряют I люминесценции анализируемого раствора и по графику находят концентрацию.
2. метод одного стандарта — выполняется закон Вавилова.
Готовят стандартный раствор определяемого вещества, который близок к концентрации этого же вещества в анализируемом растворе.
В одинаковых условиях измеряют Iлм стандартного и анализируемого раствора и в соответствии с законом Вавилова расчитывают концентрацию вещества.
Титрование с помощью флуоресцентных индикаторов.
При титровании за его ходом следят по люминесценции титруемого раствора, либо визуально, либо фотометрически. При этом титруемый раствор облучают Hg-лампой. При фотометрическом способе наблюдении за ходом титрования вычерчивают кривую в координатах показания прибора от прибавленного объема титранта.
КТТ находит экстраполяцией по пересечению линейных участков кривой в области измерений ее наклонной.
Флюорисцентные индикаторы раствора - о.в. которого при возбуждении лучами соответствуют λ изменяют люминесценцию в точке эквивалентности или вблизи ее. Титруют всегда в темноте при освеж. титр. раствора, в который добавлен индикатор с помощью источника излучения.
Применение: с помощью данного метода определяют катионы металлов после перевода их в комплексные соединения. Метод используется для контроля лекарственных веществ: фолиевой кислоты, хинин, тиамин.
80. Вопрос : Рефрактометрия. Методы нахождения концентрации. Применение.
Дифрактометр e основаны на измерении показателя преломления. 1 из старейших оптических методов, основу которого заложили Ньютон, Ломоносов, Эйпер.
В 1869 году Аббат Юрист Сконструировал 1 рефрактометр .
Рефракция это явление преломления луча света на границе раздела 2 сред которые отличаются по оптической плотности друг от друга.
Преломление света 2 сред — изменение направления преломления и скорость распространения светового луча. Если луч проходит из среды с меньшим преломлением в среду с большей пригласительной способностью, то угол наблюдениям больше угла преломления.
При прохождении света из более плотные среды в менее плотную угол преломления Больше падения света.
В разных средах свет распространяется с разной скоростью.
Изменение скорости распространения приводит к преломлению света при переходе из 1 среды в другую.
Скорость света в воздухе и вакууме а 300000 км в секунду в воде 225000 км в секунду.
Чтобы найти абсолютный показатель преломления нужно найти отношений скоростью света в вакууме к скорости света в воде.
Для жидких и твердых веществ определяет показатели преломления относительно воздуха.
Отношений показателя преломления это отношение скорости света в воздухе к скорости света в данной среде.
n — безразмерная величина показывающего сколько раз скорость света в среде 1 меньше скорости света в среде 2 .
Девчата метрических таблицах для жидкостей и твердых веществ приводит значение n относительной.
На практике показатель преломления определяет и длине волны для лямда= 589,3 нм соответствует положение д линии спектре излучения натрия в натриевых лампах.
По n вещества Судят об их природе частоте количество в растворе на эту величину влияют
1. >плотность , тем >n
2. Чем >длина волны, тем <n
3. температура, чем>t, тем <n
4. концентрация, чем >конц., тем >n
Достоинства: простота выполнения, минимальное количество просьбой, быстрота выполнения.
Недостатки: невысокая точность, чувствительность используется при Анализе в области больших концентраций больше 1%
Может быть использована для анализа индивидуальном вещества или смеси 2-3 компонентов.
Методы нахождения концентрации
1. метод градуировочного графика
Строят график по раствором вещества с известной концентрации (n от с) измеряют n анализируем в растворе и на графике по показателю определяют концентрацию.
2. По Рефрактометрическим таблицам (n от массовой доли) для многих веществ есть таблицы.
3. Метод стандартов.
Если известен геометрический фактор то концентрации вещества рассчитывают по формуле.
Также фактор может найти по таблице.
4. Метод добавок.
Сначала определяет показатель преломления Исследуемого раствора затем добавляет определенный объем стандартного раствора и каждый раз определяют n.
Применение: для исследования пищевых продуктов, определение солености, влажности меда, спирта, парфюмерия, косметика, Качество антифризов , Белка в крови, Подлинности лекарственных веществ, используют в качественном анализе.
81 Вопрос :Поляриметрия. Применение.
Поляриметрия это метод основанный на способность веществ поворачивать плотность поляризации после прохождения Через них плоско поляризованного Света.
Цвет называется неполяризованным если в нем отсутствует какая либо ориентированность колебаний то есть они совершаются ко всем направлениям сразу. Если Световых волн совершаются в 1 определенной плоскости Такой свет называется поляризованным.
Плоскость в которой совершаются колебания поляризованной световой волны называются плоскостью колебаний, а плоскость перпендикулярна и и плоскостью поляризации.
Поляризация — возникновение направленности.
Впервые понятие о приватизации введено в оптику Ньютоном в начале 18 века
Оптическая активность вызывает вращение плоскости поляризованного света а вещества обладающие этим свойством называется оптически активными к ним относятся аминокислоты белки антибиотики лекарственные препараты
Физик Николь Приобрел устройство поляризатор для получения поляризованного света "призмоликоль".
ВЗависимости от природы оптически Активного вещества вращения плоскости поляризации имеет разное направление и величину.
Если свет проходящей через оптический активное вещество а вращается плоскость поляризации по часовой стрелке а то это право вращающие вещества (+) и аналогично слева вращающим( -)
Когда поляризованный луч света пропускают через оптический теме вячеслав плоскость поляризации изменяется, поворачиваясь на определенный угол. Это угол вращения плоскости поляризации определяется с помощью приборов поляриметров.
Основные части поляриметра: Поляризатор источник лучей и анализатор для иследования лучей.
Луч света от лампы переходе через поляризатор для получения определенной ориентации плоскости поляризации поляризуемый луч проходит через исследуемый образец который находится между поляризатором и анализатором.
Если образец оптический активен его плоскость поляризации по раньше выехать затем изменяется а луч попадает в анализатор. Чтобы луч света прошел Анализатор его поворачивать на такой угол, которые соответствуют величине угла вращения плоскости поляризации исследуемого образца.
Этот угол зависит от природы вещества и растворителя толщины слоя температуры длины волны и концентрации.
Зная величину угла вращения оптически активного вещества находит его концентрацию По графику.
Толщина слоя 1 дециметр температура равна 20° по цельсию угол равен 589,3 нм; с в гр на 100мл.
Применение биологической активности (-) вращении изомеров чем сильнее (+) вращающих.
Проверка чистоты определяется концентрацией активность препаратов, определенных содержание сахарозы, определяет качество натурального масла. Определяют качество духов: (-) Вращающий более сильный аромат, определяю чистоту лактозы. определяют наркотические вещества.
82 Вопрос : Инфракрасная спектроскопия. Использование ик-спектров. Природа ик-спектров поглощения.
Инфракрасная спектроскопия изучает спектры поглощения, отражение электромагнитного излучения в диапазоне длин волн от 1 до 1000 мкм.
ИК было открыто в 1800 году английским ученым Генгелем. Он обнаружил, что в полученном Им С помощью призмы спектре солнца за границей красного повышается температура. Было доказано, что излучения в этой области подчинено законам оптики а следовательно имеет ту же природу что и свет.
Конце 19 века Были записаны ик спектры более 50 соединении с поставленной наблюдении полосы поглощения из функциональными Группами которые присутствовали в этих молекулах.
1903 году кобленц Использовал призму из натрий хлор и получил ик спектре Для органических и неорганических соединений.
В 1923 году глаголева аркадьева получила радиоволн и с длиной волны около 80 микро метров располагающихся в инфракрасном диапазоне.
Все это доказывает что ик излучения и родя волны эта разновидность электромагнитных волн
Использование ик спектров. По имеющимся полосам спектры По имеющимся полосам спектра неизвестного вещества судят о его структуре.
По наличию лишних Полос в спектре, известные соединения судят о частоте этого вещества
По виду спектра можно идентифицировать вещество. ( Есть библиотека эталонных спектров)
ИКС Длину волны измеряется в микронах .
Если вещество он получить ик спектром разной частоты, то оно будет поглощать кванты энергия тех частот а, которой характерны для имеющихся в веществе структурных фрагментах.
ИКС — Кривая с большим числом максимумов и минимумов, каждое вещество имеет свой индивидуальный ик спектр поглощения.
Иногда Ик спектры поглощения называют отпечатками пальцев данного вещества. Положение максимума в спектре молекулы, их по полу ширина, интенсивность зависит от масс Влияющих Его атома, межатомных сил и геометрического строения.
Природы ик спектров поглощения.
Атомы и однотонные ионы не дают ик Спектров
Молекулы и ионы обладают
1 поступательный энергия это энергия движения молекул в пространстве
2 Электронный энергия энергия электронов в атоме составляющих молекулу
3 колебательной энергии. Энергия колебательном движении ядер, атомов
4 вращательные энергии этой энергии вращательного движения молекул в пространстве.
Колебательное движение ядер, приводящей к изменению длины связи называется валентными колебаниями.
Колебательное движение, приводящей к изменению углов между связями называется деформациоными колебаниями.
Энергия деформации колебания меньше энергии валентных колебаний Формационные колебания наблюдаются при больших длинах волн. Колебания многоатомных молекул, и он являются Смешанными Валентно — деформационными.
83 Вопрос : Спектрофотометры. Подготовка образцов для снятия ик-спектров. Конечная идентификация. Применение.
Для регистрации спектров используют
1. Классический спектрофотометр
Достоинства: дешевизна, не сложность Конструкции
Недостатки: Сложность регистрации слабых сигналов, невысокая разрешающая способность, длительной регистрации спектра несколько минут
2. Фурьеспектрометры
Достоинства работать в широком диапазоне длинны волны, быстрая регистрация спектров несколько секунд, Высокая разрешающая способность.
Недостатки: высокая стоимость, Сложность обслуживания.
Подготовка образца для снятия ик спектра Ик спектры можно измерять для жидких, твердым, газообразных веществ для Записи спектров разных фаз используют разные методики.
Для твердых веществ
1. Метод прессования с инертными наполнителями
В качестве инертного наполнителя используют безводный спектральный чистые кристаллы калия брома или кристаллы калия хлора
Использует прессование с полиэтиленом
Достоинства Калия бром: Не имеет собственного полос поглощения веществ в области от 1 до 1000 мкм. Пластичен при прессовании. Легко обезвоживается. Химически инертен.
При проведении анализа навес к исследуемого образца 1-2 микро грамм Растирают в ступке с калиброванным От 100 До 400 микрограмм
Затем эту смесь прессуют вакууме под давлением, получают прессованные таблетку а диаметром 10 мм. Записывает ик спектр поглощения таблетки помещая в канала сравнение Аналогичную таблетку из чистого калия бром.
2. Метод растираний образца с Ферментными жидкостями вазелин или масло .
Навесками лицензируемого образца от 5 до 15 микрограмм смешивают с минимальным количеством индифферентный их жидкостей 2-3 капли и растирают
Получившуюся массу а палочкой наносят в виде полос на пластинку из чистого калия бром и прижимают ее другой такой же пластинкой
Недостатки часто наблюдается уменьшение светопоглащения За счет рассеивания света .
В области собственно поглощения индифферентной жидкости запись полос поглощения анализируемых вещества не очень надежна.
Записывают ик спектр поглощения получившейся пасты, помещая в каналы сравнения спектрофотометра, Такие же пластинке с тонким слоем индикаторной жидкости.
Для получения качественного ик спектра испытывают обе методики. Если в обеих случаях получается одинаковый спектр то в дальнейшем можно использовать вектор получившейся методом прессования. Если же спектры будут не одинаковые то анализируемым веществом вступила в реакцию с калибром и от этой методике нужно отказаться
Для жидких веществ
Для получения ик-спектра поглощения не водных жидкостей, анализируемую жидкость наносят на пластинку калия брома и записывают спектр образца, помещая в канал сравнения чистые пластинки с калий бром.
Ик-спектры поглощения неводных растворов получают так же как и спектры неводных жидкостей, но исследуют не слой между пластинками, а применяют кюветы с разной толщиной стекла, помещая в канал сравнение такую же кювету с чистым растворителем.
Получившиеся ик-спектр поглощения водных растворов затруднено из-за собственной поглощения воды в ик-области и невозможности применения пластиной КВr. Вместо них используют пластинки из аргентум хлор.
Для газов
ИК-спектра поглощения записывается с использованием кювет, которые имеют окошки из солевых пластинок с толщиной поглощающего слоя 10см.
Из газовой кюветы снабженным газоотводным краном откачивают воздух, ее заполняет анализируемый газ и записывают ик-спектр, в канал сравнение помещают такую же кювету с азотом.
Конечно идентификации — ее проводят, сравнивая полученные ик-спектры поглощения со спектром эталона.
Применение
1 качественный и количественный анализ сырья
2 фракционная состоянии нефтепродуктов
3 анализ топлива, нефти, газа, продуктов их переработки
4 контроль качества полупроводников
5 анализ синтетических каучуков
6 контроль качества лекарственных веществ, сырья
7 анализ многокомпонентных газовых смесей
8 Анализ влажности, состав газа
9 контроль белков, жиров, клетчатки
10 определение нефтепродуктов в воде и почве.
11 Контроль атмосферного воздуха
84 Вопрос: Хроматография.Классификация.Применение
Это физико-химический метод разделения в-в, основанный на распределении компонентов между двумя фазами: подвижной и неподвижной.
Как метод анализа была введена в 1903г М.С Цвет
Достоинства: простота выполнения, возможность разделения малых кол-в в-в с близкими св-ми.
В качестве ПФ используют твердое в-во (сорбент) или пленка жидкости нанесенное на твердое в-во.
В качестве НФ используют газ или жидкость, которые протекают через НФ.
Классификация.
1.По агрегатному состоянию ПФ и НФ
газовая : а) газо-жидкостные ПФ; б) газо-твердофазная НФ.
Жидкостная: а) жидкостно-жидкостная; б) жидкостно-твердофазная; в) жидкостно-гелевая.
2. По механизму взаимодействия сорбент-сорбат.
Распределительная-основана на различии в р-ти, разделяемых в-в в неподвижной фазе или на различии в р-ти в подвижной и неподвижной жидкой фазы. К ней относиться: бумажная, газо-жидкостная.
Ионно-обменная-основана на разной способности в-в к ионному обмену , между ионами электролита и ионами адсорбента.
Адсорбционная-основана на избирательной адсорбции компонентов анализируемой смеси с соответствующими адсорбентами.
Осадочная-основана на образовании различающихся по р-ти осадков разделяемых в-в с сорбентом.
Эксклюзионная-основана на различии в размерах и формах молекул разделяемых в-в.
Хемихроматография-основана на различной способности компонентов смеси в те или иные химические реакции с реагентами входящие в состав НФ: ОВР,осаждения.
Аффинная-основана на взаимодействии разделяемых примесей с лигандами , который связан с инертным носителем.
Адсорбционно-комплекснообразовательная-основана на образовании комплексных соединений разной устойчивости на поверхности.
Электрофорез-основана на неодинаковой способности перемещаться под действием электрического поля.
3. По технике выполнения
Колоночная т.е разделение проводиться в специальных колоннах, стеклянная трубка с верху через колонну пропускают ПФ. Компоненты движутся вдоль колонки с разной скоростью и это приводит к разделению зон, каждая из которой содержит одно в-во. В-ва способные сильнее адсорбироваться будут поглощаться верхней части колонки. В-ва неспособные сорбироваться будут собираться в фильтрате.
Плоскостная-разделение проводят на бумаге или в тонком слое сорбента.
Капиллярная.
4. По способу получения хроматограммы
Аналитическая.
Промышленная.
Препаративная.
5. По способу получения хроматограммы
Фронтальная.
Проявительная(элюентная).
Вытеснительная.
Применение. Определяют жидкие, твердые в-ва с высокой молекулярной массой. Строение и св-ва органических в-в.
85 Вопрос: Бумажная хроматография. Методы определения кол-ва компонентов.
Основана на различии в скорости перемещения компонентов смеси на бумаге в потоке р-ля. (элюента)
Используются для разделения органических , неорганических смесей сахаров, стероидов в сочетание с электрофорезом для разделения пептидов.
Достоинства: доступность, простота выполнения, разделения малых кол-в , несложная аппаратура.
Недостатки: размывание хроматографической зоны связано с неоднородностью бумаги. Для разделения сложных смесей используют бумагу длинной в 1м, это приводит к длительности и больше растворяется р-ля.
Требования.
Готовиться из высококачественных сортов хлопка. Должна быть однородна по плотности , химически чистой и инертной по отношению к подвижным компонентам.
В качестве НФ используется вода адсорбированная бумагой ( это нормально фазовый вариант БХ), или неполярные органические р-ли, которыми пропитывают бумагу(это обращенный вариант БХ).
В качестве ПФ используют смесь органических р-лей с водой.
Коэффициент распределения-это отношение концентрированного в-ва в подвижном р-ле к концентрации того же в-ва в неподвижном р-ле.
Бумажную хроматографию проводят в стеклянной камере , в которую помещают емкость с элюентом на полоску бумаги на линию старта наносят каплю исследуемого р-ра, который содержит разделяемое в-во. Бумагу ниже линии старта опускают в ПФ р-ль начинает двигаться под действием капиллярных сил, крышку камеры закрывают и проводят хроматографию до тех пор, пока ПФ не достигнет линии фронта , процесс прерывают , бумагу сушат на воздухе и проводят детектирование пятен и идентифицируют в-ва. Если зоны не окрашены, то хроматограмму опрыскивают реагентами , которые образуют с компонентами окрашенные соединения.
По расположению бумаги и направлению движения элюента различают: восходящую, нисходящую, горизонтальную.
Положение хроматографических зон характеризуют величиной коэффициента подвижности- это отношение пути пройденного центром хромаграфической зоны к пути пройденному фронтом р-ля.
Методы определения кол-ва компонента.
1.Предварительно строят градуировочный график исходя из пропорциональной зависимости ( зависимости кол-ва в-ва в пятне и площадью пятна).
2. Пятно вырезают , взвешивают и вырезают такой же по площади лист и бумаги на разности находят массу определяемого в-ва.
Учитывают связь между интенсивностью окраски и содержанием в нем определяемого компонента.
86 Вопрос : Тонкослойная хроматография. Сорбент. Требования к сорбентам.
Это метод адсорбционной хроматографии при которой адсорбент используется в виде тонкого слоя на пластинке.
На поверхность пластинки намечают линию старта ( 2-3см от нижнего края) и линию финиша р-ля.
Различают:
1.Пластинки с незакрепленным слоем. Слой сухого сорбента тщательно выравнивают на поверхности пластинки до получения слоя одинаковой толщины.
Достоинства: пластинки готовятся быстро и легко.
Недостатки: сложность получения воспроизводимых результатов.
2. Пластинки с закрепленным слоем.
Получают суспензию сорбента в воде или в органическом в-ве , добавляют гипс или крахмал как закрепляющее в-во и эту смесь наносят на пластинку. Высушивают, а затем активируют ( 30мин при 100-110гр).
На линию старта пластинки наносят небольшое кол-во жидкости , которая содержит смесь разделяемых в-в (А и В) в подходящем р-ле. Затем пластинку помещают в жидкую ПФ. Процесс проводят в хроматографических закрытых камерах, которые насыщены парами р-ля. Под действием капиллярных сил ПФ перемещается вдоль НФ от линии старта до фронта р-ля, при этом увлекает за собой компоненты смеси( А и В). В-ва А и В передвигаются с разными скоростями. Если сродство компонента А НФ меньше сродства компонента В к этой фазе то компонент А будет перемещаться быстрее компонента В, через некоторое время после достижения ПФ линии финиша р-ля хроматографию заканчивают. Пластинку достают из камеры, высушивают и определяют положение пятен А и В.
Для характеристики разделяемых компонентов в системе вводиться понятие коэффициент подвижности (Rf), обычно в пределах от 0 до 1.
Rf зависит : от природы р-ля, природы сорбента от чистоты , его толщины слоя, от активности сорбента.
Для надежной идентификации разделяемых в-в используют «свидетели»- это эталонные в-ва наличие которых предполагается в анализируемой пробе. Если Rf=Rfсвидетель, то в-во -свидетель присутствует в хроматографической смеси. Для характеристики разделения 2х компонентов, вводят понятие степень разделения, чем больше Ra\b, тем лучше разделяются пятна на хроматограмме.
Сорбент
Чем больше сорбент содержит воды, тем больше его активность .
Активность сорбента-это способность сорбировать компоненты.
Зависит : от природы активных центров их концентрации , от размеров поверхности , от степени дисперсности частиц, от содержания воды на сорбенте , от природы ПФ.
В качестве сорбента используют: активированный уголь, CaCo3, CaSo4, сахарозу, крахмал, Al2O3-используют как сорбент для разделения в-в слабоосновного и нейтрального характера, его активность зависит от кол-ва поглощения воды, которую измеряют по шкале Брокмана.
Недостатки: Перед использованием необходимо активация пластинки при t=100-150гр, небольшая адсорбционная емкость , al2o3 по отношению к ряду р-ций проявляет каталитические св-ва.
Силикагель
Обладает большой поверхностью, активными центрами являются группы S-OH. Молекулы воды могут блокировать эти центры , поэтому силикагель активируют при нагревании 150-220гр. При более высокой t активные центры разрушаются.
Достоинства: слой сорбента хорошо закрепляется на поверхности пластинки , высокая адсорбционная емкость.
Требования к сорбентам
1. Большая удельная активность, слой сорбента должен быть равномерным и однородным по толщине.
2. Не должен растворяться в ПФ.
3. Должен обеспечивать требуемую скорость перемещения ПФ(10 сек до 30мин).
87 Вопрос: Растворители тсх. Способы тсх. Расшифровка хроматограмм.
Выбор р-ля определяется природой сорбента и св-ми разделяемой смеси, в качестве ПФ готовят смесь нескольких р-лей. При их выборе учитывают способность вытеснять соединения сорбированные на НФ. Она зависит от сочетания св-в р-ля и НФ для данного сорбента существуют элюотропные ряды , облегчающие выбор р-ля.
Пример: ряд растворителей по Траппу
1.Циклогексан
2. Гексан
3. Метанол, этанол, вода.
Систему р-лей в качестве ПФ подбирают так: смешивают 2 р-ля из начала и конца меняя р-ли и их кол-во получают ПФ с желательными св-ми.
Способы ТСХ
Восходящая ТСХ. Основана на том, что фронт хроматографической системы поднимается снизу вверх под действием капиллярных сил.
Недостатки: Скорость поднятия фронта происходит не равномерно, для устранения этого недостатка по стенкам камеры прикрепляют фильтровальную бумагу, по которой поднимающиеся система насыщает парами камеру по всему объему.
Нисходящая ТСХ. Основана на том, что опускается сверху вниз под силой тяжести. В верхней части прикрепляют кювету с хроматографической системой из которой на пластинку поступают р-ли.
Горизонтальная ТСХ. Скорость движения фронта постоянна. В методе ТСХ используют: одномерную, двумерную, многократную, ступенчатую.
При одномерной, анализ проводят не изменяя направление движения идентификации в-в.
При двумерной разделение в-в проводят в двух перпендикулярных направлениях , используют при анализе сложных смесей.
При многократной процесс проводят много раз ( 3 раза) с одной и той же ПФ до тех пор пока не получат желаемое разделение пятен компонентов.
В ступенчатой процесс проводят с одной и той же пластинкой последовательно используют каждый раз новую ПФ, до тех пор пока не достигнут четкого разделения пятен.
Расшифровка хроматограммы
Если пятна на хроматограмме окрашены, то после высушивании пластинок определяют расстояние от линии старта до центра каждого пятна и вычисляют коэффициент подвижности. Если в состав пробы входят бесцветные в-ва необходимо провести детектирование для этого хроматограммы проявляют.
1.Обработка УФО. Используется для обнаружения флюоресцирующий в-в.
2.Термическая обработка. Высушивают на воздухе пластинку нагревают до 200гр избегать потемнение в-в, при этом пятна в-в проявляются в виде коричневых зон.
3.Химическая обработка. Хроматограммы обрабатывают реагентами, которые образуют окрашенные соединения смеси H2S, соед.Br, H2SO4конц.
После детектировании пятен определяют какому в-ву принадлежат то или иное пятно. Для этого используют эталонное в-во.
При анализе пятен предполагается связь между площадью в-ва и содержания в нем в-ва , эту связь устанавливают методом градуировочного графика. Иногда сравнивают интенсивность окраски пятна, полагают , что она пропорциональна кол-ву определяемого компонента.
Ошибка определения методом ТСХ от 5 до 10%.
Использование: метод ТСХ применяется для анализа и контроля качества лекарственных средств.
88. Ионообменная хромотография. Применение.
Основателем является самуэльсон . Теорию метода разработал Никольский.
Ионный обмен это гетерогенный процесс При котором сорбент неподвижной фазы и находящихся с ним вконтакте раствор подвижная фаза обратимо обменивается одноименно заряженными ионами.
В качестве сорбентов используют ионнообменники или иониты.
Они состоят из матрицы которая распределена ионной гены мин группами . Группа включает прочно связаны ионы и ионы, менее прочно связанные, то есть противоионы, Которые способны к отщепления и переходу в раствор.
Монеты, обменивающиеся катионами называются катионнообмениками или катионидами.
Монеты, обменивающиеся анионами — аниониты.
Арматурные иониты способны обмениваться в растворами и катионами и анионами — амфолиты.
Применение: Очистка от примесей, разделении электролитов, Концентрирование разбавленных растворов , разделении редкоземельных металлов , Анализ лекарственных веществ
89. Катионный и анионный обмен. Иониты.
Катионный обмен. Катионные смол и содержит активные группы OH, COON, son
Подвижными остаются ионоводороды этих групп.
Катионит в H+ форме состоит из матрицы R и ионогенной группы SO3H
Группа SO3 прочно связана с радикалом и в условиях ионного обмена отщепляться не может.
Противоионы H+ могут отщепляется от иоаногенной группы. Их замещают катионы металлов, которые переходят из раствора в фазу сорбента и будут и держиваться ионогенной группой.
Ионы H+ переходят в раствор и уносятся подвижной фазой. Так происходит катионный обмен.
Анионный обмен.
В анионнобменных смолах активными являются основные группы NH2
Анионит в основной форме содержит гидроксильную группу состоит из матрицы R и ионногенной группы.
Эта группа включает прочно связаный катион, не способный к отщеплению в условиях обмена. Противоион ОН способен к отщеплению и к обмену с анионитами раствора.
Иониды
1. Неорганические Al2O3
2. Органические
3. Синтетические
4. Природные
Сорбенты на основе ионообменных смол обладают высокой способностью к ионному обмену химической стойкостью , большой прочностью.
Обменная емкость ионита — определяется числом мили моль обменянных ионов, приходящихся на 1 грамм сухого ионита или на 1 миллилитр набухшего ионита.
Обменная емкость характеризуется способностью ионитов ионному обмену. Зависит от природы и числа ионногенных групп, способности к ионизации, температуры.
После завершения ионного обмена и разделения ионов иониты можно регенерировать.
Регенерации позволяет многократно использовать иониды.
Существуют ряды сорбируемых ионов на ионно обменников (для катионидов и анионидов).
Для катионидов: Li<Na<K<...<Pu.
Наименьшим сродством к катионному обмену обладает литий, наибольшим плутоний.
Для анионитов:F<Cl<Brr<I<...<OH
Наименьшим сходством обладает фтор наибольшим гидроксил ион.
90. Методы ионообменной хромотографии. Ионообменное равновесие.
Методы и ионно обменной хроматографии. В колоночной ионообменной хроматографии применяют методы вытеснительной и проявителей хроматографии. Разделение ионов осуществляется вследствие их неодинакового сродства к сорбенту. Из за различных констант ионного обмена коэффициент распределения и скорости перемещения зон .
Колонки заполненные заранее ионитом в определенной форме, заливают дистиллированной водой, верхний уровень жидкости должен быть выше слоя ионида. Глубина и Скорость ионого разделения зависит от природы ионов, сорбента, неподвижной фазы, температуры, длинны колонки, скорости перемещения подвижной фазы.
Ионообменное равновесие — гетерогенной равновесие.
Константа ионного обмена показывает отношение равновесных концентраций ионов в фазе сорбента прямо пропорционально отношению равновесной концентрации этих же ионов в растворе. Зависит от природы сорбента, обменивающихся ионов, жидкой фазы.
Если константа равно 1, то сродство обоих катионов одинаково, в этом случае ионный обмен почти не происходит.
Если константа > 1, то равновесие смещено вправо и происходит обмен катионов.
Фактор распределения — Характеризует способность данного ионида к разделению 2 ионов, которые находятся в растворе.
если фактор разделения равен единице разделения не будет.
Для эффективного разделения ионов с помощью ионнообменной хроматографии подбирают иониты с высоким значением фактора разделения.
Коэффициент распределения D— характеризует способность ионита к обмену ионнов.
91. Газовая хроматография. Применение. Колонки.
Основы метода были разработаны в 1958 году джеймсом и мартином .
Газовая хроматография это процесс разделения компонентов смеси, основный на различии В распределении этих компонент между 2 фазами ( газовый носитель и твердой фаза или газовой носитель и жидкой фаза)
Хроматографирование проводят на газовых хроматографах разной конструкции .
Анализируемую смесь переводят в парообразное состоянии и смешивать с инертным газовым носителем и образуют подвижную фазу.
Газовый носитель (аргон гелий или азот) ввод. анализ. проба в испаритель, который вместе испаряется и потоком газоносителя уносится в хроматограф. колонку .
После разделения смеси на зоны компонентов последняя поступает в детектор, где регистрируются электрический сигнал и преобразуется в виде хроматограммы
при большом объеме пробы эффективность колонки уменьшается
оптимальный объем для жидкости 1 микролитр, а оптимальный объем для газообразного вещества до 5 миллилитров. Разделенные компоненты распределение пф и нф в соответствии с коэффициентом распределения.
Равновесный обмен хроматографируемого вещества осуществляют в результате многократного повторения сорбции и десорбции по мере движения в колонке.
Из колонки вместе с газовым носителем выходящий зоны хроматографируют вещества, разделенные полностью или частично.
Если коэффициент распределения различны, то перввм Покидают колонку компоненты у которых коэффициент распределения меньше.
Каждому разделенному Объекту соответствует свой пик на хроматограмме.
Колонки.
Представляют собой металлические или стеклянной трубки разной формы с длиной до нескольких метров, диаметром около 0,5 мм или меньше
Колонки бывают 2 типов капиллярные и наполненные.
Наполненные это металлические/ стеклянные длиной до 5 м, обычно изогнуты их заполняют частицами твердой основны с Нанесением на их поверхность тонким слоем жидкоц неподвижной фазы
капиллярные это стеклянные, внутренная поверхность покрыты тонким слоем жидкой неподвижной фазы. роль твердого носителя выполняет внутренняя поверхность колонки длина от 10 до 100 м, диаметр равен или меньше 0,5 мм. Эти колонки обеспечивает высокую степень разделения.
В качестве материала твердых носителей используют оксид алюминия, оксид кремния, полиэстер. Неподвижная фаза представляет собой не летучие высококипящие жидкости.
После заполнения колонки сорбентом ее к кондиционируют.
Применение Метод газожидкостная хроматография используют для разделения определении летучих веществ либо веществ которое можно перевести в летучие продукты. Используют для идентификации определение разделением белков аминокислот нуклеиновых кислот полисахаридов взрывчатых веществ лекарственных веществ
92. Параметры удерживания. Параметры разделения. Обработка хроматограмм.
Параметры удерживания
1) время удерживания , измеряется с момента ввода пробы до момента выхода пика на хроматограмме.
Зависит от природы вещества, газоносителя, природы и массы нф, скорости движения подвижной фазы, температуры, длины колонки. Чем выше коэффициент распределения вещества, тем больше время удерживания.
2) время выхода — отношение длинны колонки к скорости движения газоносителя.
3) исправленное время удерживания компонентов 1 и 2 — время, в течение которого компонент находится в нф.
Исправленное время удерживания пропорционально коэффициенту распределения данного вещества.
4) скорость удерживания = скорости пф, которая выносит данное вещество из колонки. Зависит от скорости движения РФ.
5) коэффициент удерживания R — отношение скорости перемещения данного компонента вдоль колонки к скорости движения газоносителя.
6) коэффициент емкости К— чем больше К, тем больше времени компонент находится в нф.
Параметры разделения.
1. Степень разделения Rs — Характеризует разделение 2 пика на хроматограмме.
Если Rs <1, то разделение веществ не полное
Если Rs>1, происходит полное разделение.
С ростом длинны колонки степень разделения увеличивается, но при этом увеличивается продолжительность анализа.
Степень зависит от коэффициента разделения и числа теоретических тарелок.
2. Коэффициент разделения — характеризует селективность неподвижности фазы по отношению к 2 компонентам, а также расположение разделенных пиков на хроматограмме.
Если коэффициент=1, то хроматографируемые вещества не разделяются.
Чем > коэффициент, тем лучше разделяются пики.
При разделении компонентов происходит перенос вещества через границу раздела подвижной и неподвижной фаз, чем больше таких переходов тем лучше разделены компоненты.
Участок зоны внутри колонки, на которой установлено равновесие между подвижной и неподвижной фазой называется теоретической тарелкой.
Число теоретических тарелок состоит от нескольких сотен до нескольких тысяч. Чем больше их число, тем эффективнее работает колонка.
Чем >n и <высота эквивалентных ТТ, тем лучше отделение зоны компонента от других компонентов.
С увеличением температуры эффективность разделения возрастает, но снижается селективность колонки.
При температуре 200—250° разделяет спирты и углеводы
при температуре 250—400° разделяют фенолы, жирные кислоты.
Обработка хроматограмм.
Идентификацию разделяя не компонентов проводят 2 методами
1. Используя вещества свидетели
В тех же условиях, в которых получали хроматограмму разделения смеси, записывают хроматограмму веществ свидетелей далее определяют время удерживания вещества свидетелей и сравнивают со временем удержания компонентов смеси.
Совпадение времени удерживания говорит о идентичности вещества свидетелей и компонентов смеси.
2. Использование времени удерживания
Родственные вещества могут иметь одинаковое время удерживания при использовании колонки с определенной неподвижной фазой.
Для характеристики состояния среды используют всю хроматограмму.
Профиль хроматограммы — это совокупность данных о числе расположении интенсивности форме пиков
Профиль получают при проведении только одного анализа. Все вещества хроматографируют в одинаковых условиях, это позволяет оценить содержание каждого компонента.
93. Электрохимические методы анализа. Классификация.
Электрохимические методы анализа — Основаны на электродных реакциях и на переносе электричество через раствор.
Методы базируются на зависимости величин измеряемых параметров от содержания определенного вещества.
Классификация
1. По природе источника электрической энергии
1) Методы без наложения внешнего потенциала (источником электрической энергии служит электрохимическая система)
Потенциометрический метод
2) Методы с наложением внешнего потенциала
а) кондуктометрический анализ
б) кулонометрический анализ
в) вольтамперометрический анализ
г) электрогравиметрический анализ
2. По способу применения электрохимических методов
1) прямые — Измеряет электрохимический параметр и по показаниям прибора находит содержание определяемого вещества
а) прямая потенциометрия
б) прямая кондуктометрия
2) косвенные — методы тестирования
а) потенциометрические
б) кондуктометрические
94. Потенциометрический анализ. Прямая потенциометрия.
Потенциометрический анализ основан на измерении ЭДС и электронных потенциалов при измерениях используют 2 электрода.
1. Индикаторный электрод потенциал которого зависит от концентрации определяемого вещества
2. Электрод сравнения, потенциал которого остается постоянным при проведении анализа
В Потенциометрии используют электроды 1,2 рода, окислительно восстановительные, мембраны.
Электроды 1 рода — электроды обратимые по катиону общему с материей электрода
1. Металлы, погруженные в раствор соли того же металла. Потенциал электрода 1 рода зависит от активности кат. металла.
2. Газовые электроды например в дороге. Потенциал зависит от активности ионов водорода.
3. Амальгамные это амальгамы металлов погруженные в раствор содержащий катионы того же металла. Потенциал зависит от активности катионов металла в растворе и активности металлов в амальгаме.
Электроды 2 рода — Электроды обратимые по аниону (используют в качестве электрода сравнения)
1. Металлы, поверхность которых покрыта малорастворимой солью того же металла. И погружены в раствор содержащий анионы, входящие в состав этой малорастворимой соли (хлорсеребрянный электрод)
2. Газовые электроды (хлорный электрод)
О-в электроды
Состоит из инертного материала (графит платина) погруженного в раствор содержащий окисленную или востановленную форму данного вещества.
1. Электроды потенциал которых не зависит от активности ионов водорода. Потенциал зависит от активности окисленной и востановленной формы вещества.
2. Электродный потенциал которых зависит от активности ионов водорода (хингидронный электрод) — платиновая проволока погруженная в раствор НСl, насыщенный хингидринном.
Мембранные электроды
— Электронный обратимые по катионов и анионов сорбирующие мембраной.
Потенциал зависит от активности тех ионов, которой сорбируются мембранной.
По обе стороны мембраны находятся разные растворы, содержащей одни и те же опред. ионы но с разной концентрацией .
1) Анализируемый раствор с неизвестной концентрацией
2) Стандартный раствор с точной концентрацией
Из за разной концентрации ионов в растворе на различных сторонах мембраны ионы сорбируются в разных количествах; не одинаковым будет электронный заряд на разных сторонах мембраны, в результате возникает мембранная разность потенциалов.
Определение ионов с помощью мембранных электродов называют ионометрией.
Прямая потенциометрия
Достоинства: быстрота проведения измерений, не требуют больших объемов.
Определение концентрации вещества проводят
1. Метод градуировочного графика
Готовят от 5 до 7 эталонных растворов с известной концентрации содержания определенного вещества, эти растворы вносят в электрохимическую ячейку которую помещает индикаторный электрод и электрод сравнения. Для каждого раствора измеряют эдс . Строит график под данным . Затем в ячейку вносится анализируемый раствор и измеряют эдс. Затем находят концентрацию по графику.
2. Метод добавок стандарта
Ячейку вносит известный объем анализируемого раствора, измеряет эдс. В тот же раствор добавляют точно измерить объем стандартного раствора и снова определяет эдс. Электродов используют водородные и хингидронный.
Применяется прямая потенциометрия для определения концентраций ионов водорода концентрации металлов и концентрации анионов.
95. Потенциометрическое титрование. Кривые титрования. Применение.
Потенциометрическое титрование это определение объема титранта путем измерения эдс в процессе титрования.
Достоинства: Высокая точность, чувствительность, титрование можно проводить в украшенных, мутных, не водных средах, не требует Индикатора.
Анализируемый раствор титруют подходящим титрантом, конец титровании фиксируют по резкому изменению потенциала индикаторного электрода.
Изменение потенциала измеряют в процессе титрования в зависимости от объема прибавленого титранта.
Добавляют равными Порциями титрант, каждый раз измеряют разность потенциалов. По полученным данным строят кривую тестирования, по которой измеряют объем израсходованного титранта в точке эквивалентности. В качестве электродов используют серебро платину (индикаторные). В качестве электрода сравнения используют хлорсеребряный.
Кривые потенциометрического титрования это график изображаемый измененийюе эдс в ячейке в зависимости от объема прибавленого титранта .
Интегральные кривые (эдс от объема титранта)
Дифференциациальные кривые (dE/dV от объема титранта)
Метод грана (V/VE от объема титранта)
По построенным кривым определяют объем в точке эквивалентности.
Применение: Для определения конца тестирования, для раздельного определения компонентов смеси в анализируемом раствора, для анализ лекарственных препаратов
96. Кондуктометрический анализ. Прямая кондуктометрическия.
Кондуктометрический анализ основан на зависимости между электропроводимостью электроантов и их концентрации
Электропроводимость растворов судят на основании измерения электрического сопротивления в электрохимической ячейке (стеклянный стакан с двумя электродами между которыми находится раствор электролита) через нее пропускают эл. ток
Электроды используют из платины, которую покрывают губчатой платиной.
Электрическое сопротивление раствора электролита прямо пропорционально толщине этого слоя и обратно пропорционально площади поверхности электродов.
Удельная электропроводность это электрическая проводимость слоя электролита, находящейся между сторонами куба с длиной 1 сантиметр и численно равное току проходящему через слой электролита с площадью сечения 1 квадратный сантиметр при потенциале 1 вольт.
Зависит от природы электролита, природы растворителя, концентрации ( С увеличении концентрации электролита удельной электропроводностью возрастает, проходит через максимум и постепенно понижается)
У слабых электролитов с повышением концентрации удельная электропроводность падает. У сильных электролитов при очень большой концентрации удельная электропроводность падает.
Температура с увеличением температуры удельная электропроводность повышается
Эквивалентной и молярная электропроводность
Эквивалентная электропроводность — это электрическая проводимость слоя электролита, находящегося между одинаковыми электродами с такой же площадью, чтобы объем раствора электролита заключенного между ними содержал 1 грамм эквивалент. растворенного вещества.
Эквивалентная электропроводность повышается с понижением концентрации или с повышением температуры.
Эквивалентная электропроводность раствора электролита при бесконечном разбавления равна сумме подвижности катионов и анионов.
С увеличением концентрации подвижность ионов падает
Прямая кондуктометрия
Концентрация вещества в растворе определяется по резкому изменению удельной электропроводности раствора
при обработке данных используют 2 метода
1.расчетный — молярная концентрация эквивалента рассчитывается, если известна удельная электропроводность и эквивалентная.
Удельную электропроводность определяют На основании измерения электрического сопротивления если подвижность катиона и аниона известны то можно рассчитать концентрацию.
2. Метод градуировочного графика. Готовит несколько эталонных растворов с известной концентрации вещества, Измеряют удельную электропроводность каждого раствора при постоянной температуре строит график. Затем в тех же условиях измеряют удельную электропроводность анализируемого раствора и находит концентрацию по графику.
Достоинства: высокая чувствительность, Простота выполнения, небольшая ошибка до 2%
Недостатки: малая селективность
Применение: Определение растворимости малорастворимых электролитов
Для контроля жидких пищевых продуктов, воды,
для определения содержания солей водных объектах.
97. Кондуктометрическое титрование.
За ходом тестирования следят по изменению электропроводности анализируемого раствора, который находится в кондуктометрической ячейке.
По полученным Данным строят прямую которая отражает зависимость электропроводности от объема прибавленого титранта
КТТ находят экстраполяцией участков кривой тестирования в области изменении ее наклона при этом не требуется использование индикаторов
Достоинства: титрование проводят в окрашенных и непрозрачных растворах Высокая чувствительность , ошибка определения до 2%
Недостатки: малая селективность
98. Полярографический анализ. Применение. Количественный полярографический анализ.
Полярографический анализ основан на использовании зависимости между электрическими параметрами и свойствами анализируемого раствора.
В качественном полиграфическом анализе использует связь между электрическим потенциалом и природе вещества.
В количественном использует связь между величиной диффузионного тока и концентрации вещества в растворе.
Величина электрического потенциала диффузионного тока определяется при анализе поляризационных (вольт амперных) кривых, которые отражают зависимость электрического тока от величины приложенного потенциала.
Полярографический метод с применением ртутного капающего электрода был разработан в 1927 году Гейровским.
В соседу, в который вносят раствор с анализируемым веществом имеется 2 электрода — микрокатод и макрокатод, которые подключают к источнику тока.
Микрокатод — стеклянный капилляр, заполненной жидкостью и соединенный с резервуаром жидкой ртути. Ртуть вытекает по каплям.
Макрокатод — жидкая ртуть на дне сосуда в качестве макрокатода используют наполненный электрод по отношению к которому измеряет потенциал микрокатодом.
Полярограмма — зависимость тока от потенциала , состоит из 3 участков.
1. Остаточный ток
2. Ток, контрол. переносом заряда
3. Предельный ток, контролируется скорость диффузии
При постепенном повышении потенциала электрического тока, обуславливается присутствием растворенного кислорода ионнов фонового электролита, других примесей сначала возрастает медленно (остаточный ток)
При некоторых значениях потенциала ток в ячейке резко возрастает и при дальнейшем повышении Е, достигает максимального значения после чего сново мало измеряется (Предельный ток)
Разность между предельным и остаточным током равно диффузионному ток
Ртутная капля по мере ее формирования на конце капилляра заряжена отрицательно в приэлектронном слое около ртутной капли находятся катионы определяемого вещества, которые Разряжаются на ртутной капле при достижении величины потенциала выделения.
Концентрация катионов в приэлектронном слое возле ртутный капли понижается и становится меньше их концентрации в общем объеме.
Транспорт катионов в приэлектронный слой поддерживается за счет диффузии.
Величина предельного и диффузионного токов в полиграфической ячейке зависит от концентрации анализируемого вещества.
Вещество которое разряжается на микрокатоде называется деполяризатором
На практике вместо потенциала выделения определяют потенциал полуволны.
Для разных катионов потенциал полуволны неодинаков это позволяет открывать эти катионы в растворе. Потенциал полуволны зависит от природы растворителя, вещества, температуры, рН, от присутствия комплексообразователей, не зависит от концентрации.
Достоинства: Высокая чувствительность до 10 в - 6 моль/л
Большая селективность
Воспроизводимость
Анализ смеси веществ без их разделения
Анализ окрашенных растворов
Недостатки: Сложность аппаратуры и токсичности ртути
Если в анализируемом растворе присутствует несколько востанавливающих веществ то на полярограмме наблюдается несколько волн каждая из которых соответствует своему веществу. В качестве растворителя используют воду, водоорганические смеси (вода спирт)
Количественный палярографический анализ — Основан на измерении диффузионного тока при анализе полярограмм находят концентрацию определяемого вещества.
1. Метод градуировочного графика. Готовят несколько стандартных растворов с точно известной концентрацией вещества. Проводит полярографирование каждого раствора, получают полярограммы и находят значение потенциала полуволны и диффузионого тока. По данным строят график.
Затем проводят полярографирование анализируемого раствора, получают полярограмму измеряют величину диффузионного тока и по графику находят концентрацию вещества.
2. Метод добавок к стандарту. Получают полярограмму анализируемого раствора с неизвестной концентрации вещества находят величину диффузионного тока, затем к анализируемому раствору добавляют известное количество анализируемого вещества и Опять проводят полярог
рафирование, определяют значение диффузионного тока, затем по уравнению Ильковича находят концентрацию определяемого вещества.
3. Метод стандартных растворов. в одинаковых условиях проводят полярографирование 2 растворов. Первый — анализируемый раствор с не известной концентрации, второй — стандартный раствор с известной концентрации. На полученных полярограммах находят высоты волн которые отвечают диффузионному толку затем по уравнению Ильковича определяют концентрацию анализируемого вещества.
При проведении полярографического анализа необходимо
1. Поддерживать электропроводность раствора для этого в раствор вносят фоновый электролит NaCl, KNO3
2. Концентрация электролита больше концентрации активного вещества более чем в 100 раз
3. Перед проведением анализа из раствора удаляют растворенный в нем кислород так как он так же дает полярографическую волну (через раствор пропускают инертный газ азот)
4. Для подавления максимума тока в раствор добавляют пва (агар-агар). Который меняет поверхностное натяжения ртутной капли.
5. Поддержание постоянной температуры
Применение для определения катионов металлов, анионов, органических соединений это алкалоидов витаминов, примесей в лекарственных препаратах
99. Амперометрическое титрование. Кривые титрования. Применение.
Амперометрическое титрование — Разновидность вольтамперометрического метода; основан на измерении тока между электродами в ячейке к которой приложено напряжение. Точка Эквивалентности фиксируется по резкому изменению (падение или рост) диффузионного тока, что отвечает окончанию реакции.
Различают:
1. Амперометрическое титрование с 1 поляризуемым электродом.
Основан на измерении тока в зависимости от количества прибавленного титранта при постоянном потенциале.
Индикаторный электрод — ртутный капающий электрод или графитовый.
В качестве электрода сравнения — хлорсеребрянный.
В начале получают вольтамперные кривые для определенного вещества и титранта, на основании которых выбирают значение потенциала при котором достигается величина предельного тока.
Эти значения потенциала будут поддерживать постоянно в течение всего титрование дочка величина тока зависит от концентрации вещества. В точке эквивалентности величина тока резко изменятся.
По результатам титрование строят кривые зависимость величины тока от объема титранта.
Объем прибавленого титранта точке эквивалентности определяются по пересечения прямых на графике.
Достоинства: Метод обладает высокой чувствительностью 10 в - 6 моль на литр, большой точностью, высокой селективностью, титрование окрашенных и мутных растворов, не требует изменений индикатора.
2. Амперметрическое титрование с 2 одинаковыми поляризуемость электродами. Основан на измерении тока между 2 одинаковых электродов (платина) На кот. подают небольшую разность потенциалов.
Титрование ведут при перемене сеней раствора. Добавляет до резкого прекращения или явление тока по микроамперметру.
При исчезновении компоненты или появлении нового ток в точке эквивалентности резко приживается или появляется.
Применение: йодометрия, нитритометрия, тестирование в некоторых средах.
100. Кулонометрический анализ. Применение. Кулонометрическое титрование.
Кулонометрический анализ — основан на зависимости между массой вещества прориагировавшей при электролизе и количестве электричества прошедшему через электрохимическую ячейку.
В соответствии с законами электролиза фарадея масса вещества связана с количеством электричества.
Клонометрический анализ проводяпроводят:
1. В амперостатическом режиме (при постоянном токе)
2. В патенциостатическом режиме (постоянный потенциал)
В 1 случае для определения Q измеряют время электролиза и постоянный ток.
Во 2 случае Q определяют либо расчетным способом, либо с помощью кулонометров (серебряный/медный)
Зная массу металла, который выделяется на катоде в кулонометре определяют количество электричества.
Прямая кулонометрия
Электролизу подвергается анализируемое вещество, измеряют Q и рассчитывают массу определяемого вещества. Потенциал электрода поддерживают постоянно для этого используют потенциостаты. Постоянное значенищй потенциала выбирают на основании рассмотрения поляризационной кривой координаты (ток от потенциала). Обычно выбирают такое значение потенциала, которое соответствует области предельного тока для анализируемого вещества.
В качестве рабочего используют платиновой, в качестве электрода сравнения — хлорсеребряный
Достоинства: Метод селективен, чувствителен, высокая воспроизводимость.
Недостатки: Длительность проведения анализа , дороговизна аппаратуры.
Использование: Определению ионов металла, анодного окисления хлора брома йода, определение новокаина, аскорбиновой кислоты.
Кулонометрической титрование.
При титровании определяемое вещество находится в ячейке, реагируя с титрантом.
Окончание тестирования фиксируют визуально индикаторным методом, либо патенциометрически.
Достоинства: обладают высокой точностью, можно определить небольшое количество вещества, мало стойке соединения . Не требуют приготовления, стандартизации, хранения титрантов, так как он непрерывно образуется при Электролизе и расходуется на реакцию с веществом.
Недостатки: Сложная дорогая аппаратура
Вместо объема прибавленного титранта измеряют время и ток электролиза.
Титрование проводят
1. В амперстатическом режиме. При титровании измеряют время и количество электричества, затем находят массу вещества
2. В патенциостатическом режиме. Потенциал остается постоянным до тех пор, пока непрореагируют все катионы, после чего он уменьшается.
Условия проведения титрования
1. Реагент из которого генерируется титрант должен быть в большом избытке По отношению к определяемому веществу (возможно до 1000кратного избытка)
2. Величина постоянного тока должна быть < величины диффузионного тока, для избежания побочных процессов
3. Необходимо точно измерять количество электричества, для чего нужно фиксировать начало и конец времени и величину тока.
Применение: определение небольших количеств кислот 10 в -5 моль/л, для определения соединений сурьмы, мышьяка, иодидов, фенола, катионов Ме.
