
3886
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное учреждение высшего образования
Воронежский государственный лесотехнический университет
Экология древесины
Лабораторный практикум для студентов по направлению подготовки 35.03.02 – Технология лесозаготовительных и деревоперерабатывающих производств
Воронеж 2016
УДК
Экология древесины [Текст] : лабораторный практикум для студентов по направлению подготовки 35.03.02 – Технология лесозаготовительных и деревоперерабатывающих производств / Бельчинская Л. И. ; М-во образования и науки РФ, ФГБОУ ВО «ВГЛТУ им. Г. Ф. Морозова». – Воронеж, 2016. – 29с.
Печатается по решению учебно-методического совета ФГБОУ ВО «ВГЛТУ им. Г. Ф. Морозова» (протокол № 9 от 25 мая 2016 г.)
Рецензент доцент кафедры химии ФГБОУ ВО «ВГТУ», к.х.н. В.П. Горшунова
Лабораторный практикум предназначен для обучения бакалавров по направлению подготовки 35.03.02 – Технология лесозаготовительных и деревоперерабатывающих производств с учѐтом современного подхода к анализу взаимодействия технологических процессов и производств с окружающей средой.
Оглавление |
|
Введение .................................................................................................................. |
4 |
ЛАБОРАТОРНАЯ РАБОТА №1 Определение химических соединений, |
|
образующихся при сушке различных пород древесины............................... |
5 |
ЛАБОРАТОРНАЯ РАБОТА №2 Определение содержание |
|
формальдегида в формальдегидосодержащих клеях .................................... |
8 |
ЛАБОРАТОРНАЯ РАБОТА №3 Определение количества |
|
формальдегида, выделяющегося при отверждении клеѐв ......................... |
12 |
ЛАБОРАТОРНАЯ РАБОТА №4 Определение класса эмиссии |
|
формальдегида из древесных плитных материалов.................................... |
15 |
ЛАБОРАТОРНАЯ РАБОТА №5 Создание древесно-полимерной |
|
композиции из отходов древесины и полимеров.......................................... |
19 |
ЛАБОРАТОРНАЯ РАБОТА №6 Ознакомление с технологией и |
|
оптимизацией получения древесно-полимерных композиций.................. |
22 |
ЛАБОРАТОРНАЯ РАБОТА №7 Оценка эффективности экологичности |
|
способов утилизации отходов деревообработки ........................................... |
24 |
Библиографический список .............................................................................. |
29 |
Введение
Лабораторный практикум является важной составляющей в обучении бакалавров по направлению 35.03.02. В лабораторный практикум входит ряд работ по определению состава выбросов при сушке древесины, определение содержания формальдегида в формальдегидосодержащих клеях. Определение формальдегида при отверждении клеѐв, а так же установлении класса эмиссии формальдегида древесно-плитных материалов. Бакалавры осваивают технологии создания древесно-полимерных композиций при вторичном использовании полимеров и древесины. Они знакомятся со способами утилизации отходов деревообработки, оценивают их эффективность и экологичность. В лабораторные практикумы входят два текущих контроля, один из них связан с определением эмиссии газов и паров при сушке древесины различных парод, а так же с оценкой мономерного токсиканта в клеях и при их отверждении. Во второй контроль входит оценка знаний технологий и оптимизаций получения древесно-полимерной композиции.
ЛАБОРАТОРНАЯ РАБОТА №1 Определение химических соединений, образующихся при сушке различных пород древесины
Цель работы: Установление количества химических соединений, растворимых в воде при сушке древесины.
Процесс сушки древесины сопровождается выделением из древесины продуктов, содержащихся в древесине и которые могут быть при сушке удалены с сушильным агентом и водой.
Состав экстрактивных веществ, укрупнено, представляется по [Боровиков А.М ] следующими веществами.
Дубильные вещества, красящие вещества, камеди. Основную, активную, часть дубителей составляют танниды - производные многоатомных фенолов. По химической природе танниды происходят от двух типов фенольных соединений – пирогаллола и пирокатехина. В состав дубителей кроме таннидов входят углеводы, простейшие полифенолы, органические кислоты, минеральные и азотсодержащие вещества.
Камеди представляют собой водорастворимые смолообразные вещества, сотоящие в основном из полисахаридов (арабогалактана и др.). Красящие вещества желтого, коричневого, красного и синего цветов содержатся в полостях клеток.
Из древесины могут быть выделены разнообразные по химическому составу вещества: смоляные и жирные кислоты, воски, стеарины и др. Смоляные кислоты и спирты, эфиры смоляных кислот и смоляных спиртов или одноатомных фенолов, химически инертные вещества. В смолах могут присутствовать эфирные масла и вода.
Терпены (С10Н16) являются жидкими веществами с повышенной химической активностью. Они быстро изменяются под действием температуры, кислорода воздуха, кислот и других химических агентов.
Помимо смоляных кислот в древесине хвойных и лиственных пород содержится небольшое количество органических кислот линейного строения – жирных кислот: олеиновой, линолевой и др.
Согласно [Боровиков А.М ] химический состав древесины наиболее используемых пород представлен в таблице 1.
Результаты анализов древесины по Д. Фенгелю дают те же значения состава. Приведенный краткий перечень показывает, что древесина содержит много веществ,
представляющих опасность для окружающей среды. (в данном случае полезные потребительские свойства перечисленных веществ не рассматриваются).
Таблица 1 – Химический состав древесины
Порода |
Экстрактивные вещества, растворимые |
|
|
В эфире |
В воде |
Сосна |
2,6 |
0,6 |
Ель |
1,5 |
1,4 |
Лиственница сибирская |
3,6 |
5,1 |
Дуб |
4,3 |
1,8 |
Береза |
1,3 |
- |
Тополь |
6,8 |
2,1 |
Задание . Определить наличие экстрактивных веществ, растворимых в воде, сравнить с приведѐнными в таблице1, определить относительную ошибку измерения.
Количество удаляемых из древесины, при высушивании, органических веществ, в пределах одной породы, будет зависеть от температурного воздействия, его продолжительности, сечения, начальной и конечной влажности. Точное количество и
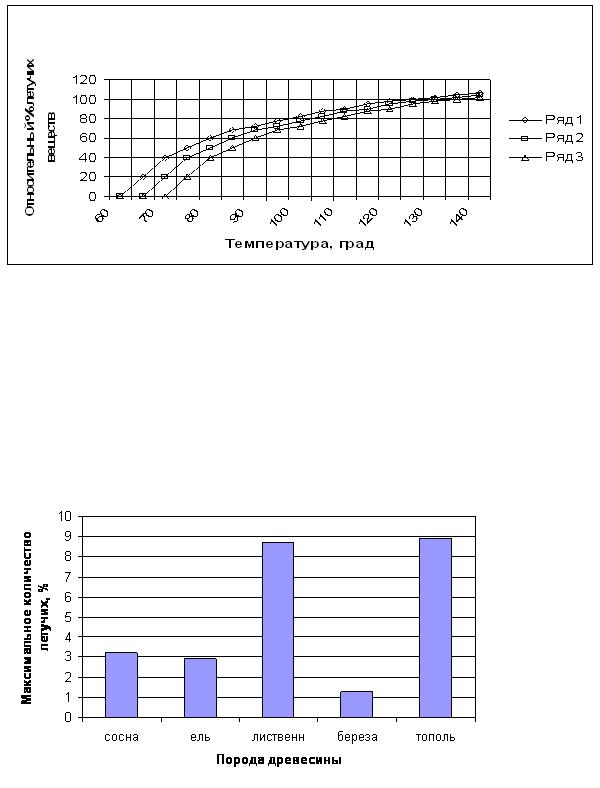
состав удаляемых летучих из древесины при сушке в литературе не описаны. Можно предположить, что качественная картина будет повторять известные данные по изменению прочности древесины в процессе сушки. На рисунке 1 изображена диаграмма относительных потерь летучих веществ из древесины при сушке.
Рисунок 1 – Диаграмма относительных потерь летучих веществ при сушке древесины
Ряд 1 – продолжительность теплового воздействия свыше 96 часов; Ряд 2 – продолжительность теплового воздействия свыше 48 часов; Ряд 3 – продолжительность теплового воздействия свыше 24 часов
Вполне понятно, что характер изменения потерь летучих веществ подобен только внешне.
За 100 % принята масса летучих веществ, максимально возможная для удаления, которое у различных пород древесины различно. Примерное количество их показано на диаграмме 2.. Выход летучих веществ может быть выше, чем 100 %, за счет продуктов начального термического разложения древесины.
Диаграмма 2 – Максимальное количество летучих веществ, которое может быть удалено при сушке

Вкачестве примера рассмотрим возможные выбросы в атмосферу летучих веществ для сушильных камер периодического действия в г. Красноярске. Выбросами в канализацию вместе с конденсатом можно пренебречь, ввиду их незначительности.
Внастоящее время в городе Красноярске, согласно метода экспертных оценок, насчитывается 14 действующих участков сушки, с общим объемом загрузки 5 530 м3. При высушивании условного пиломатериала, продолжительность сушки которого фактически
составит в среднем 9 – 11 дней, (исходная продолжительность 88 часов [РТМ]),
– 36. Общее количество высушиваемой древесины составит201 845 м3 в год, не считая иных способов сушки. Общее количество выбросов ориентировочно 14 129 – 42 387 кг или 14 – 42 т. органических веществ в год.
При кажущейся визуально незначительности выбросов из одной сушильной камеры, суммарная величина вредных выбросов достаточно для того, чтобы задуматься о данной проблеме.
ЛАБОРАТОРНАЯ РАБОТА №2 Определение содержание формальдегида в формальдегидосодержащих клеях
Цель работы: освоение сульфитного метода определения концентрации формальдегида в водном растворе.
На предприятиях деревообрабатывающей промышленности, занимаю-щихся синтезом карбамидоформальдегидных смол (КФС) и производством на их основе древесно-стружечных плит (ДСП), ежегодно образуется значитель-ное количество сточных вод, загрязненных формальдегидом, органическими и неорганическими соединениями, концентрации которых значительно превы-шают установленные для них ПДКв. В водных растворах формальдегид может находиться как в мономерном состоянии, так и в виде полимеров (полиок-симетиленов) общей формулы HO–(CH2–O–CH2–O)n– H.
Формальдегид обладает раздражающим, аллергенным, мутагенным, сенсибилизирующим, канцерогенным действиями, поражает центральную нерв-ную систему, легкие, печень, почки, органы зрения. Вследствие токсического воздействия на водные организмы содержание свободного формальдегида в по-верхностных водах нормируется.
Таким образом, определение концентрации формальдегида в сточных во-дах является весьма важной экологической задачей.
Таблица 16
Предельно допустимые концентрации (ПДКв) формальдегида в природных и питьевых водах
Объекты анализа |
ПДКв формальдегида, |
Нормативный документ |
|
|
мг/дм3 |
|
|
Водные объекты |
|
|
|
хозяйственно-питьевого и |
0,050 |
ГН 2.1.5.1315-03 |
|
культурно-бытового |
|||
|
|
||
водопользования (ПДКв) |
|
|
|
Водные объекты |
|
Приказ Росрыболовства N |
|
рыбохозяйственного |
0,010 |
||
20 от 18.01.2010 |
|||
значения (ПДКр.х.) |
|
||
|
|
||
Питьевая вода, |
0,025 |
СанПиН 2.1.4.2653-10 |
|
расфасованная в емкости |
|||
|
|
||
|
|
|
|
Вода централизованных |
|
|
|
систем питьевого |
0,050 |
СанПиН 2.1.4.1074-01 |
|
водоснабжения |
|
|
|
|
|
|
Формальдегид в водной среде определяют сульфитным титриметриче-ским методом
(рис. 9).

1 – бюретка
2 – штатив
3 – колба для титрования
4 – мерный цилиндр
5 – мерная колба
6 – индикатор
7 – емкость со сточной водой
Рис. 9. Лабораторная установка для сульфитного метода определения формальдегида В нейтральной среде между формальдегидом и сульфитом натрия проте-кает
реакция
|
H |
O |
| |
H – C + Na2SO3 + H2O |
H – C – OH + NaOH . |
H |
| |
|
SO3Na |
Количество выделившегося NaOH эквивалентно количеству прореагиро-вавшего формальдегида. Поэтому, определив концентрацию NaOH, можно оп-ределить концентрацию формальдегида. Для этого образовавшийся в результа-те реакции NaOH оттитровывают кислотой.
Необходимое оборудование и реактивы: стеклянная бюретка для титрования; мерный пальчик; колбы для титрования;
пипетки объемом 10 мл;
1 М раствор сульфита натрия Na2SO3;
0,1 М раствор соляной кислоты HCl; индикатор тимолфталеин.
Ход работы
Следует определить концентрацию формальдегида в пяти колбах с рабо-чими растворами. Для анализа в колбу для титрования помещают 10 мл иссле-дуемого раствора формальдегида, добавляют мерным пальчиком избыток сульфита натрия. Количество сульфита натрия (Na2SO3) определяют по табли-це 17, исходя из концентрации формальдегида (НСОН). Затем в колбу добав-ляют две капли индикатора тимолфталеина. Раствор приобретает голубой цвет. Через одну минуту оттитровывают пробу 0,1 М раствором соляной кислоты до исчезновения голубой окраски. Анализ проводят два раза при хорошей сходи-мости результатов (не менее 90 %). При худшей сходимости раствор титруют третий раз.

Результаты титрования заносят в табл. 18. По трем опытам вычисляют среднее значение VHCl. Величину объема, пошедшего на титрование, подстав-ляют в уравнение
(11).
Таблица 17 Объем сульфита натрия для определѐнной концентрации
раствора формальдегида
|
|
Объем раствора |
|
Концентрация раствора |
|
Объем 1 М раствора Na2SO3, |
|
||||||||||||||||
|
формальдегида, взятого для |
|
|
формальдегида, |
к,, % |
|
необходимый для реакции с |
|
|||||||||||||||
|
|
анализа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
формальдегидом, мл |
|
||||
|
|
|
10 |
|
|
|
|
|
|
0,125 |
|
|
|
|
|
|
|
3 |
|
|
|||
|
|
|
10 |
|
|
|
|
|
|
0,25 |
|
|
|
|
|
|
|
|
7 |
|
|
||
|
|
|
10 |
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
7 |
|
|
||
|
|
|
10 |
|
|
|
|
|
|
0,75 |
|
|
|
|
|
|
|
|
10 |
|
|
||
|
|
|
10 |
|
|
|
|
|
|
1,00 |
|
|
|
|
|
|
|
|
15 |
|
|
||
|
|
|
10 |
|
|
|
|
|
|
1,25 |
|
|
|
|
|
|
|
|
15 |
|
|
||
|
|
|
|
– контрольная концентрация раствора формальдегида, выданного |
|||||||||||||||||||
|
студенту преподавателем. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Таблица 18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Результаты определения формальдегида в пробах сточной воды |
|
|
||||||||||||||||||||
|
с различной концентрацией |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
№ |
№ |
Объем сточной |
|
|
Объем |
|
|
Среднее значение |
|
Концентрация |
||||||||||||
|
колбы |
пробы |
воды для анализа |
|
титранта VHCl, |
|
|
VHCl, мл |
|
|
формальдегида в СВ, э |
||||||||||||
|
|
|
|
|
|
|
|
|
|
мл |
|
|
|
|
|
|
|
|
|
, % |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание: |
э |
– экспериментально определенная |
концентрация |
раствора |
||||||||||||||||||
|
формальдегида; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
СВ – сточные воды. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Концентрацию формальдегида в сточных водах |
( |
– |
массовую |
долю, %) |
|||||||||||||||||
|
вычисляют на основании формул (5) – (11) |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
mформ. |
|
100 % , |
|
|
|
|
|
|
|
(5) |
|
|||||
|
|
|
|
э |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
mпробы |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Так как плотность раствора формальдегида |
р-ра ф-да |
~ 1 г/мл, то |
|
|
|||||||||||||||||
|
|
mпробы = Vпробы |
р-ра ф-да = 10 г. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Массу формальдегида mф-да |
определяют из выражения для нормальной |
||||||||||||||||||||
|
концентрации: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH (ф да ) |
|
|
mф да |
|
1000 , |
|
|
|
|
|
(6) |
|
|||||||
|
|
|
|
|
Эф да Vф да |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
где СН( ф-да) – нормальная или эквивалентная концентрация, моль-экв/л; |
|
|
||||||||||||||||||||
|
Эф-да – масса эквивалента, г/моль; |
|
Vф-да – объем раствора, мл. |
|
|
|
|
||||||||||||||||
|
|
|
|
m |
|
СН (ф да ) Vф да Эф да |
, |
|
|
|
|
|
|
||||||||||
|
|
|
|
ф да |
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(7)
Эф-да = 30 г/моль.
