
3664
.pdf
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования “Воронежская государственная лесотехническая академия”
А.Д. Колешня, А. И. Дмитренков, С.С. Никулин
лабораторный практикум
Воронеж 2010
УДК 547(076.5)
Колешня, А. Д. Органическая химия [Текст] : лаб. практикум / А. Д. Колешня, А. И. Дмитренков, С. С. Никулин ; Фед. агентство по образованию, ГОУ ВПО «ВГЛТА». – Воронеж, 2010. – 40 с.
Лабораторный практикум предназначен для студентов I курса лесохозяйственного факультета и факультета ТДО ВГЛТА и включает 9 лабораторных работ по органической химии, составленных в соответствии с Государственным образовательным стандартом специальностей 250201, 250203, 250303
и 080502.
Табл.: 1. Ил.: 6. Библиогр.: 4 наим.
Печатается по решению редакционно-издательского совета ВГЛТА
Рецензенты: кафедра химии Воронежского государственного аграрного университета; канд. хим. наук, доц. А. И. Щербань
УДК 547
©А. Д. Колешня, А. И. Дмитренков, С. С. Никулин, 2007
©Воронежская государственная лесотехническаяакадемия, 2007
Учебное издание
Колешня Алла Давидовна Дмитренков Александр Иванович Никулин Сергей Саввович
О р г а н и ч е с к а я х и м и я Лабораторный практикум
|
|
|
Редактор |
|
|
Темплан 2007 г. |
|
|
Оригинал-макет – И. В. Сазыкина |
||
|
|
|
|
|
|
Подписано в печать 28.01.10 Формат |
60х84 |
1/16 . |
Объем 2,5 п.л. |
||
Усл.п.л. 2,5 |
Уч.-изд. л. 2,49 |
|
Тираж 300 |
экз. |
Заказ № 47 |
РИО ГОУ ВПО «ВГЛТА». 394613, г. Воронеж, |
ул. Тимирязева, 8. |
|
|
||
Отпечатано в ИП Хасанова И.Б. 394087, |
г. Воронеж, ул. Ломоносова, 87. |
|
|||
2
ВВЕДЕНИЕ
Изучение органической химии при подготовке специалистов лесного хозяйства в деревообрабатывающей промышленности имеет особое значение. Курс «Органическая химия» является фундаментом для изучения биологии, физиологии растений. Все живое построено из органических веществ, составляющих основу жизнедеятельности, представляет собой превращения органических соединений. Органическая химия дает лесному хозяйству удобрения, средства борьбы с сорняками (гербициды), насекомыми и грибками (инсектофунгициды), ускорители роста растений и др.
Специалистам, работающим в области деревообработки, постоянно приходится иметь дело с различными растворителями, моющими и полировочными веществами и составами, красителями, отделочными, декоративными покрытиями для мебели, пластмассовой фурнитурой и полимерными конструкционными материалами. Изучение органической химии необходимо для понимания химии высокомолекулярных соединений, которая, в свою очередь, служит базой для таких спецкурсов, как «Технология клеевых материалов», «Отделка древесины» и др.
Лабораторный практикум включает в себя экспериментальные работы по всем основным классам органических соединений и ставит своей задачей закрепление теоретического материала, освоение основных приемов и методов работы с органическими веществами, качественное и количественное определение функциональных групп органических соединений.
Студент, получивший допуск к лабораторной работе, выполняет опыты по теме, оформляет работу в тетради по следующей форме:
1)тема работы;
2)название опыта;
3)химизм опыта: уравнения реакций;
4)вывод: что наблюдалось и объяснение причины явления.
Зачет по лабораторной работе сдается преподавателю, при этом студент должен уметь ответить на вопросы по данной теме.
3
Техника безопасности при выполнении лабораторных работ
Перед лабораторной работой изучите теоретический раздел и описание лабораторной работы. Покажите преподавателю конспект теоретической и практической части лабораторной работы. Сдайте преподавателю допуск для проведения лабораторной работы.
Уясните технику выполнения лабораторной работы.
Всоответствии с техникой безопасности запрещается:
брать реактивы больше требуемого количества;
неизрасходованные или взятые в избытке реактивы возвращать обратно в склянки (их надо сдать лаборанту);
загромождать рабочее место (во время работы на лабораторном столе должны находиться только необходимые приборы, реактивы и лабораторная тетрадь);
уносить приборы, реактивы общего пользования на свое рабочее место.
путать пробки от склянок.
принимать пищу в химической лаборатории.
Необходимо выполнять следующие требования.
Перед началом работы следует ополоснуть чистую посуду дистиллированной водой над раковиной, затем при необходимости высушить её.
После окончания работы следует тщательно вымыть посуду, кюветы и вытереть фильтровальной бумагой корзину для кювет.
Склянки и реактивы должны находиться в определенном месте, их нельзя переносить на другие столы.
Следует работать без лишней торопливости, не проливать и не просыпать реактивы, если все же это случилось, нельзя сливать загрязненный реактив обратно в склянку с чистым реактивом, а следует собрать его и передать лаборанту; стол (или другой запачканный предмет) нужно вымыть и вытереть.
4
Бросать бумагу, бытовое стекло и другие предметы можно только в специальные сосуды и мусорницы.
Если во время работы будет пролита в большом количестве кислота или другой раствор, нужно тотчас сообщить о случившемся лаборанту.
Удалять растворы нужно быстро, так как эти реактивы портят стол и другие предметы, и осторожно, чтобы не прожечь одежду и не повредить руки.
При всех несчастных случаях необходимо тотчас обращаться к лаборанту или преподавателю.
При работе с электроприборами необходимо соблюдать следующие правила.
1Работу с приборами можно начинать только после тщательного ознакомления с инструкцией по их эксплуатации.
2Включать приборы только в сеть переменного тока с напряжением 220 В.
3Электроприборы должны располагаться на лабораторном столе таким образом, чтобы химические реактивы не попадали на них, а также в электрическую розетку.
4Если произошло замыкание электроустановки или возник пожар, необходимо немедленно обесточить прибор. Тушить пожар следует песком и огнезащитной тканью.
5Приборы должны иметь рабочую изоляцию, элемент для заземления.
6В электроприборах имеются элементы, находящиеся под напряжением, поэтому запрещается самостоятельно вскрывать и ремонтировать их, а также работать с неисправными приборами.
7После окончания работы необходимо отключить прибор от сети.
5
Лабораторная работа № 1
АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Органическая химия – это химия углеводородов и их производных. Поэтому успешное изучение всего курса органической химии имеет своим фундаментом глубокое усвоение строения и свойств углеводородов: алканов, алкенов, алкинов и алкадиенов. Лабораторная работа по этой теме ставит своей целью изучение способов получения предельных и непредельных углеводородов и проведение реакций, показывающих различие их свойств. Студентам следует обратить внимание на особенности простой, двойной и тройной связей между атомами углерода, сопоставив строение молекул и их свойства. Уясните также генетическую взаимосвязь между алканами, алкенами и алкинами, рассмотрев способы их превращения друг в друга.
При выполнении лабораторной работы необходимо соблюдать правила техники безопасности. Помните, что смесь этилового спирта с концентрированной серной кислотой (опыт 2) вызывает ожоги так же, как серная кислота, и работа с ней требует особого внимания и аккуратности; что ацетилениды металлов (опыт 3 в, г)- взрывчатые вещества, и подсушивать их нужно очень осторожно.
Опыт 1 Получение метана и изучение его свойств
Всухую пробирку А (рис. 1) помещают около 0,5 г смеси, состоящей из одной части обезвоженного уксуснокислого натрия и двух частей натронной извести. Пробирку закрывают пробкой с газоотводной трубкой. Содержимое нагревают. Выделившийся метан пропускают в течение не более одной минуты в пробирку с марганцовокислым калием (В). Обесцвечивания не наблюдается. Затем быстро пропускают метан в бромную воду, которая тоже не обесцвечивается. Объясняется это тем, что при обычных условиях предельные углеводороды обладают малой химической активностью и не вступают в реакцию с бромной водой и с окислителями.
Вконце опыта газоотводную трубку заменяют другой, с оттянутым кончиком, и, продолжая нагревание, осторожно зажигают газ.
Метан горит голубоватым несветящимся пламенем.
6

Рис.1 Прибор для получения метана
Напишите уравнения следующих реакций:
1)получения метана путем сплавления уксуснокислого натрия с натронной известью;
2)горения метана.
Опыт 2 Получение этилена и изучение его свойств
В лаборатории этилен получают нагреванием этилового спирта с концентрированной серной кислотой:
СН3–СН2ОН + НОSО2ОН → Н2О + СН2OSO2OH
CH3
При нагревании выше 170 оС этилсерная кислота расщепляется на этилен и серную кислоту:
CH2 CH3–СН2ОSO2OH → + H2SO4
CH2
В пробирку А (рис. 2) помещают кусочек пемзы и наливают около 1 мл заранее приготовленной смеси, состоящей из одной части этилового спирта и трех частей концентрированной серной кислоты (этилсерная кислота). Про-
7
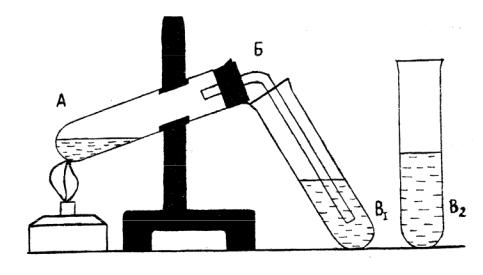
бирку закрывают пробкой с газоотводной трубкой и осторожно нагревают. Выделяющейся газ пропускают в заранее приготовленные пробирки, содержащие по 5-6 капель бромной воды (В1) и разбавленного раствора марганцовокислого калия (В2).
Рис. 2 Прибор для получения этилена
Что наблюдается? Напишите уравнения реакции бромирования этилена и окисления его марганцовокислым калием.
Опыт 3 Получение ацетилена и изучение его свойств
Ацетилен обычно получают действием воды на карбид кальция в приборе (рис.2) без спиртовой горелки.
Напишите уравнение реакции получения ацетилена из карбида кальция. В четыре пробирки раздельно вносят по 10-12 капель следующих растворов: в первую – раствор брома в воде (бромную воду), во вторую – розовый раствор марганцовокислого калия, в третью – аммиачный раствор однохлористой меди Сu (NН3)2СI и в четвертую – аммиачный раствор оксида серебра Ag(NH3)2OH. Во все пробирки быстро пропускают ацетилен из газоотводной
трубки Б:
8
а) бромная вода обесцвечивается в результате присоединения брома по месту разрыва тройной связи; напишите уравнение реакции;
б) розовая окраска марганцовокислого калия быстро исчезает вследствие окисления ацетилена
CH ≡ CH + 5 [O] → 2CO2 +H2O
и восстановления перманганата калия до оксида марганца (IV)
3СН≡СН + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O;
в) в третьей пробирке образуется ацетиленид меди красного цвета; напишите уравнение реакции. К какому типу органических реакций она относится? В сухом виде ацетиленид меди взрывается при ударе или нагревании. Эта реакция может применяться для открытия следов ацетилена в воздухе помещений, где работают с ацетиленом;
г) в четвертой пробирке образуется осадок ацетиленида серебра бледножелтого цвета; напишите уравнение реакции.
Опыт 4 Получение йодоформа
Получение йодоформа основано на реакции
C2H5OH + 4I2 +6 NaOH → CHI3 + HCOONa + 5 NaI + 5 H2O
В конической колбе растворяют около 1 г NaOH в 20 мл воды, добавляют 10 мл этилового спирта. Полученную смесь нагревают на водяной бане до 60-65 оС и осторожно, небольшими порциями при перемешивании прибавляют 3,0 г йода. При этом наблюдается исчезновение бурой окраски йода. В дальнейшем при медленном охлаждении реакционной массы наблюдается выпадение чистых кристаллов йодоформа.
9

Лабораторная работа № 2
АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
Алициклические углеводороды во многом повторяют свойства алифатических углеводородов с открытой цепью. Но отличительной их особенностью являются реакции присоединения за счет раскрытия цикла. Эти реакции протекают тем легче, чем менее устойчив цикл. В свою очередь устойчивость цикла определяется его строением, а именно: 1) отклонением валентного угла от 109о 28' и 2) конформацией цикла, т. е. пространственным расположением атомов.
Особое место среди циклических углеводородов занимают циклические терпены, то есть углеводороды состава С10Н16. Они широко распространены в природе и встречаются в смоле хвойных растений и многих эфирных маслах. Циклические терпеновые углеводороды подразделяются на:
•моноциклические – содержащие один шестичленный цикл и две двойные углерод-углеродные связи;
•бициклические – содержащие два конденсированных цикла (один шестичленный, а второй трех- ; четырехили шестичленный) и одну двойную углерод-углеродную связь;
•трициклические – содержащие три конденсированных цикла.
Вданной лабораторной работе вы изучите свойства пинана и α-пинена. Пинан в природе встречается и получается в промышленных условиях гидрированием α-пинена.
|
|
СН3 |
|
|
|
|
СН3 |
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
С |
|
|
|
|
|
|
СН |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2С |
|
|
|
|
|
СН |
+ Н2 |
Н2С |
|
|
|
|
|
|
СН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Н3С–С–СН3 |
Н3С–С–СН3 |
|||||||||||||||
|
||||||||||||||||
Н2С |
|
|
|
|
|
СН2 |
|
Н2С |
|
|
|
|
|
|
СН2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН |
|
|
|
|
|
СН |
|
|||||||
|
α-пинен |
|
|
пинан |
||||||||||||
α-пинен – основной компонент скипидара, являющегося основной частью живицы – смолы сосны.
10
