
3285
.pdf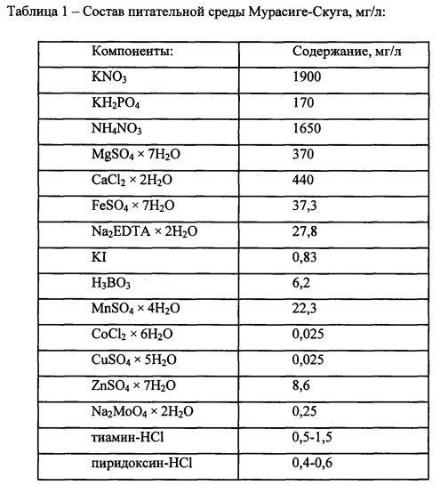
Основные компоненты питательной среды:
-Макроэлементы;
-Микроэлементы;
-Витамины;
-Углеводы;
-Агар;
-Фитогормоны и их синтетические аналоги.
В настоящее время известно большое количество питательных сред, различающихся по составу. Наиболее часто применяемая при выращивании изолированных тканей в условиях in vitro – среда Т. Мурасиге и Ф. Скуга, впервые составленная в 1962 году. Эта среда содержит хорошо сбалансированный состав питательных веществ и отличается от других, как правило, соотношением аммонийного и нитратного азота.
Для обеспечения процесса выращивания микроорганизмов необходимо иметь в составе питательной среды в определенном количестве источники углерода, азота, фосфора, витаминов, макро - и микроэлементов.
Для роста микроорганизмов, окисляющих газообразные углеводороды, необходимо наличие в составе питательной среды источников азота, фосфора, микроэлементов и других ростовых веществ. Наиболее универсальной и часто используемой в биотехнологии является питательная среда Мурасиге-скуга (табл. 1).
11
Оборудование: Химические стаканы (50, 100, 250 мл), штативы с пробирками, инструменты (пинцеты, скальпели, ножницы, препарировальные иглы), моющие средства (стиральный порошок), соли макро и микроэлементов.
Ход работы:
1.Изучить и записать минеральный состав питательной среды МС.
2.Изучить внешний вид солей и записать.
3.Приготовить маточный раствор макросолей МС:
Взять чистую посуду, взвесить необходимое количество солей, растворить в определѐнной последовательности. Фильтровать, перемешать, остудить, убрать в холодильник.
Вопросы и задания для самоконтроля
1.Какие макро и микроэлементы используют при приготовлении питательных сред?
2.Какую роль играют макро и микроэлементы в развитии растений?
ЛАБОРАТОРНАЯ РАБОТА №3
Фитогормоны в биотехнологии растений. Приготовление растворов.
ЦЕЛЬ: Изучить фитогормоны, используемые в биотехнологии растений, научиться приготавливать растворы.
Общие сведения.
Основную роль при подборе оптимальных условий культивирования эксплантов играют соотношение и концентрация внесенных в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов—ИУК и НУК в концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей на питательных средах с повышенным содержанием цитокининов (5—10 мг/л) происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к появлению токсического действия и формированию растений с измененной морфологией. Вместе с тем, возможно наблюдать такие нежелательные для клонального микроразмножения эффекты, как подавление пролиферации пазушных меристем, образование витрифицированных (оводненных) побегов и уменьшение способности растений к укоренению. Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования
12
питательных сред с минимальной концентрацией цитокининов, обеспечивающих стабильный коэффициент микроразмножения, или путем чередования циклов культивирования на средах с низким и высоким уровнем фитогормонов.
В качестве ауксинов используют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), a-нафтилуксусную кислоту (НУК), индолил-масляную кислоту (ИМК), индолилуксусную кислоту (ИУК) в концентрации 0,5 - 10 мг / л, в зависимости от вида экспланта.
Оборудование и реактивы: Химические стаканы (50, 100, 250 мл),
штативы с пробирками, моющие средства (стиральный порошок), весы, шпатель, спирт этиловый, дистилированная вода, фитогормоны БАП, ИУК, НУК, ИМК, Кинетин, Гиббереллин.
Ход работы
1.Изучить и записать виды фитогормонов.
2.Изучить внешний вид фитогмонов.
3.Приготовить растворы фитогормонов:
Взять чистую посуду, взвесить необходимое количество фитогормонов, растворить. Остудить, убрать в холодильник.
Вопросы и задания для самоконтроля
1.Какие фитогормоны используют в биотехнологии растений?
2.Какую роль играют фитогормоны в развитии и росте растений?
3.Как фитогормоны используются при культивировании растений?
ЛАБОРАТОРНАЯ РАБОТА №4
Клональное микроразмножение: состав и приготовление питательных сред. Отбор и стерилизация эксплантов, введение. Микроразмножение растений. Укоренение растений in vitro. Переведение растений в закрытый грунт для адаптации
Цель: изучение основных этапов микроклонального размножения растений в культуре тканей.
Опыт 1 Клональное микроразмножение:
состав и приготовление питательных сред.
Материалы и оборудование. Химические стаканы, колбы, мерные цилиндры от 5 мл до 2 л, пробирки, пипетки от 0,01 мл до 10 мл или дозаторы, весы аналитические до 500 г, весы торсионные до 100 мг, пинцеты, ножницы, шпатели, электроплитки, магнитные мешалки, химические
13
реактивы или готовые маточные растворы макро- и микросолей, витаминов, фитогормонов.
Ход работы.
1.В химический стакан емкостью 2 л поместить 20 г сахарозы, долить дистиллированной водой до 400 мл и растворить.
2.Добавить к раствору сахарозы 50 мл маточного раствора макросолей,
1мл микросолей, 5 мл хелата железа, 5 мл хлористого кальция.
3.Приготовить агар: навеску 7 г поместить в стакан и залить водой до
200мл, растворить, нагревая плитке или газовой горелке, при постоянном помешивании. Готовый агар долить к раствору солей.
4.Питательную среду довести до нужного объема (1 л) дистиллированной водой. Измерить pH среды: если pH превышает 5,5-6,0 добавить несколько капель 0,1 н HCl, если ниже этого значения – 0,1 н КОН.
5.Готовую питательную среду разлить в колбы, около 25мл, закрыть их фольгой.
6.Поместить колбы в автоклав и проавтоклавировать.
7.Металлические инструменты завернуть в плотную бумагу и поместить в сушильный шкаф для стерилизации сухим жаром при to 170200oС в течение 2 часов.
8.Чашки Петри, колбы с питательной средой, вату, марлю, фильтровальную бумагу, колбы с дистиллированной водой (закрытые фольгой) поместить в автоклав.
9.Автоклав привести в рабочее состояние: закрыть плотно крышку, воду залить до метки. Включить автоклав, 1,2 атм. (в паровой камере),
заполнить паром стерилизационную камеру, вытеснить конденсат в течении 10 минут, при этом давление пара в стерилизационной камере должно быть на уровне 0,1-0,2 атм. Довести давление в стерилизационной камере до 1 атм., включить автоматический режим.
10.Автоклавировать 20 минут при давлении в стерилизационной камере 1-1,2 атм.
11.Отключить автоклав, вытеснить пар из обеих камер довести давление до 0 атм.
12.Проавтоклавированные материалы перенести.
Опыт 2 Отбор и стерилизация эксплантов, введение
Основные сведения.
14
В культуре тканей можно размножать растения и получать оздоровленный (безвирусный) посадочный материал. Для оздоровления растений используют культуру апексов или культуру апикальных меристем, так как в стеблевой апекс вирусы проникают медленнее, чем в другие части растений. При культивировании апексов размножение вирусов подавляется реакцией растительного организма на травму, вызванную отсечением верхушки. В in vitro используются апексы верхушечных и боковых почек (точек роста), кончиков корней (особенно проростков). Апикальная меристема — группа меристематических (образовательных) клеток, организованных в ростовой центр, занимающая терминальное положение в побеге или корне и обеспечивающая образование всех органов и первичных тканей. Верхняя часть апикальной меристемы представлена инициалями (единственной клеткой — у хвощей и многих папоротников и многоклеточной структурой — у семенных растений). Ближайшие производные инициальных клеток часто выделяют в зону протомеристемы. Вслед за ней лежат ткани, уже частично дифференцированные, но всѐ ещѐ находящиеся в меристематическом состоянии, которые относят к частично детерминированной первичной меристеме. В зависимости от производимых ею систем тканей детерминированная меристема включает следующие клеточные комплексы: тунику, образющую в дальнейшем первичную покровную ткань (эпидермис) и часть первичной коры, и корпус, клетки которого постепенно формируют комплекс проводящих тканей (центральный цилиндр); в корне — дерматоген, дифференцирующийся в первичную покровную ткань (ризодермис); периблему — будущую первичную кору; плерому — центральный цилиндр. Таким образом, будущий ход развития меристематических тканей частично детерминирован уже самим размещением их в апексе побега и корня. Обычно на питательные среды высаживают небольшую часть меристемы до 0,5 мм. В целом закономерность такова: чем меньше величина меристемы, тем больше вероятность получения безвирусных растений. Ее выделение осуществляется
вламинар-боксе с использованием препаравальных инструментов под увеличением бинокулярного микроскопа.
Материалы и оборудование. Химические стаканы, колбы, мерные цилиндры от 5 мл до 2 л, пробирки, пипетки от 0,01 мл до 10 мл или дозаторы, весы аналитические до 500 г, весы торсионные до 100 мг, пинцеты, ножницы, шпатели, электроплитки, магнитные мешалки, питательные среды
вкультуральных сосудах, ламинарные боксы, растения, стерилизующие агенты.
Ход работы.
15
1. Взять растения с живыми меристемами и молодыми листьями (бегония). Отделить экспланты, провести стерилизацию.
2. Стерилизованные экспланты (на стерильной чашке Петри) поместить в ламинар-бокс.
3. Препаровальной иглой (режущие иглы от шприца) изолировать апикальную меристему (конус) на 12-13 пластохроне (промежуток времени между инициациями двух листовых бугорков) и перенести на стерильную среду.
Изолированные меристемы культивируют в асептических условиях на питательных средах с богатым содержанием макро- и микросолей, с повышенной концентрацией цитокининов (6-БАП 2 мг/л). В культуральной комнате с кондиционированным воздухом поддерживают температуру 25±2оС, влажность воздуха 70 %, освещенность 5 кLx и фотопериод 16 часов. В среднем от посадки меристемы на среду до формирования проростков с 5-6 листочками проходит 30-45 дней, в некоторых случаях от 2 до 8 месяцев. Среды по мере истощения обновляют, и проростки периодически пересаживают на новые среды в стерильных условиях.
Опыт 3 Микроразмножение растений.
Материалы и оборудование. Питательные среды в культуральных сосудах, ламинарные боксы, пинцеты, скальпели, стерилизаторы, стерильная бумага и вата.
Ход работы.
1.Подготовить ламинар-бокс и инструменты к работе.
2.В ламинаре извлечь стерильные проростки из колб.
3.Побеги разделить на микрочеренки (междоузлие с почкой) и посадить в питательную среду на глубину междоузлия.
4.Колбу закрыть пленкой и перенести в культуральную комнату.
5.Результаты зарисовать через 2-4 недели.
6.Сделать выводы о степени пролиферации почек различных растительных культур.
Опыт 4 Укоренение растений in vitro.
Материалы и оборудование. Питательные среды в культуральных сосудах, ламинарные боксы, пинцеты, скальпели, стерилизаторы, стерильная бумага и вата.
Ход работы.
16
1.Подготовить ламинар-бокс и инструменты к работе.
2.В ламинаре извлечь стерильные проростки из колб.
3.Побеги разделить на микрочеренки (междоузлие с почкой) и посадить в питательную среду для укоренения на глубину междоузлия.
4.Колбу закрыть пленкой и перенести в культуральную комнату.
5.Результаты зарисовать через 2-4 недели.
6.Сделать выводы о степени укоренения различных растительных
культур.
Опыт 5 Переведение растений в закрытый грунт для адаптации
Материалы и оборудование. Укоренившиеся микроклоны растений в условиях культуры тканей, теплица, технологические горшки с питательным субстратом, пинцеты, пульверизатор, полиэтиленовая пленка.
Ход работы.
1.Пролить субстрат теплой водой.
2.Извлечь пинцетом из культуральных сосудов микроклоны.
3.Отмыть корни от питательной среды.
4.Посадить микроклон в субстрат.
5.Обработать водой из пульверизатора.
6.Накрыть пленкой.
7.Результаты записать через 2-3 недели.
8.Сделать выводы о приживаемости микроклонов растений в условиях закрытого грунта.
Вопросы для самоконтроля
1.Каковы основные этапы микроклонального размножения растений?
2.Как готовить питательную среду?
3.Опишите процесс микроклонирования растений.
ЛАБОРАТОРНАЯ РАБОТА №5 Получение каллусной ткани в условиях in vitro
Цель: научиться получать каллусы в условиях культуры тканей растений.
Основные сведения.
Основным типом культивируемой растительной клетки является каллус. Каллусная ткань - один из видов клеточной дифференцировки, возникает путем неорганизованной пролиферации дедифференцированных клеток органов растения. У растений в природе каллусная ткань возникает в исключительных обстоятельствах (например, при травмах) и функционирует
17
непродолжительное время. Эта ткань защищает место поранения, может накапливать питательные вещества для анатомической регенерации или регенерации утраченного органа.
Образование каллуса не всегда связано с травматическим воздействием. Каллус может возникнуть и в результате пролиферации внутренних тканей экспланта без связи с поверхностью среза из-за нарушения гормонального баланса. Растущий каллус разрывает слои ткани и развивается на поверхности. Для получения культивируемых каллусных клеток фрагменты тканей различных органов высших растений - корней, листьев, стеблей, пыльников, зародышей (эксплан-ты) помещают на искусственную среду, содержащую ауксины, в пробирки, колбы, чашки Петри (in vitro).
В качестве ауксинов используют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), a-нафтилуксусную кислоту (НУК), индолил-масляную кислоту (ИМК), индолилуксусную кислоту (ИУК) в концентрации 0,5 - 10 мг / л, в зависимости от вида экспланта.
Процессу образования каллуса предшествует дедифференцировка тканей экспланта. При дедифференцировке ткани теряют структуру, характерную для их специфических функций в растении, и возвращаются к состоянию делящихся клеток. Если эксплант, используемый для получения каллуса, является фрагментом органа, то имеет в своем составе эпидермальные клетки, клетки камбия, сосудистой системы, сердцевинной и первичной коровой паренхимы. Преимущественно пролиферируют клетки камбия, коры, сердцевинной паренхимы.
Различное тканевое происхождение каллусных клеток является одной из причин гетерогенности каллусной ткани, так как некоторые функциональные особенности исходных клеток передаются в ряду клеточных поколений как стойкие модификации. В качестве примера можно привести процессы, происходящие при дедифференцировке апикальной меристемы стебля. После помещения на питательную среду меристемы стебля томатов отмечено прекращение митоза, клетки увеличиваются в размерах, теряют характерную для меристематической ткани форму, изменяется структура ядра и цитоплазмы. В готовящейся к делению клетке возрастает синтез всех форм РНК, исчезают тканеспецифичные белкиантигены и появляются белки, специфичные для делящихся клеток и для каллусной ткани. Эти наблюдения свидетельствуют об изменениях в активности генов и белкового аппарата клетки при дедифференцировке.
Активаторами матричной активности ДНК хроматина или активности РНК–полимеразы являются фитогормоны. Рецепторные для фитогормонов
18
белки, локализованные в мембранах, по-видимому, оказывают влияние в присутствии фитогормонов на структуру и функцию мембран. Возможно, это обуславливает действие фитогормонов на генную активность.
Одним из важнейших гормонов, применяемых при культивировании in vitro является ауксин, который активирует деление и растяжение клеток. Проникая в клетки, ИУК связывается со специфическими рецепторами, оказывая влияние на функциональную активность мембран, полирибосом и работу ядерного аппарата. Установлено, что в плазмалемме ауксин индуцирует работу Н+-помпы, в результате чего матрикс клеточных стенок размягчается, что является необходимым условием для роста и растяжения клеток. Включенная Н+-помпа усиливает поглотительную активность тканей, обогащенных ауксином. Предполагается, что поступление ауксина в клетку способствует усилению секреции кислых гидролаз и полисахаридов, необходимых для дальнейшего роста клеточных стенок. Под влиянием ауксина уменьшается продолжительность различных периодов митотического цикла. Так, предполагается, что уменьшается продолжительность периода удвоения числа клеток, продолжительность S - периода, G1 - периода. Все это приводит к значительному ускорению темпов размножения клеток.
Общим моментом в действии ауксинов на деление клеток является также предварительное усиление синтеза и накопление РНК. Стимулирующее действие ауксинов на синтез РНК может быть связано с восстановлением клеток после голодания перед их вхождением в митотический цикл, но может быть также приурочено к прохождению клетками этапов митотического цикла. Особенно отчетливо необходимость синтеза РНК проявляется при прохождении клетками G1 - периода. Под влиянием ауксина усиливается синтез р-РНК, но имеет место и появление новых информационных РНК, причем на очень ранних этапах действия.
Осуществление клетками подготовки к делению на всех этапах митотического цикла зависит от синтеза белков. Ауксин вызывает как общую стимуляцию их синтеза, так и появление новых белков. Это позволяет предположить существование в хроматине структурных генов, транскрипция которых специфически индуцируется ауксином. Реализация действия ауксина на хроматин и последующее деление осуществляется вследствие его проникновения в цитоплазму, образования комплекса с цитоплазматическим ауксиновым рецептором и воздействием этого комплекса на транскрипционную активность хроматина. Кроме этого ауксин усиливает окислительную и фосфорилирующую активность митохондрий, в результате чего улучшается энергетическое и субстратное обеспечение процессов
19
синтеза РНК и белков, репликация ДНК, а также осуществление самого митоза. Этот эффект обнаруживается очень рано и, как и синтез РНК, зависит от проникновения ауксина в клетку.
Для возбуждения процессов подготовки к делению достаточно начального кратковременного действия ауксина. Поэтому процессы, происходящие в клетках под влиянием ауксина, можно разделить на первичные, непосредственно индуцированные ауксином, и вторичные, являющиеся следствием первичного индуцирующего действия. Исходя из этого, можно предположить, что в митотическом цикле растительных клеток имеются кратковременные переходы, когда необходимо присутствие ауксина в клетках, и более продолжительные периоды, когда присутствие ауксинов в клетке не является необходимым.
Оборудование: Питательные среды в культуральных сосудах, ламинарные боксы, пинцеты, скальпели, стерилизаторы, стерильная бумага и вата, микроклоны в культуре тканей, спирт.
Ход работы.
1.Стерильным скальпелем вырезать часть листа с участком паренхимы: длиною 1,5-2 см, шириной 1 см.
2.Поместить экспланты на питательные среды (перед каждой манипуляцией инструменты обрабатывать спиртом и обжигать на пламени спиртовки).
3.Колбы с эксплантами перенести на стеллажи для индукций каллусогенеза при температуре 18 + 2о С.
4.Результаты зарисовать через 2-4 недели.
5.Через 2-4 недели стерильным пинцетом переложить каллусы на стерильную поверхность стола ламинар-бокса, разделить на кусочки 5х5 мм. и поместить в колбы с питательными средами, содержащими различные наборы фитогормонов.
6.Колбы перенести в культуральную комнату с температурой 18 + 2оС, влажностью воздуха 70 % и интенсивностью освещения 5кLх.
7.Результаты эксперимента зарисовать через 2-4-6-8 недель.
Вопросы для самоконтроля
1.Что такое каллус?
2.Как образуется каллусная ткань?
3.Какие питательные среды используют для каллусогенеза?
20
