
1497
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Воронежская государственная лесотехническая академия»
ХИМИЯ
Методические указания для аудиторной и самостоятельной работы бакалавров по направлению подготовки 250400 – Технология лесозаготовительных и деревоперерабатывающих производств
Воронеж 2012
2
УДК 546+547(075)
Бельчинская, Л. И. Химия [Текст] : методические указания для аудиторной и самостоятельной работы бакалавров по направлению подготовки 250400 – Технология лесозаготовительных и деревоперерабатывающих производств / Л. И. Бельчинская ; М-во образования и науки РФ, ФГБОУ ВПО «ВГЛТА». – Воронеж, 2012. – 24 с.
Печатается по решению учебно-методического совета ФГБОУ ВПО «ВГЛТА» (протокол № 2 от 25 ноября 2011 г.)
Рецензент д-р хим. наук В. Ю. Хохлов
3
1. ЦЕЛИ И ЗАДАЧИ ДИСЦИПЛИНЫ
Данные методические указания по дисциплине «Химия» предназначены для бакалавров по направлению подготовки 250400 – Технология лесозаготовительных и деревоперерабатывающих производств, профиль Технология деревообработки. Их особенность состоит в более фундаментальном характере изложения, имеет целью формирование у студентов целостного естественнонаучного мировоззрения.
При подготовке бакалавров необходимо учитывать современное состояние химической науки и требования, предъявляемые к бакалаврам технического профиля.
Врезультате освоения дисциплины «Химия» решаются следующие задачи:
1)углубление имеющихся представлений и получение новых знаний и умений в области химии, без которых невозможно решение современных технологических, экологических, сырьевых и энергетических проблем, стоящих перед человечеством;
2)использование основных понятий и законов химии в профессиональной деятельности;
3)владение методами экспериментального исследования в химии, а также методами обработки полученных результатов;
4)умение самостоятельно освоить теоретический материал и самостоятельно подготовиться к лабораторным занятиям;
5)применение полученных знаний для понимания:
–строения вещества, взаимосвязи состава, строения и свойств веществ;
–соотношения порядка и беспорядка в природе, упорядоченности в системах, взаимных переходах из упорядоченного в неупорядоченное состояние при изучении термодинамики в химических системах;
–свойств растворов неэлектролитов и электролитов;
–различий в реакционной способности веществ и скорости химических реакций;
–основных закономерностей окислительно-восстановительных электрохимических и коррозионных процессов.
4
2. ТРЕБОВАНИЯ К РЕЗУЛЬТАТАМ ОСВОЕНИЯ ДИСЦИПЛИНЫ «ХИМИЯ» С УЧЕТОМ ОСНОВНЫХ ОБРАЗОВАТЕЛЬНЫХ ПРОГРАММ БАКАЛАВРИАТА
Выпускник должен обладать следующими общекультурными (ОК) и профессиональными (ПК) компетенциями:
 владением культурой мышления, способностью к общению, анализу, восприятию информации, постановке цели и выбору путей ее достижения
владением культурой мышления, способностью к общению, анализу, восприятию информации, постановке цели и выбору путей ее достижения
(ОК-1);
 умением логически верно, аргументированно и ясно строить устную и письменную речь (ОК-2);
умением логически верно, аргументированно и ясно строить устную и письменную речь (ОК-2);
 готовностью к кооперации с коллегами, работе в коллективе (ОК-3);
готовностью к кооперации с коллегами, работе в коллективе (ОК-3);
 стремлением к саморазвитию, повышению своей квалификации и мастерства
стремлением к саморазвитию, повышению своей квалификации и мастерства
(ОК-6);
 умением критически оценивать свои достоинства и недостатки, наметить пути и выбрать средства развития достоинств и устранения недостатков
умением критически оценивать свои достоинства и недостатки, наметить пути и выбрать средства развития достоинств и устранения недостатков
(ОК-7);
 способностью осознавать социальную значимость своей будущей профессии, обладанием высокой мотивацией к выполнению профессиональной деятельности (ОК-8);
способностью осознавать социальную значимость своей будущей профессии, обладанием высокой мотивацией к выполнению профессиональной деятельности (ОК-8);
 использованием основных законов естественнонаучных дисциплин в профессиональной деятельности, применением методов математического анализа и моделирования, теоретического и экспериментального исследования
использованием основных законов естественнонаучных дисциплин в профессиональной деятельности, применением методов математического анализа и моделирования, теоретического и экспериментального исследования
(ОК-10);
 способностью использовать технические средства для измерения основных параметров технологического процесса, свойств сырья и изделий из древесины и древесных материалов (ПК-1).
способностью использовать технические средства для измерения основных параметров технологического процесса, свойств сырья и изделий из древесины и древесных материалов (ПК-1).
5
3. ОБЪЕМ ДИСЦИПЛИНЫ И ВИДЫ УЧЕБНОЙ РАБОТЫ
|
|
|
Таблица 1 |
|
|
|
|
|
|
Виды учебной работы |
Трудоемкость |
Семестр |
|
|
|
|
|
|
|
|
всего |
в зачетных |
I |
|
|
часов |
единицах |
|
|
|
|
|
||
|
|
|
|
|
Общая трудоемкость дисциплины |
108 |
3,0 |
108 |
|
|
|
|
|
|
Аудиторные занятия |
54 |
1,5 |
54 |
|
|
|
|
|
|
Лекции (Л) |
18 |
0,5 |
18 |
|
|
|
|
|
|
Лабораторные занятия (ЛР) |
36 |
1,0 |
36 |
|
|
|
|
|
|
Самостоятельная работа (Сам) |
54 |
0,5 |
54 |
|
|
|
|
|
|
Виды итогового контроля (зачет, экзамен) |
* |
* |
экзамен |
|
|
|
|
|
|
4.СОДЕРЖАНИЕ ДИСЦИПЛИНЫ
4.1.Разделы дисциплины и виды занятий
|
|
|
|
Таблица 2 |
||
|
|
|
|
|
|
|
№ п/п |
Разделы дисциплины |
Лекции |
ЛР |
|
Сам |
|
|
|
|
|
|
|
|
1 |
Введение. Основные понятия и законы химии |
2 |
2 |
|
4 |
|
|
|
|
|
|
|
|
2 |
Основные понятия химической термодинамики и |
2 |
6 |
|
8 |
|
|
кинетики |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Поверхностные явления |
2 |
6 |
|
8 |
|
|
|
|
|
|
|
|
4 |
Строение вещества |
4 |
4 |
|
8 |
|
|
|
|
|
|
|
|
5 |
Растворы |
4 |
12 |
|
16 |
|
|
|
|
|
|
|
|
6 |
Основы электрохимии. Коррозия и защита металлов |
4 |
6 |
|
10 |
|
|
|
|
|
|
|
|
|
Итого часов: |
18 |
36 |
|
54 |
|
|
|
|
|
|
|
|
|
Итого кредитов: |
0,5 |
1,0 |
|
1,5 |
|
|
|
|
|
|
|
|
4.2. Содержание разделов дисциплины
Раздел 1
Введение. Предмет химии. Понятие о материи и химической форме движения материи. Основные химические понятия и стехиометрические законы химии.
Раздел 2
Основные понятия химической термодинамики и химической кинетики. Химическое равновесие.
6
Раздел 3
Поверхностные явления. Фазовое равновесие. Поверхностно-активные вещества. Сущность процессов адгезии и когезии и их использование в технологии деревообработки.
Раздел 4
Строение атома. Периодическая система элементов. Химическая связь и строение простых молекул. Комплексные соединения.
Раздел 5
Дисперсные системы. Общие понятия о растворах. Коллигативные свойства растворов. Растворы электролитов. Идентификация химических веществ. Химический физико-химический и физический методы анализа. Коллоидные растворы.
Раздел 6
Окислительно-восстановительные свойства веществ. Электрохимические системы. Гальванические элементы. Топливные элементы. Электролиз. Аккумуляторы. Коррозия и защита металлических поверхностей.
|
|
4.3. Содержание лекций |
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
|
|
|
№ п/п |
№ раздела дисциплины |
|
Наименование лекций |
|
|
|
1 |
Раздел 1 |
Лекция 1. Введение. Понятие о материи и химической |
|
|||
|
|
форме движения материи. Основные стехиометрические |
|
|||
|
|
законы химии. |
|
|
|
|
2 |
Раздел 2 |
Лекция 2.Основные понятия химической термодинамики и |
|
|||
|
|
химической кинетики. Химическое равновесие. |
|
|
||
3 |
Раздел 3 |
Лекция 3. Поверхностные явления. Равновесие в |
|
|||
|
|
гетерогенных |
системах. |
Поверхностная |
энергия. |
|
|
|
Смачивание. Сущность процессов адгезии и когезии и их |
|
|||
|
|
использование в технологии деревообработки. |
|
|
||
|
|
|
|
|||
4 |
Раздел 4 |
Лекция 4, 5. Строение атома. Химическая связь и строение |
|
|||
|
|
простых молекул. |
|
|
|
|
5 |
Раздел 5 |
Лекция 6, 7. Дисперсные системы. Общие свойства растворов. |
|
|||
|
|
Коллигативные |
свойства |
растворов. |
Растворы |
|
|
|
электролитов. Идентификация и анализ химических |
|
|||
|
|
веществ. Коллоидные растворы. |
|
|
||
6 |
Раздел 6 |
Лекция 8, 9. Окислительно-восстановительные свойства |
|
|||
|
|
веществ. Электрохимические системы. Коррозия и защита |
|
|||
|
|
металлических поверхностей. |
|
|
|
|
7
5. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
|
|
|
|
|
Таблица 4 |
|
|
|
|
|
|
||
№ |
№ раздела |
№ |
Наименование лабораторных работ |
|
||
п/п |
дисциплины |
недели |
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
|
4 |
|
|
|
|
|
|
|||
1 |
Раздел 1 |
1 |
Техника безопасности. Основные классы неорганических |
|||
|
|
|
соединений. Контроль остаточных знаний |
|
||
|
|
|
|
|||
2 |
Раздел 2 |
2 |
Лабораторная работа № 1. Определение термодинамических |
|||
|
|
|
функций в химических процессах |
|
||
|
|
|
|
|||
3 |
Раздел 2 |
3 |
Лабораторная работа № 2. Определение скорости химической |
|||
|
|
|
реакции. Химическое равновесие. Смещение химического |
|||
|
|
|
равновесия |
|
|
|
|
|
|
|
|||
4 |
Раздел 3 |
4 |
Лабораторная работа № 3. Определение краевого угла |
|||
|
|
|
смачивания |
|
|
|
|
|
|
|
|||
5 |
Раздел 3 |
5 |
Лабораторная работа № 4. Адсорбция. Адсорбционное |
|||
|
|
|
равновесие |
|
|
|
|
|
|
|
|||
6 |
Раздел 1,2,3 |
6 |
Текущий контроль № 1 по темам «Основные понятия и законы |
|||
|
|
|
химии», «Основы химической |
термодинамики и кинетики», |
||
|
|
|
«Поверхностные явления» |
|
|
|
|
|
|
|
|||
7 |
Разделы 1,2,3 |
7 |
Проверка № 1 самостоятельной работы студентов – решение |
|||
|
|
|
7 задач |
|
|
|
|
|
|
|
|||
8 |
Раздел 4 |
8 |
Семинар по теме «Строение вещества. Межмолекулярные |
|||
|
|
|
взаимодействия» |
|
|
|
|
|
|
|
|||
9 |
Раздел 4 |
9 |
Коллоквиум по теме «Строение вещества. Межмолекулярные |
|||
|
|
|
взаимодействия». Проверка самостоятельной работы – решение |
|||
|
|
|
3 задач |
|
|
|
|
|
|
|
|
||
10 |
Раздел 5 |
10 |
Лабораторная работа № 5. Приготовление растворов |
|
||
|
|
|
|
|||
11 |
Раздел 5 |
11 |
Лабораторная работа № 6. Определение концентрации |
|||
|
|
|
приготовленных |
растворов |
титриметрическим |
и |
|
|
|
фотоколориметрическим методами |
|
||
|
|
|
|
|||
12 |
Раздел 5 |
12 |
Лабораторная работа № 7. Определение жесткости воды |
|||
|
|
|
титриметрическим методом |
|
|
|
|
|
|
|
|||
13 |
Раздел 5 |
13 |
Лабораторная работа № 8. Потенциометрическое определение |
|||
|
|
|
рН растворов. Гидролиз солей |
|
|
|
|
|
|
|
|||
14 |
Раздел 5 |
14 |
Текущий контроль № 2 по теме «Свойства растворов |
|||
|
|
|
неэлектролитов и электролитов» |
|
|
|
|
|
|
|
|||
15 |
|
15 |
Проверка № 2 самостоятельной работы студентов – решение |
|||
|
|
|
10 задач |
|
|
|
|
|
|
|
|
||
16 |
Раздел 6 |
16 |
Лабораторная работа № 9. Электролиз растворов |
|
||
|
|
|
|
|||
17 |
Раздел 6 |
17 |
Текущий контроль № 3 по темам «Электрохимия», «Коррозия и |
|||
|
|
|
защита металлов» |
|
|
|
|
|
|
|
|||
18 |
Раздел 6 |
18 |
Проверка № 3 самостоятельной работы студентов – решение |
|||
|
|
|
3 задач |
|
|
|
|
|
|
|
|
|
|
8
6. ВОПРОСЫ К ТЕКУЩЕМУ КОНТРОЛЮ ПО ХИМИИ
Контроль № 1 по теме «Основные понятия и законы химии. Общие закономерности
химических процессов. Поверхностные явления»
Вопросы к разделу «Основные понятия и законы химии»
1.Основные понятия химии: атом, молекула, моль, молярная масса, относительная атомная масса, относительная молекулярная масса.
2.Химические свойств кислот, оснований, солей, оксидов.
3.Основные стехиометрические законы химии: закон сохранения массы М.В. Ломоносова, закон эквивалентов И. Рихтера, закон постоянства состава Ж. Пруста, закон кратных отношений Дж. Дальтона, закон Авогадро, закон объемных отношений Гей-Люссака, закон соотношения массы и энергии А. Энштейна.
Вопросы к разделу «Химическая термодинамика и кинетика»
1.Энергетика химических процессов. Экзотермические и эндотермические реакции. Тепловой эффект реакции. Термохимические уравнения и расчеты. Законы термохимии: закон Гесса и закон Лавуазье-Лапласа.
2.Химическая термодинамика. Понятие «система», термодинамические параметры и свойства. Первый закон термодинамики. Внутренняя энергия и энтальпия. Изменение энтальпии образования. Изменение энтальпии в химических реакциях.
3.Направление течения химической реакции. Энтропия. Второй закон термодинамики. Условие самопроизвольного направления химических процессов. Изменение энтропии в химических реакциях. Понятие об изобарно-изотермическом потенциале. Изменение энергии Гиббса. Образование условия термодинамической возможности протекания химического процесса.
4.Скорость химической реакции, гомогенные и гетерогенные химические реакции, определение скорости химических реакций. Порядок реакции. Механизмы химических реакций. Факторы, влияющие на скорость химической реакции. Закон действия масс. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Особенности гетерогенных реакций.
9
Катализ. |
Катализаторы. |
Катализ |
гомогенный |
и |
гетерогенный. |
Колебательные реакции. Применение катализаторов.
5.Химическое равновесие. Условие химического равновесия. Константа химического равновесия и ее связь с термодинамическим функциями. Смещение химического равновесия. Принцип Ле Шателье.
Вопросы к разделу «Поверхностные явления»
1.Понятие о поверхностной энергии. Правило фаз Гиббса. Диаграмма состояния воды. Поверхностное натяжение. Факторы, влияющие на величину поверхностного натяжения. Поверхностно-активные вещества.
2. Сорбция. Абсорбция. Адсорбция. Термодинамика адсорбции. Адсорбционное равновесие. Изотермы адсорбции Ленгмюра и Фрейндлиха. Адсорбция на границе раздела твердое тело-газ и твердое тело-жидкость. Применение адсорбции.
3.Смачивание и растекание. Краевой угол смачивания. Адгезия, когезия, аутогезия. Работа адгезии, работа когезии. Уравнение Дюпре. Уравнение Юнга. Адсорбционная теория адгезии для процесса склеивания. Типы разрушения при склеивании двух древесных материалов третьим (адгезионный, аутогезионный, когезионный и смешанный).
Коллоквиум «Строение вещества»
Вопросы по разделу «Строение атома»
1.Основные сведения о строении атома. Состав атомных ядер. Изотопы, изобары.
2.Квантово-механическая модель атома водорода. Двойственная природа электрона (уравнение де Бройля).
3.Волновое уравнение (уравнение Шредингера). Характеристика
энергетического состояния электрона квантовыми числами: главное, побочное, магнитное, спиновое. Распределение электронов по энергетическим уровням в соответствии с принципом Паули, правилами Клечковского и Гунда.
Вопросы к разделу «Периодическая система элементов Д.И. Менделеева»
1.Периодическая система элементов и электронная структура атомов. Структура периодической системы.
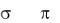
10
2.Периодические свойства элементов: кислотно-основные и окислительновосстановительные свойства веществ, энергия ионизации, энергия сродства к электрону, электроотрицательность.
3.Физическое состояние веществ. Химические системы. Газообразное, жидкое и твердое состояние вещества. Реальные кристаллы. Соединения переменного состава.
Вопросы к разделу «Химическая связь»
1.Условие образования химической связи. Химическая связь и валентность. Основные виды химических связей. Количественные характеристики химической связи: длина связи, энергия связи, валентные углы.
2.Ковалентная связь. Метод валентных связей (МВС). Свойства ковалентной связи: насыщаемость; направленность ( - и -связи, гибридизация атомных орбиталей, типы гибридизаций, пространственная конфигурация молекул); поляризуемость связи (полярные и неполярные молекулы, понятие о диполях и дипольном моменте, структура и полярность).
3.Ковалентная связь. Метод молекулярных орбиталей (ММО). Основные понятия. Связывающие и разрыхляющие молекулярные орбитали. Порядок и энергия связи. Электронные структуры молекул по ММО и их свойства.
4.Особенности ионной связи, свойства ионной связи.
5.Водородная связь, еѐ особенности (энергия, длина). Влияние водородной связи на свойства веществ.
6.Металлическая связь и еѐ особенности.
7.Межмолекулярные взаимодействия: Вандерваальсовы взаимодействия, водородные связи.
8.Комплексные соединения. Донорно-акцепторное взаимодействие молекул. Комплексы. Комплексообразователи. Лиганды. Координационное число и заряд комплекса. Номенклатура комплексных соединений. Роль комплексных соединений в природе и технике.
Контроль № 2 по теме «Растворы»
Вопросы к разделу «Растворы электролитов и неэлектролитов»
1.Дисперсные системы. Эмульсии. Суспензии. Растворы. Общие свойства растворов. Способы выражения состава растворов.
