
116
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВОРОНЕЖСКАЯ ГОСУДАРСТВЕННАЯ ЛЕСОТЕХНИЧЕСКАЯ АКАДЕМИЯ
Х И М И Я
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторной работе по теме:
«АДСОРБЦИЯ. АДСОРБЦИОННОЕ РАВНОВЕСИЕ»
для студентов 1 курса всех специальностей
(с элементами УИРС)
ВОРОНЕЖ 2003
2
УДК 541.183
Бельчинская Л.И., Стрельникова О.Ю. Химия. Методические указания к лабораторной работе по теме: « Адсорбция. Адсорбционное равновесие», для студентов 1 курса всех специальностей (с элементами УИРС) – Воронеж: Воронеж. гос. лесотехн. акад., 2003. – 10 с.
Печатается по решению редакционно-издательского совета ВГЛТА
Работа предназначена для студентов 1 курса всех факультетов ВГЛТА при изучении темы: «Равновесия в гетерогенных системах»
Рецензент: д-р техн. наук, проф. В.М. Перелыгин
Научный редактор: канд. техн. наук, доц. А.И. Дмитренков
3
Теоретическая часть
Сорбция – процесс поглощения одного вещества (сорбата) другим (сор-
бентом). Если вещество поглощается всем объемом другого вещества, то происходит абсорбция, если только поверхностью – адсорбция.
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом. В качестве адсорбентов используют непористые материалы,
пористые тела с развитой внутренней поверхностью – активные угли, силикагели, цеолиты и др.
Вещество, которое концентрируется на поверхности адсорбента, называется адсорбатом.
Таким образом, адсорбцией называется изменение концентрации адсорбата в поверхностном слое по сравнению с объемной фазой, отнесенное к единице поверхности адсорбента (г/м2, моль/м2). Часто из-за сложности определения величины поверхности адсорбентов количество адсорбированного вещества относят к единице массы (г/г, моль/г).
Адсорбция – самопроизвольный процесс, сопровождающийся убылью свободной энергии Гиббса G < 0. Энтальпия адсорбции также имеет отрицательное значение Н < 0, так как адсорбция - это экзотермический процесс.
Чем больше энергия взаимодействия адсорбата с поверхностью адсорбента, тем больше времени молекулы адсорбируемого вещества удерживаются на поверхности раздела фаз, то есть находятся в адсорбированном состоянии. Время адсорбции (τ) молекул на поверхности адсорбента определя-
ется уравнением: |
|
τ = τ0 е - Н/R T, |
(1) |
где τ0 – постоянная, зависящая от природы адсорбента и адсорбата; Н – энтальпия (тепловой эффект адсорбции);
R – универсальная газовая постоянная; Т – температура.
При адсорбции смеси веществ у границы раздела фаз будет накапливаться тот компонент, молекулы которого имеют большее время адсорбции.
Различают два вида адсорбции: физическую и химическую (хемосорбцию).
При физической адсорбции между частицами адсорбента и адсорбата возникают относительно непрочные межмолекулярные взаимодействия (силы Ван-дер-Ваальса). Физическая адсорбция характеризуется невысоким тепловым эффектом и малыми временами адсорбции. Примером физической адсорбции является адсорбция газов или растворенных веществ активированным углем.
4
При хемосорбции между частицами адсорбента и адсорбата возникают химические взаимодействия. Тепловой эффект хемосорбции близок к тепловому эффекту химических реакций. Примером химической адсорбции является адсорбция кислорода металлами.
Процесс адсорбции может быть обратимым. Явление, обратное адсорб-
ции, называется десорбцией.
Таким образом, десорбцией называется процесс удаления поглощенного вещества (адсорбата) с поверхности адсорбента.
Если в системе адсорбат – адсорбент при заданных условиях скорость
адсорбции равна скорости десорбции, то состояние системы называется адсорбционным равновесием.
Зависимость количества адсорбированного вещества (а) от его равновесной концентрации (С), т.е. концентрации адсорбата при адсорбционном
равновесии (или равновесного парциального давления (Р)) при постоянной температуре называется изотермой адсорбции. Изотермы адсорбции из вод-
ных растворов и газовых сред описаны уравнениями Лэнгмюра и Фрейндлиха. Уравнение Лэнгмюра выведено на основании допущения об адсорбции
монослоя на однородной поверхности адсорбента. Уравнение адсорбции Лэнгмюра имеет вид:
|
k C |
|
|
а = аmax |
|
, |
(2) |
|
|||
|
1+ k C |
|
|
где а – количество адсорбированного вещества (адсорбция), мг/г;
аmax – предельное количество вещества, которое может адсорбироваться, мг/г; С – равновесная концентрация вещества;
k – константа адсорбционного равновесия.
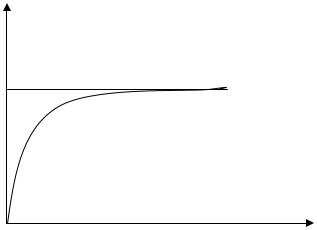
Графически изотерма адсорбции имеет вид, приведенный на рис.1.
а
аmax
23
1
0 |
С |
Рис.1. Изотерма адсорбции Лэнгмюра |
|
5
На изотерме Лэнгмюра можно выделить три участка:
1)при малых концентрациях адсорбата наблюдается линейная зависимость количества адсорбированного вещества от равновесной концентрации (участок 0-1);
2)в широком интервале средних концентраций количество адсорбированного вещества возрастает пропорционально С1/n (участок 1-2). Для этого участка справедливо уравнение изотермы адсорбции Фрейндлиха
а = k С1/n, |
(3) |
где k и n – константы.
Уравнение Фрейндлиха используется для описания адсорбции на неоднородных поверхностях.
3)при больших концентрациях адсорбированное количество адсорбата остается постоянным и не зависит от концентрации, достигается предел адсорбции аmax (участок 2-3);
Такой вид изотермы адсорбции может быть объяснен со следующих позиций. В результате введения малого количества адсорбата только небольшая часть поверхности адсорбента окажется занятой в данный момент, поэтому адсорбция следующих вводимых порций практически не будет зависеть от адсорбции предыдущего количества. Адсорбция будет пропорциональна равновесной концентрации. С дальнейшим увеличением концентрации адсорбата все большая часть поверхности адсорбента окажется занятой и вероятность попадания молекул адсорбируемого вещества на незаполненную поверхность уменьшается. Это приводит к росту адсорбции пропорционально некоторой дробной степени концентрации. При больших концентрациях адсорбата вся поверхность адсорбента занята. Абсорбция постоянна.
Величина адсорбции зависит от следующих факторов:
•природы адсорбента и адсорбата;
•температуры;
•концентрации (давления) адсорбата.
Адсорбция растет с увеличением концентрации или давления адсорбирующихся веществ согласно изотермам адсорбции (уравнения 2,3). С ростом температуры адсорбция уменьшается (уравнение 1). При увеличении температуры адсорбционное равновесие смещается в сторону десорбции. Т.е. десорбцию можно осуществить путем повышения температуры, снижения давления, а также вытеснения адсорбата другими веществами (десорбентами).
6
Для нахождения значений постоянных уравнения Лэнгмюра аmax и k можно построить зависимость величины обратной адсорбции 1/а от 1/С, выразив уравнение Лэнгмюра (2) в виде:
1 |
= |
1 |
+ |
1 |
, |
(4) |
||
|
|
|
|
|
||||
|
|
|
||||||
|
||||||||
а |
аmax |
аmax k C |
|
|||||
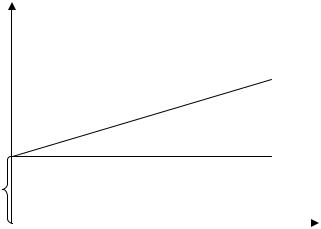
Графически изотерма адсорбции по уравнению (4) имеет вид, приведенный на рис.2.
1/а
 α
α
1/аmax
0 |
1/С |
Рис.2. Изотерма адсорбции Лэнгмюра в линейной форме
На оси ординат отсекается отрезок, равный 1/ аmax, tgα = 1/(аmax k).
Адсорбция находит широкое применение во многих технологических процессах. На различной способности компонентов смеси к адсорбции основаны методы разделения и анализа многокомпонентных систем (адсорбционная, распределительная, ионообменная хроматография).
Особенно актуально использование явления адсорбции в решении экологических задач, в частности, для очистки газов и жидкостей от различных примесей, при подготовке питьевой воды, очистке сточных вод и газовых выбросов промышленных производств, в том числе мебельных и деревообрабатывающих предприятий.
На явлении адсорбции основаны широко распространенные в деревообработке такие технологические операции как лакирование, окрашивание, склеивание и др.
7
Практическая часть
Лабораторная работа
Адсорбция и десорбция метилового оранжевого
Цель работы: ознакомление с теорией адсорбции и экспериментальное определение адсорбционных характеристик различных адсорбентов при адсорбции метилового оранжевого.
Реактивы и оборудование: адсорбенты: активированный уголь, силикагель, глинистый минерал и др.; растворы метилового оранжевого; фотоэлектроколориметр; весы; разновесы; стаканы химические емкостью 50 мл; конические колбы; воронки; фильтровальная бумага.
Ход работы
ОПЫТ 1. Адсорбция метилового оранжевого различными адсорбентами.
Группа студентов (2-3 человека) взвешивает 0,1г адсорбента для определения адсорбции при одной исследуемой концентрации метилового оранжевого.
Адсорбент помещают в стакан емкостью 50 мл, приливают 20 мл раствора метилового оранжевого исследуемой концентрации.
Содержимое стакана перемешивают и выдерживают 10минут (периодически взбалтывая), затем отфильтровывают в коническую колбу через бумажный фильтр.
Определяют концентрацию метилового оранжевого в исходном растворе и в фильтрате фотоколориметрическим методом. Для этого наливают исходный раствор в рабочую кювету фотоэлектроколориметра и измеряют оптическую плотность(А0) или пропускание (П0, %) при длине волны 492 нм. По градуировочному графику находят концентрацию метилового оранжевого, соответствующую полученным значениям пропускания. Далее аналогичные измерения проводят для фильтрата.
Результаты определения заносят в табл. 1. Адсорбцию (а, мг/г) рассчитывают по формуле
V (C0-Cа)
а = |
|
, |
(5) |
|
m
где V – объем раствора метилового оранжевого, л;
C0 – исходная концентрация метилового оранжевого, мг/л;
Са – равновесная концентрация метилового оранжевого в фильтрате после адсорбции, мг/л;
m– масса адсорбента, г.
. В данном опыте V = 0,02 л; m = 0,1г.
8
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
№ |
Пропускание |
Исходная |
Пропускание |
Равновесная |
Адсорбция |
|
П0, % |
концентрация |
П1, % |
концентрация |
а, |
опы |
(для определения |
метилового |
(для определения |
метилового |
мг/г |
та |
исходной |
оранжевого |
равновесной |
оранжевого после |
|
|
концентрации C0) |
C0, мг/л |
концентрации по- |
адсорбции Cа, |
|
|
|
|
сле адсорбции Cа) |
мг/л |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
Результаты опыта используют для построения изотермы адсорбции метилового оранжевого в координатах а – Cа.
Затем строят графическую зависимость 1/а – 1/Са и находят по графику величину максимальной адсорбции (аmax) и константу адсорбционного равновесия (k).
ОПЫТ 2. Десорбция метилового оранжевого.
Фильтр с адсорбентом (из опыта 1) помещают в стакан емкостью 50 мл и приливают 20 мл дистиллированной воды. Содержимое стакана перемешивают и выдерживают 20минут (периодически взбалтывая), затем отфильтровывают в коническую колбу через бумажный фильтр. Определяют концентрацию метилового оранжевого в фильтрате.
Результаты определения заносят в табл. 2.
Десорбцию (D, мг/г) рассчитывают по формуле
|
V Cд |
|
|
D = |
|
, |
(6) |
|
|||
|
m |
|
|
где V – объем раствора, л;
Сд – равновесная концентрация метилового оранжевого в фильтрате после десорбции, мг/л;
m– масса адсорбента, г.
. В данном опыте V = 0,02 л; m = 0,1г.
9
Степень необратимости адсорбции (γн) рассчитывают по формуле
|
aн |
|
|
γн = |
|
100 % , |
(7) |
|
|||
|
аmax |
|
|
где aн – необратимая адсорбция, мг/г.
|
Необратимую адсорбцию определяют по формуле |
|
|||
|
|
aн = а – D. |
|
(8) |
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
№ |
Пропускание |
Равновесная |
Десорбция |
Необратимая |
Степень |
опы |
П2, % |
концентрация |
D, мг/г |
адсорбция |
необратимости |
та |
(для определения |
метилового |
|
aн, мг/г |
адсорбции |
|
равновесной |
оранжевого |
|
|
γн,% |
|
концентрации по- |
после десорбции |
|
|
|
|
сле десорбции Cд) |
Cд, мг/л |
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
На основании полученных в 1 опыте величин а, аmax, k, делают следующие выводы:
1.Оценивают процент адсорбции (а) при исследуемой концентрации метилового оранжевого относительно максимальной величины (аmax).
2.Сравнивают величины аmax и k для различных адсорбентов, определяют наиболее эффективный для адсорбции метилового оранжевого.
На основании полученных в 2 опыте величин D, aн, γн делают следующие выводы:
1.При какой концентрации степень необратимости адсорбции наибольшая.
2.Сравнивают величины γн для различных адсорбентов, определяют наиболее эффективный для адсорбции метилового оранжевого.
10
Дайте ответы на следующие вопросы:
1.Дайте определение “адсорбция”, “десорбция” ?
2.В чем суть физической и химической адсорбции?
3.Что представляет собой изотерма адсорбции? Какие изотермы Вы знаете ?
4.При каких условиях наступает адсорбционное равновесие ? Как можно сместить адсорбционное равновесие?
5.Как определить адсорбционные характеристики из уравнения Лэнгмюра?
Библиографический список
1.Коровин Н.В. Общая химия. – М.: Высш. шк., 2000. – 558 с.
2.Коровин Н.В., Мингулина Э.И., Рыжкова Н.Г. Лабораторные работы по химии. – М.: Высш. шк., 1998. – 256 с.
3.Суворов А.В., Никольский А.Б. Общая химия. – СПб: Химия, 1997. – 623 с.
4.Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высш. шк., 2001.
– 527 с.
СОДЕРЖАНИЕ
Теоретическая часть………………………………………………………….… 3 Практическая часть…………………………………………………………….. 7 Опыт 1. Адсорбция метилового оранжевого различными адсорбентами….. 7 Опыт 2. Десорбция метилового оранжевого…………………………………. 8 Библиографический список……………………………………………………. 10
Бельчинская Лариса Ивановна Стрельникова Ольга Юрьевна
Х И М И Я
Методические указания к лабораторной работе по теме: «Адсорбция. Адсорбционное равновесие»
для студентов 1 курса всех специальностей (с элементами УИРС)
|
|
|
|
Редактор |
|
Подписано в печать |
Формат |
60х84 1/16 |
Объем |
п.л. |
|
Заказ № |
Уч.-изд. л. |
Усл. п.л. |
Тираж |
экз. |
|
|
|
||||
|
Воронежская государственная лесотехническая академия |
||||
РИО ВГЛТА. |
УОП ВГЛТА. |
394613, г. Воронеж, ул. Тимирязева, 8. |
|||
