
- •Введение
- •1. Химическая кинетика и равновесие
- •2. Жесткость воды
- •3. Гидролиз солей
- •5. Химические свойства металлов
- •6. Экосистемы
- •7. Организм и среда. Экологические факторы
- •9. Мониторинг почвенного покрова
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
- •Приложение 5
8.Какие виды связнодисперсных структур вы знаете? Дайте определение таким свойствам связнодисперсных структур, как тиксотропия и синерезис.
9.Приведите примеры дисперсных систем, которые встречаются в природе, в производстве, в быту.
5. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Положение металлов в периодической таблице. Если в периодиче-
ской таблице элементов Д.И. Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся все элементы побочных подгрупп), а справа вверху – эле-
менты-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ge, |
|
|
И |
Sb, Po), обладают двойственным характером и образуют амфотерные соеди- |
|
нения. |
Д |
К элементам-металлам относятся s-элементы I и II групп, все d- и f-элементы, а также p-элементы главных подгрупп: III (кроме бора), IV (Ge,
Sn, Pb), V (Sb, Bi) и VI (Po). Наиболее типичные элементы-металлы распо- |
||||
|
|
|
А |
|
ложены в начале периодов (начиная со второго). На внешнем энергетиче- |
||||
ском уровне у металлов находится обычно 1 или 2, реже 3 электрона. |
||||
|
|
б |
|
|
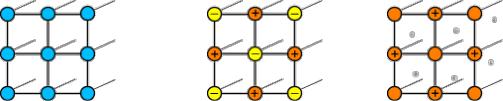
Виды кристаллических решеток представлены на рис. 1. |
||||
|
и |
|
|
|
С |
|
Ионная |
Металлическая |
|
Атомная |
|
|
||
Рис. 1. Виды кристаллических решеток
Кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отсоединившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т.е. возникает электрический ток.
38
Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры (наличием «электронного газа»).
Физические свойства:
1)пластичность – способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au, Ag, Cu, Sn, Pb, Zn, Fe пластичность уменьшается;
2)блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света;
3)электропроводность, которая объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. Электропроводность уменьшается в ряду Ag, Cu, Al, Fe и при нагревании. Последнее объясняется тем, что
сповышением температуры затрудняется направленное движение «электронного газа», т.к. усиливаются колебания атомовИи ионов в узлах кристаллической решетки;
4)теплопроводность обусловлена Двысокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит
быстрое выравнивание температуры по массе металла. Наибольшей теплопроводностью обладают Bi и Hg; А
5)твердость. Самый твердый – Cr (режет стекло); самые мягкие – щелочные металлы K, Na, Rb, Csб(режутся ножом);
6)плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атомаи(самый легкий – Li; самый тяжелый – Os (табл. 7). Металлы, имеющие плотность < 5 г/см3, считаются «легкими металлами»;
7)температурыСплавлен я кипения. Самый легкоплавкий металл – Hg, самый тугоплавк й металл – W (см. табл. 7). Металлы с t°пл выше 1000 °C считаются тугоплавкими, ниже – низкоплавкими.
№Название Атомный вес Плотность, Температура
п/п |
металла |
|
|
г/см3 |
плавления, ºC |
1 |
2 |
3 |
|
4 |
5 |
|
|
Легкие металлы |
|
|
|
1 |
Литий |
6,939 |
|
0,534 |
179,00 |
2 |
Калий |
39,102 |
|
0,860 |
63,60 |
3 |
Натрий |
22,9898 |
|
0,970 |
97,80 |
4 |
Кальций |
40,080 |
|
1,550 |
850,00 |
5 |
Магний |
24,305 |
|
1,740 |
651,00 |
6 |
Цезий |
132,905 |
|
3,500 |
710,00 |
7 |
Алюминий |
26,9815 |
|
2,702 |
660,10 |
8 |
Барий |
137,340 |
|
3,500 |
710,00 |
39
1 |
2 |
3 |
|
4 |
5 |
|
|
Тяжелые металлы |
|
||
9 |
Цинк |
65,370 |
|
7,140 |
419,00 |
10 |
Хром |
51,996 |
|
7,160 |
1875,00 |
11 |
Марганец |
54,938 |
|
7,440 |
1244,00 |
12 |
Олово |
118,690 |
|
7,280 |
231,90 |
13 |
Железо |
55,847 |
|
7,860 |
1539,00 |
14 |
Кадмий |
112,400 |
|
8,650 |
321,00 |
15 |
Никель |
58,710 |
|
8,900 |
1453,00 |
16 |
Медь |
63,546 |
|
8,920 |
1083,00 |
17 |
Висмут |
208,980 |
|
9,800 |
271,30 |
18 |
Серебро |
107,868 |
|
10,500 |
960,80 |
19 |
Свинец |
207,190 |
|
11,344 |
327,30 |
20 |
Ртуть |
200,590 |
|
13,546 |
-38,87 |
21 |
Вольфрам |
183,850 |
|
19,300 |
3380,00 |
22 |
Золото |
196,967 |
|
19,300 |
1063,00 |
23 |
Платина |
195,090 |
|
21,450 |
1769,00 |
24 |
Осмий |
190,200 |
|
22,500 |
2700,00 |
|
|
|
|
И |
|
|
|
|
Д |
|
|
Частицы металлов, находящихсяАв твердом и жидком состоянии, связаны особым типом химической связи – так называемой металлической связью. Она определяется одновременнымб наличием обычных ковалентных связей между нейтральными атомами и кулоновским притяжением между ионами и свободными иэлектронами. Таким образом, металлическая связь является свойством не отдельных частиц, а их агрегатов.
Основным химСческ м свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов, их ионы всегда заряжены положительно.
Легко отдавая при химических реакциях свои валентные электроны,
типичные металлы являются энергичными восстановителями.
Me0 – n ē = Men +.
Химические свойства металлов.
I.Взаимодействие с неметаллами:
1)с кислородом
2 Mg0 + O2 = 2 Mg+2O;
2) с серой
Hg0 + S = Hg+2S;
3) с галогенами
Ni0 + Cl2 (t°) = Ni+2Cl2;
40

4) с азотом
3 Ca0 + N2 (t°) = Ca3+2N2;
5) с фосфором
3Ca0 + 2 P (t°) = Ca3+2P2;
6)с водородом реагируют только щелочные и щелочно-земельные ме-
таллы
2Li0 + H2 = 2Li+H;
Ca0 + H2 = Ca+2H2. II. Взаимодействие с кислотами:
1. Металлы, стоящие в электрохимическом ряду напряжений (прил. 5) до водорода, восстанавливают неокисляющие кислоты с образованием водорода:
|
Mg0 + 2 HCl = Mg+2Cl2 |
+ H20; |
|
|
И |
2Al0 |
+ 3 Н2SO4(разб) = Al2+3(SO4)3 + 3 H20; |
|
6Na0 + 2 H3PO4 = 2Na3+PO4 + 3H20.
2. Окисляющие кислоты [Н2SO4(конц), HNO3 любой концентрации] взаимодействуют с металлами, стоящими в электрохимическом ряду
напряжений до и после водорода, кроме благородных металлов (табл. 8) без |
|||||
выделения водорода. |
|
А |
|
||
|
|
|
|
||
|
|
|
б |
|
Таблица 8 |
|
|
|
|
|
|
|
Взаимодействие металлов Дс окисляющими кислотами |
||||
Формула окисляющей |
|
Металл (Ме) |
Продукты реакции |
||
кислоты |
|
|
|
|
|
Н2SO4(конц) |
|
Акт вный Ме Li…Zn |
Соль + H2S + H2O |
||
|
|
Ме |
средней |
активности |
Соль + S + H2O |
|
|
Cd…Pb |
|
|
|
|
|
Неакт вный Ме |
|
Соль + SО2 + H2O |
|
|
|
и(после H ) и Fe |
|
|
|
|
|
|
2 |
|
|
HNO3(конц) |
|
Любой активности |
Соль + NО2 + H2O |
||
HNO3(разб) |
|
Активный Ме Li…Zn |
Соль + N2 + H2O |
||
|
С |
|
|
|
|
|
|
Ме |
средней |
активности |
Соль + N2O + H2O |
|
|
Fe…Pb |
|
|
|
|
|
Неактивный Ме |
|
Соль + NO + H2O |
|
|
|
(после H2) |
|
|
|
HNO3(очень разб) |
|
Активный Ме |
|
Соль + NH4NO3 + H2O |
|
3. Благородные металлы (Au, Pt, Ir, Rh, Nb, Ta, W) взаимодействуют с
«царской водкой» [смесь HNO3(конц) и HCl(конц) в соотношении 1:3].
1-я стадия: Au0 + HN+5O3(конц) + 3 HCl(конц) = Au+3Cl3 + N+2O + 2 H2O; 2-я стадия: AuCl3 + HCl(конц) = H[AuCl4].
41
Суммарное уравнение данной реакции
Au + HNO3(конц) + 3 HCl(конц) = H[AuCl4] + NO + 2 H2O.
4. Некоторые металлы (Fe, Al, Cr) не взаимодействуют с концентрированными азотной и серной кислотами при обычной температуре, т.к. происходит утолщение и уплотнение оксидных пленок на их поверхности – пассивация.
Н2SO4(конц) + Fe, Al ≠ пассивируют; HNO3(конц) + Fe, Al, Cr ≠ пассивируют;
Н2SO4(конц) + Fe (t°) = Fe2(SO4)3 + 3 SO2 + 6 H2O. III. Взаимодействие с водой:
1. Активные (щелочные и щелочно-земельные) металлы при взаимо-
действии с водой образуют растворимое основание и водород:
2Na0 + 2H2O = 2Na+OH + H20;
Ca0 + 2H2O = Ca+2(OH)2И+ H20.
тенциалов которых равно от –1 до 0 В) окисляются водой при нагревании до оксида:
2. Металлы средней активности (значение стандартных электродных по- Д
Zn0 + H2O (t°) = Zn+2O + H20.
3. Неактивные металлы Cu, Au, Ag, Pt не реагируют с водой.
IV. Взаимодействие с солями. |
|
|
|
|
|||||
|
|
|
б |
|
|
|
|
||
Вытеснение более активными металлами менее активных металлов из |
|||||||||
растворов их солей: |
и |
|
|
|
|
|
|||
|
Cu |
0 |
+ Hg |
+2 |
|
0 |
|
+2 |
Cl2; |
|
|
|
ClА2 = Hg + Cu |
|
|||||
|
Fe0 + Cu+2SO4 = Cu0 |
+ Fe+2SO4. |
|||||||
С |
|
|
|
|
|
|
|
||
|
Лабораторная работа №6 |
||||||||
Химические свойства металлов
Опыт 1. Отношение металлов к кислороду.
В пламя спиртовки по очереди внесите стружку или порошок магния и медную стружку. Напишите уравнения реакций горения. Что образуется на поверхности меди при нагревании? Сделайте вывод об активности металлов в реакции окисления кислородом в зависимости от их положения в ряду напряжений.
42
Опыт 2. Взаимодействие металлов с раствором солей.
Налейте в пробирку 1…2 см3 раствора сульфата меди и опустите железный гвоздь, предварительно зачищенный наждачной бумагой. Что наблюдается? Напишите уравнение реакции, сделайте вывод.
Опыт 3. Взаимодействие металлов с растворами щелочей.
В две пробирки налейте концентрированный раствор щелочи NaOH и добавьте в одну цинковую пыль, в другую – алюминиевый порошок. Содержимое пробирок можно немного подогреть.
Составьте уравнения реакций, учитывая, что образуются комплексные соли соответственно тетрагидроксоцинкат и тетрагидроксоалюминат натрия.
Опыт 4. Взаимодействие металлов с кислотами.
Повторите опыт, взяв вместо цинка меднуюИстружку.
В шесть пробирок поместите по кусочку металлического цинка и до-
бавьте по 1 см3 соляной, серной и азотной кислот: в первые три – разбавленные, во вторые три – концентрированные. Опыт с концентрированными кислотами проводите под вытяжкой!
Составьте уравнения всех реакций. Сделайте вывод о том, как реаги-
руют с концентрированными и разбавленными кислотами металлы, стоящие |
||||
|
|
|
|
Д |
в ряду напряжений (активности) металлов до и после водорода. |
||||
|
Вопросы и задан я дляАзащиты лабораторной работы |
|||
|
|
«Х м ческ е свойства металлов» |
||
|
|
|
б |
|
1. |
Охарактеризуйте положение металлов в периодической таблице |
|||
Д.И. Менделеева. |
и |
|
||
|
|
|
||
2. |
Назовите наиболее распространенные методы получения металлов. |
|||
3. |
Как металлы взаимодействуют с кислотами? |
|||
4. |
|
С |
|
|
Как металлы взаимодействуют с неметаллами? |
||||
5. |
Как металлы взаимодействуют с водой? |
|||
6. |
Как металлы взаимодействуют с солями? |
|||
7. |
Какими физическими свойствами обладают металлы? |
|||
8. |
Какая зависимость между свойствами металлов и их положением в |
|||
электрохимическом ряду напряжений металлов.
43
