
9. Классификация неорганических соединений и их свойства
.docxКлассификация неорганических соединений и их свойства
В настоящее время известно более 500 тысяч неорганических соединений, знать их формулы, названия, а тем более свойства практически невозможно. Для того чтобы легче ориентироваться в огромном многообразии химических веществ, все вещества разделены на отдельные классы, включающие соединения, сходные по строению и свойствам.
Первоначально все химические вещества делятся на простые и сложные.
Простые вещества подразделяются на металлы и неметаллы.
Помимо типичных металлов и неметаллов есть большая группа веществ, обладающая промежуточными свойствами, их называют металлоидами.
Сложные вещества подразделяются на четыре класса химических соединений: оксиды, основания, кислоты и соли.
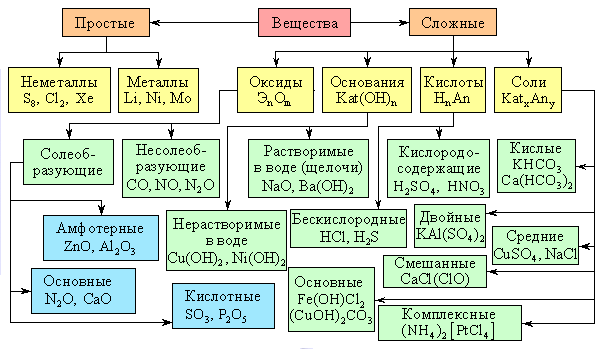
ОКСИДЫ – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород.
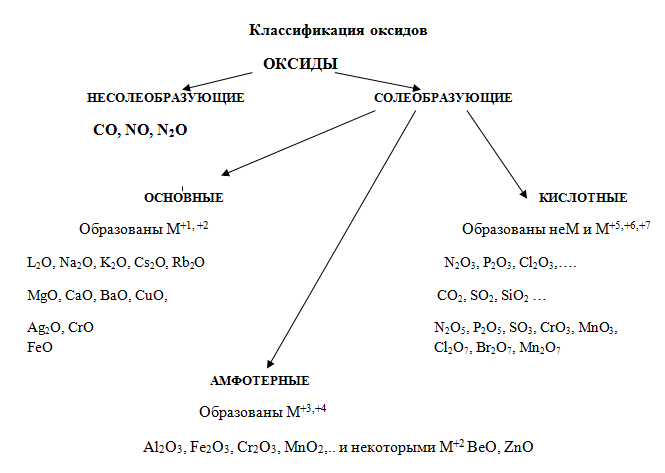
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4.
Основания (гидроксиды) - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
Наличие гидроксогруппы отражается и в названии гидроксидов:
NaOH - гидроксид натрия
Ca(OH)2– гидроксид кальция
Al(OH)3 - гидроксид алюминия
Если элемент имеет несколько степеней окисления и образует несколько гидроксидов, в названии обязательно указывается его валентность:
Cr(OH)2 – гидроксид хрома (II) Fe(OH)2 – гидроксид железа (II)
Классификация по растворимости |
||
растворимые (щелочи) |
нерастворимые |
|
LiOH,NaOH,KOH и др |
Al(OH)3,Cu(OH)2,Fe(OH)3и др |
|
Классификация по свойствам |
||
кислотные (кислоты) |
амфотерные (амфотерные основания) |
основные (основания) |
H2SO4,HNO3,H3PO4 |
Al(OH)3,Zn(OH)2,Be(OH)2 Fe(OH)3 Cr(OH)3 |
NaOH,Ca(OH)2,Cu(OH)2 Fe(OH)2 Cr(OH)3 |
Классификация по кислотности |
||
однокислотные |
двукислотные |
трехкислотные |
содержат одну гидроксогруппу |
содержат две гидроксогруппы |
содержат три гидроксогруппы |
LiOH,NaOH,KOH,NH4OH |
Zn(OH)2,Cu(OH)2,Be(OH)2 |
Al(OH)3,Fe(OH)2,Cr(OH)3 |
Cr(OH)3 –гидрокисд хрома (III) Fe(OH)3 – гидроксид железа (III)
Гидроксиды - сложные соединения, в состав которых входит одна или несколько гидроксогрупп (OH−), связанных с атомом элемента.
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = H2ZnO2
форма основания форма кислоты
КИСЛОТЫ – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
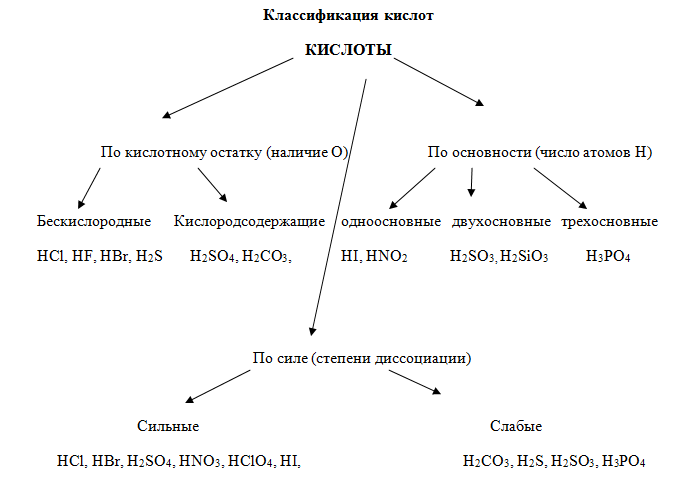
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, H2SO4, H3PO4) и бескислородные (HI, H2S).
СОЛИ – это сложные вещества, состоящие из ионов металла и кислотных остатков.
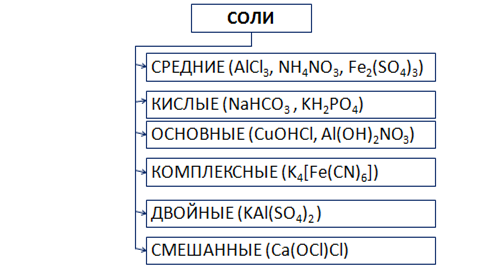
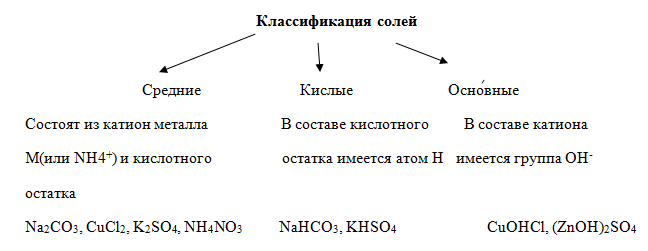
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
