
Конспект термодинамика
.docxОглавление
Тема 1. Физическое состояние вещества, уравнения состояния. Виды агрегатного состояния. Фазовые превращения и диаграммы фазового состояния тел. Непрерывность физического состояния вещества. Тройная и критическая точки. Закритическое состояние вещества. Уравнения состояния идеальных и реальных газов, коэффициент сжимаемости. 3
Тема 2. Смеси газов и жидкостей. Характеристики смесей: состав, кажущаяся молекулярная масса, характеристическая газовая постоянная, теплоемкость, критические параметры. Закон соответственных состояний вещества. 10
Тема 3. Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии. Понятие о внешнем и внутреннем теплообмене. Внешний энергетический баланс и баланс рабочего тела. 16
Тема 4. Процессы изменения состояния. Классификация процессов изменения состояния любых термодинамических систем и простых тел. Политропические процессы, уравнение политропы с постоянным показателем, определение постоянного показателя политропы. 22
Тема 5. Круговые процессы - циклы. Первое начало термодинамики для круговых процессов. Цикл Карно. КПД цикла Карно. 33
Тема 6. Второе начало термодинамики. Принцип существования энтропии. Математическое выражение. Основные следствия. Принцип возрастания энтропии. Математическое выражение. Основные следствия. 39
Тема 7. Парообразование, процессы изменения состояния паров. 50
Тема 8. Термодинамика потока. Истечение газов и паров, дросселирование. Уравнение первого начала термодинамики для потока, его анализ. Понятие истечения газа из сопел. Истечение несжимаемых жидкостей. Истечение паров и реальных газов. 56
Тема 9. Термодинамический анализ процессов в компрессорах. 75
Тема 10. Циклы двигателей внутреннего сгорания и газотрубных установок. Циклы поршневых ДВС и ГТУ в «p-v» и «T-s» координатах. 76
Тема 1. Физическое состояние вещества, уравнения состояния. Виды агрегатного состояния. Фазовые превращения и диаграммы фазового состояния тел. Непрерывность физического состояния вещества. Тройная и критическая точки. Закритическое состояние вещества. Уравнения состояния идеальных и реальных газов, коэффициент сжимаемости.
Система, состоящая из одной фазы вещества или веществ, называется гомогенной. Гомогенная система, неподверженная действию гравитационных, электро-магнитных и других сил и имеющая во всех своих частях одинаковые свойства, называется однородной.
Система, состоящая из нескольких гомогенных частей (фаз), отделённых поверхностью раздела, называется гетерогенной.
Термодинамической системой принято называть систему, внутреннее состояние которой определяется значениями определённого количества независимых переменных, которые принято называть параметрами состояния. Если состояние термодинамической системы и ее параметры не изменяются во времени, то говорят, что система находится в равновесном состоянии.
Равновесным состоянием системы называется такое состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Простейшей термодинамической системой или простым телом называется равновесная система, физическое состояние которой вполне определяется значениями двух независимых переменных. К простым телам относятся: газы, пары, жидкости и многие твёрдые тела, находящиеся в термодинамическом равновесии и не подверженные химическим превращениям, действию гравитационных и электромагнитных сил.
Параметры состояния - физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные. Интенсивные свойства не зависят от массы системы, а экстенсивные - пропорциональны массе.
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы.
К простейшим термодинамическим параметрам состояния относятся: удельный объем v , давление p и температура t, T .
Различают три агрегатных состояния простых систем: твёрдое, жидкое и газообразное.
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое.
Рассмотрим диаграмму фазовых состояний чистого вещества, которая представлена на рисунке.
Фазами системы называются области, ограниченные поверхностями раздела.
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
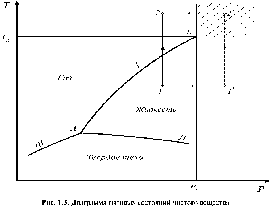
На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трёх агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
Энергетической границей между жидкостью и паром является теплота испарения, а между твёрдым телом и жидкостью - теплота плавления. Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода обозначается символом r.
Наибольший интерес для проведения технических расчётов в термодинамике представляют газ и жидкость. При увеличении давления термодинамическое различие в их свойствах заметно уменьшается и в критической точке исчезает полностью.
Критические параметры являются важнейшими термодинамическими постоянными вещества. Понятие критической температуры введено Д. И. Менделеевым.
Критическая температура Тк – это температура, при которой и выше которой газ никаким сжатием не может быть переведён в жидкое состояние. Критическое давление рк – это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние, а критический объем представляет собой максимальный объем данного количества вещества в жидком состоянии.
В закритической области (p > Рк; т > Тк) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путём по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например, по линии 1 -1'- 2'- 2 (рисунок).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путём непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния F(p, v, T) = 0, описывающее любое однофазное состояние вещества.
В термодинамических системах в качестве рабочего тела часто рассматрива¬ется идеальный газ. Идеальными называются газы, у которых молекулы пред¬ставляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Уравнением состояния идеального газа является уравнение Клапейрона (1834 г.) для произвольной массы и 1 кг:

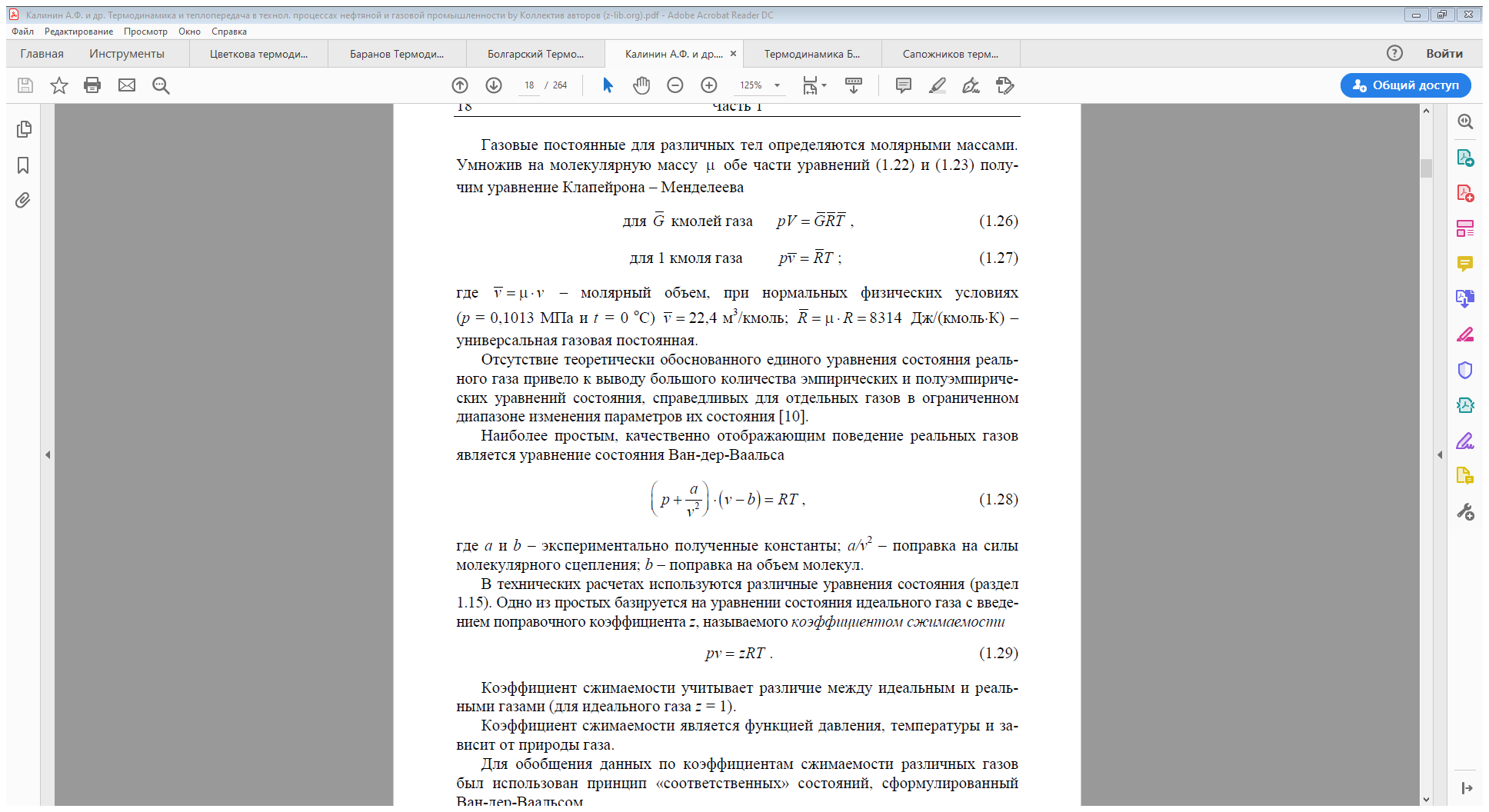


Для более точных оценок коэффициентов сжимаемости газов необходимо использовать специальные таблицы и формулы.
Уравнение состояния, записанное в виде F (w, п, т) = 0, называется приведённым уравнением состояния. Оно не содержит индивидуальных констант вещества.
Тема 2. Смеси газов и жидкостей. Характеристики смесей: состав, кажущаяся молекулярная масса, характеристическая газовая постоянная, теплоемкость, критические параметры. Закон соответственных состояний вещества.
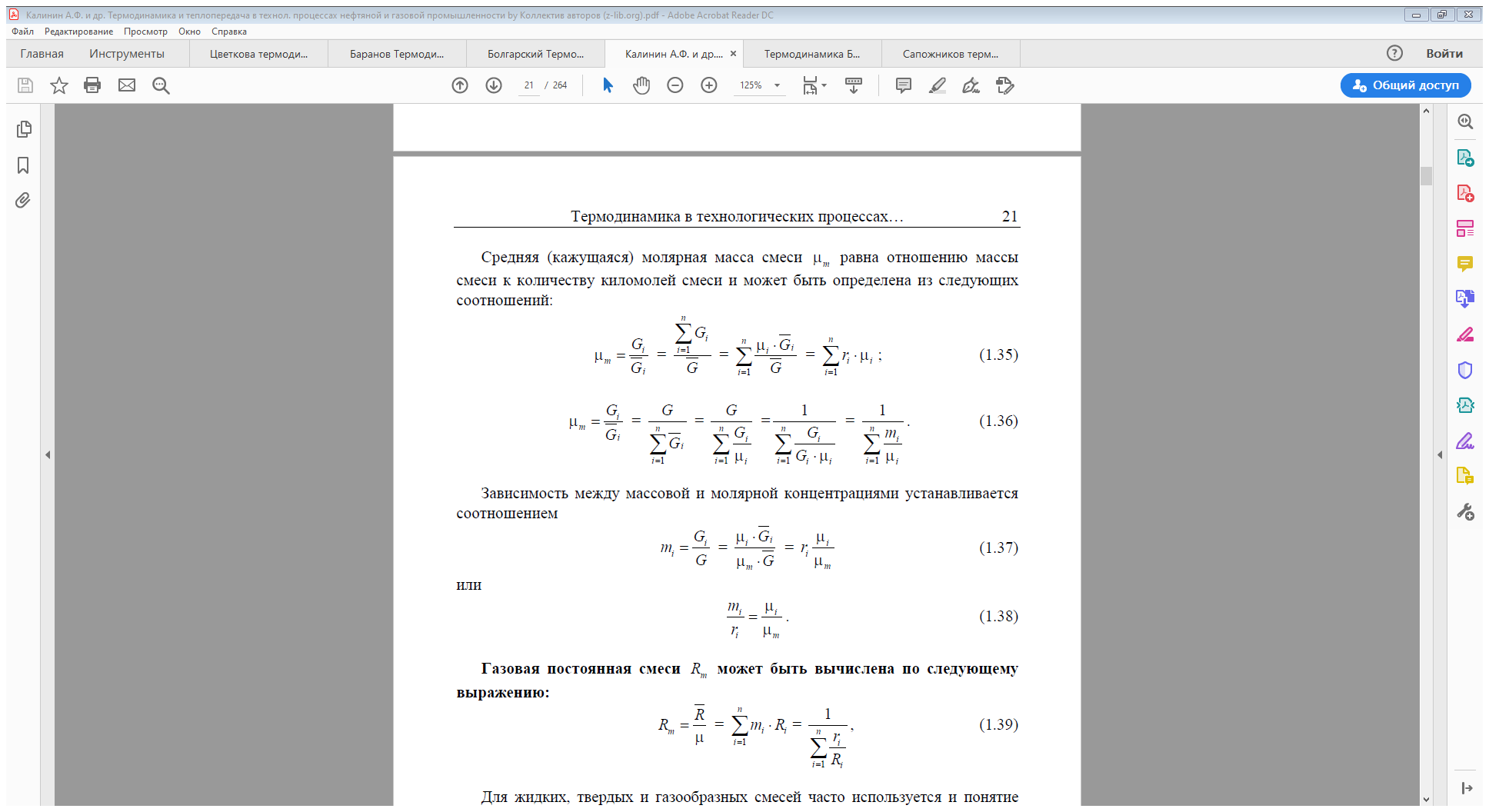
Термодинамическая система - объект исследования термодинамики, может представлять собой смесь химически не взаимодействующих между собой чистых веществ.
Предполагается также, что структура отдельных компонентов смеси в процессе смесеобразования и стабилизации смеси не изменяется.

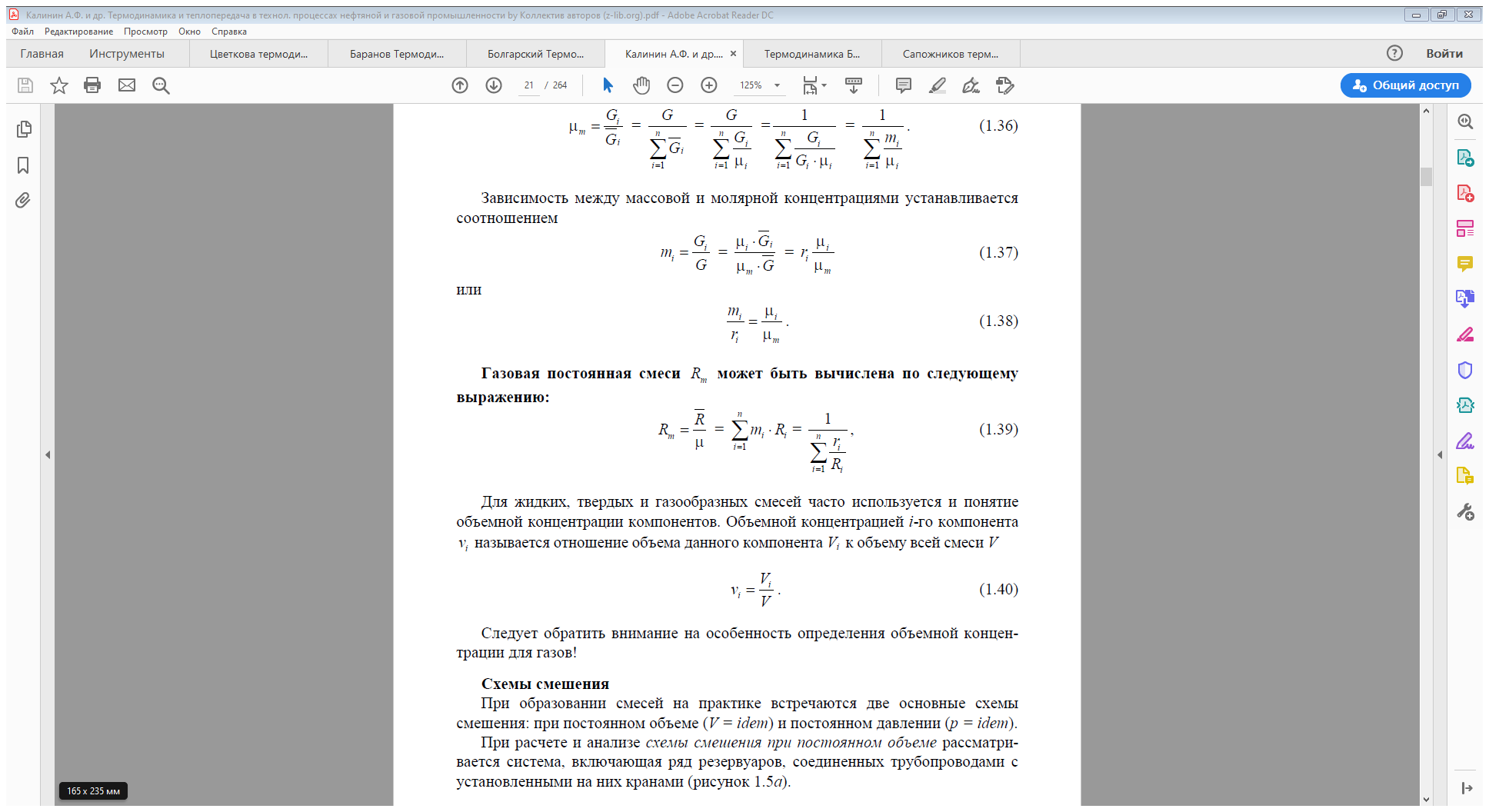
При образовании смесей на практике встречаются две основные схемы смешения: при постоянном объёме (V = idem) и постоянном давлении (p = idem).
При расчёте и анализе схемы смешения при постоянном объёме рассматривается система, включающая ряд резервуаров, соединённых трубопроводами с установленными на них кранами (рисунок 1.5а).

Смесеобразование при постоянном давлении происходит в трубопроводах (рисунок 1.5 б). К общему трубопроводу отдельными потоками подводятся компоненты.
Для каждого компонента известны: массовый расход Gi , молярная масса, давление pi и температура Ti . Смесеобразование в трубопроводе возможно лишь в случае, когда давление каждого компонента pi больше среднего давления смеси в трубопроводе pm. При прохождении запорного устройства давление компонента уменьшается до среднего давления смеси pm - отсюда наименование схемы (p = idem).
Заключительные стадии процесса смешения при p = idem - выравнивание температур, концентраций компонентов в смеси (диффузионные процессы) и переход системы в состояние термодинамического равновесия.
В процессе смешения при p = idem теплота извне не подводится и внешняя работа не совершается.
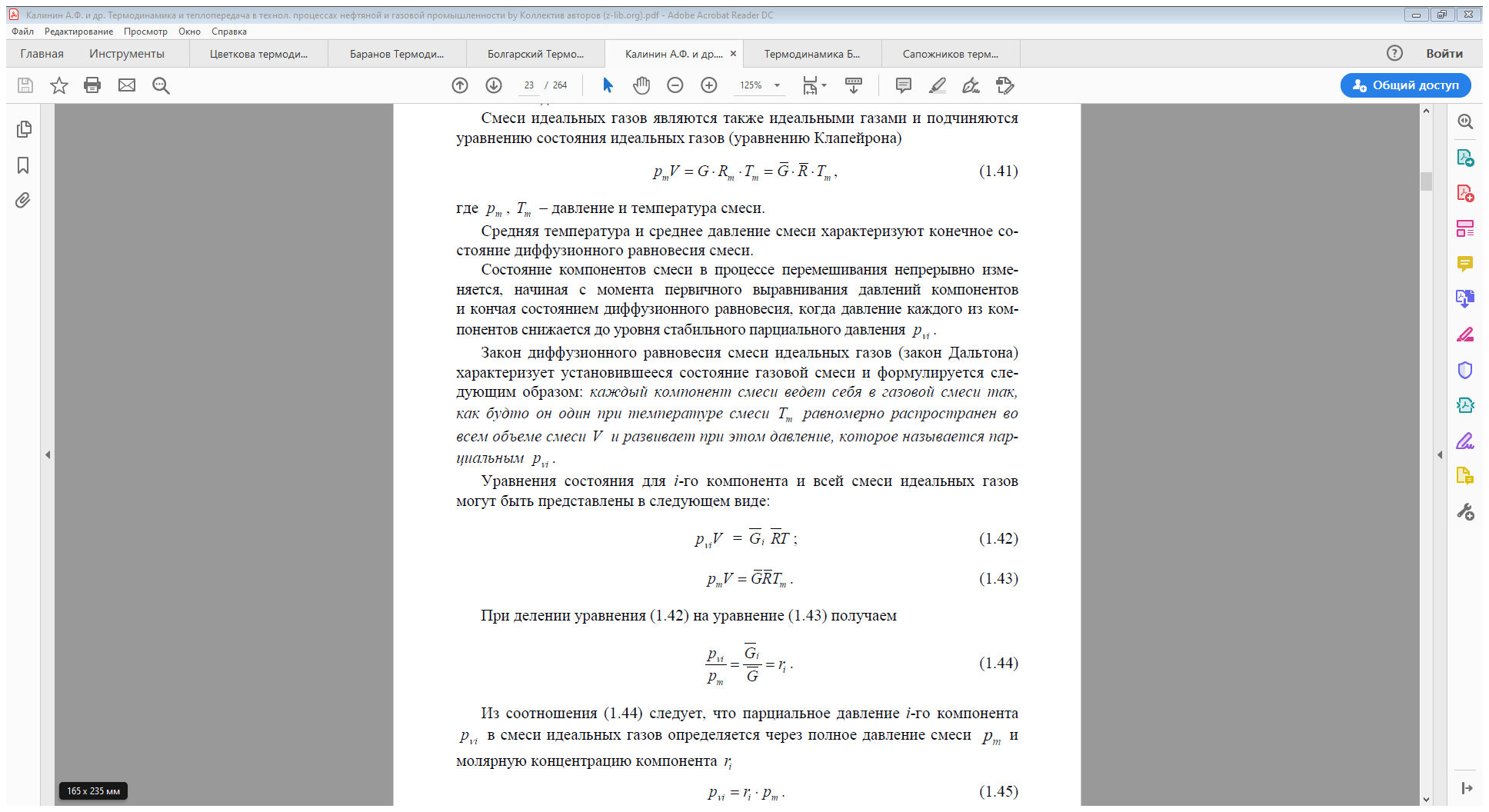
Смеси реальных газов
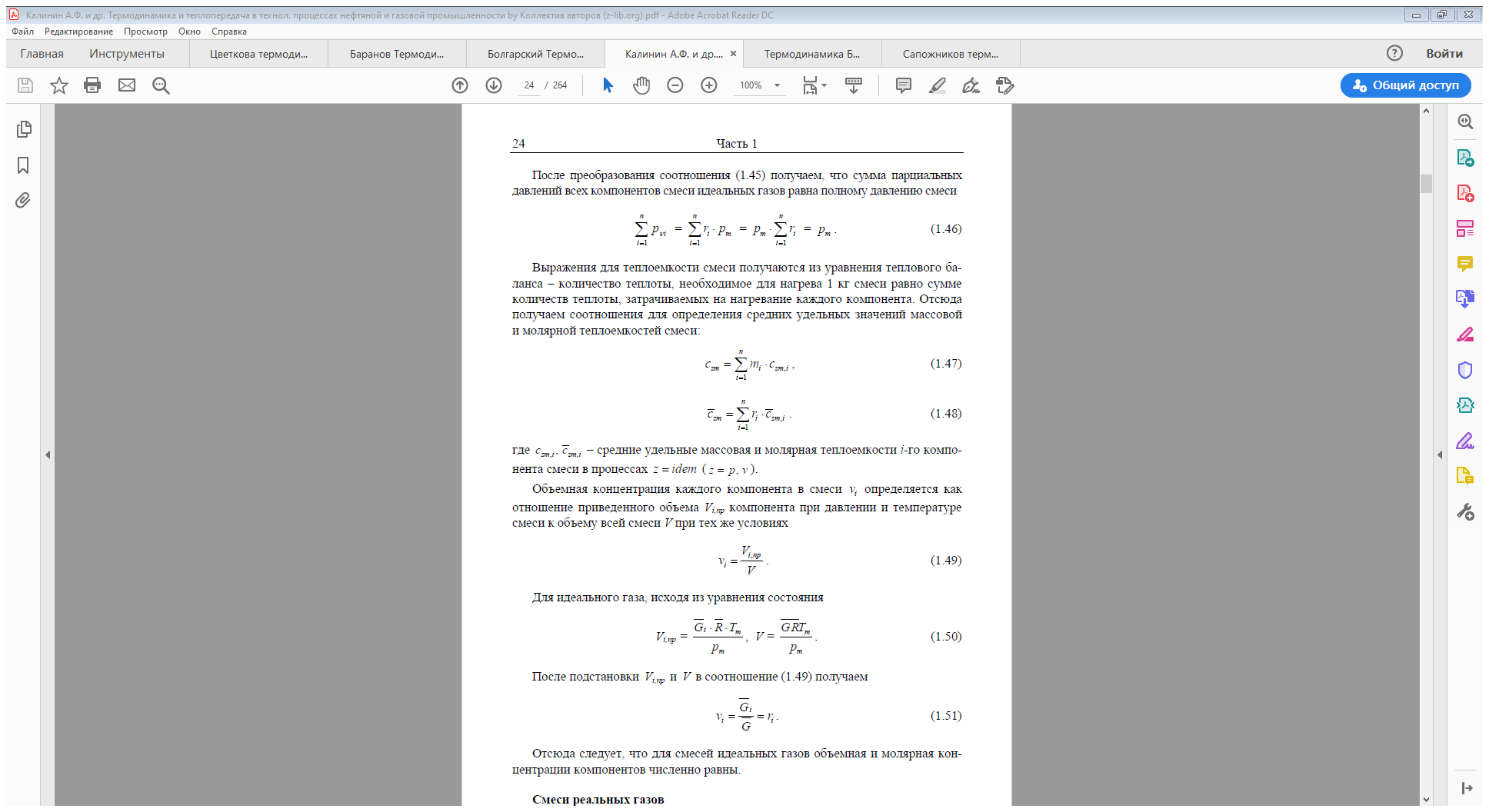
Для расчётов характеристик смесей реальных газов используются следующее уравнение состояния
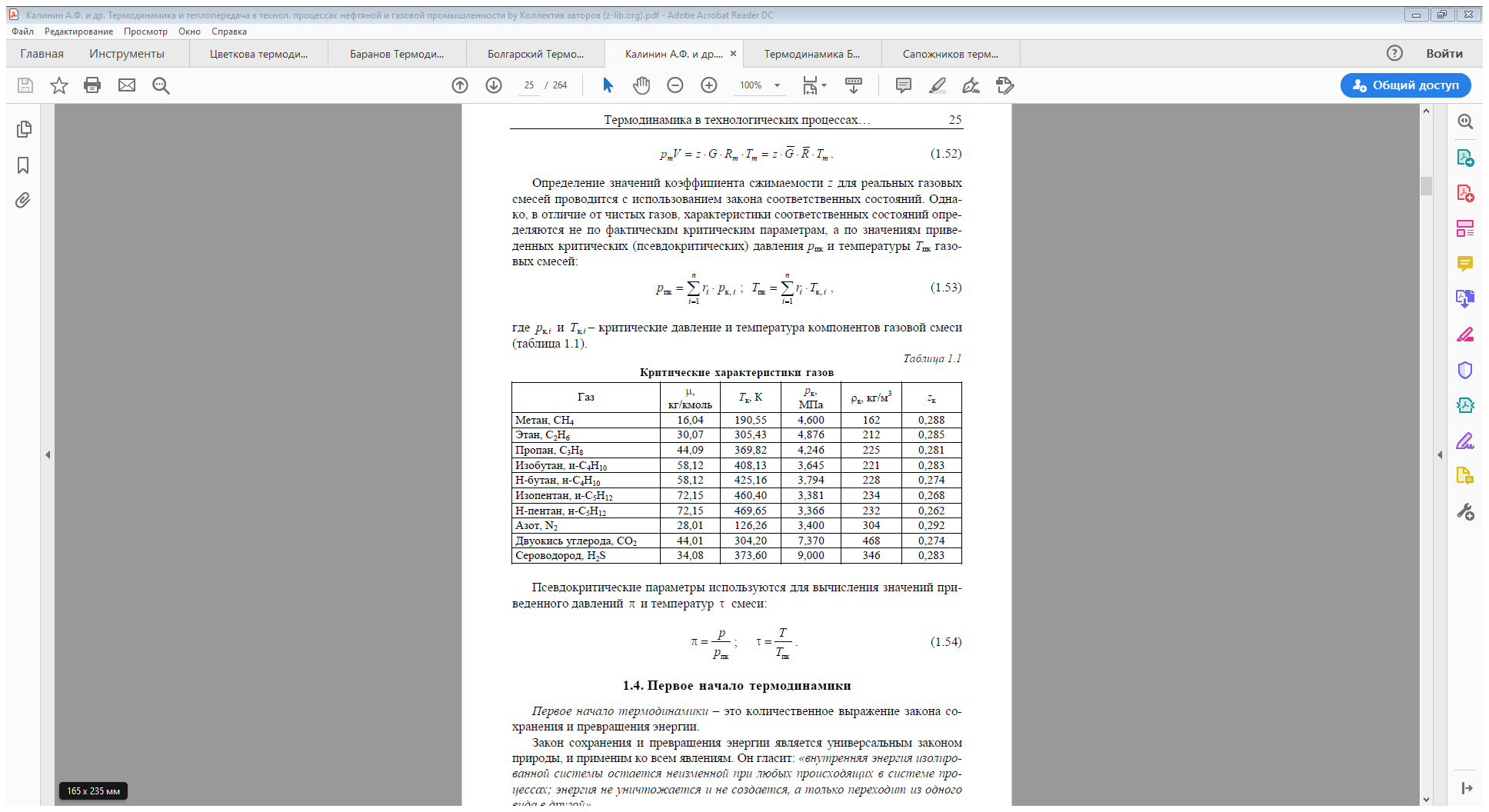
Тема 3. Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии. Понятие о внешнем и внутреннем теплообмене. Внешний энергетический баланс и баланс рабочего тела.
Первое начало термодинамики - это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы, и применим ко всем явлениям. Он гласит: «внутренняя энергия изолированной системы остаётся неизменной при любых происходящих в системе процессах; энергия не уничтожается и не создаётся, а только переходит из одного вида в другой».
При построении термодинамики принимается, что все возможные энергетические взаимодействия между телами сводятся лишь к передаче теплоты и работы. При этом необходимо отметить, что в отличие от теплообмена, работа как форма энергетического взаимодействия в условиях обратимого течения явлений допускает возможность своего полного превращения в другие виды энергии.
В термодинамике приняты следующие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
В силу того, что теплообмен и передача работы являются единственными формами передачи энергии, изменение энергии изолированной системы (т.е. системы, которая энергетический не взаимодействует с окружающей средой или с другой системой) равно нулю.
Рассмотрим систему, к которой извне подводится или отводится теплота и подводится или отводится термодинамическая работа

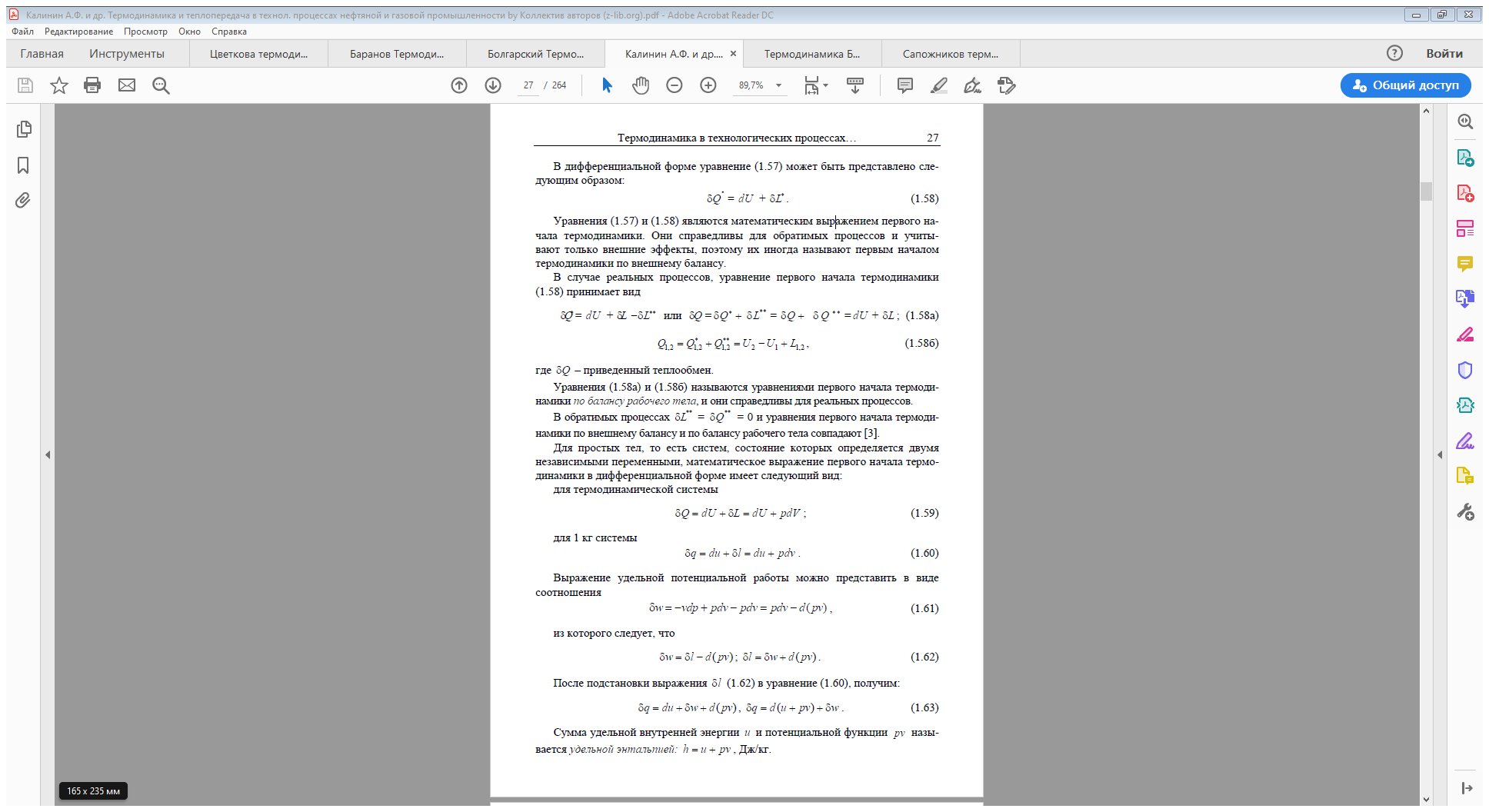
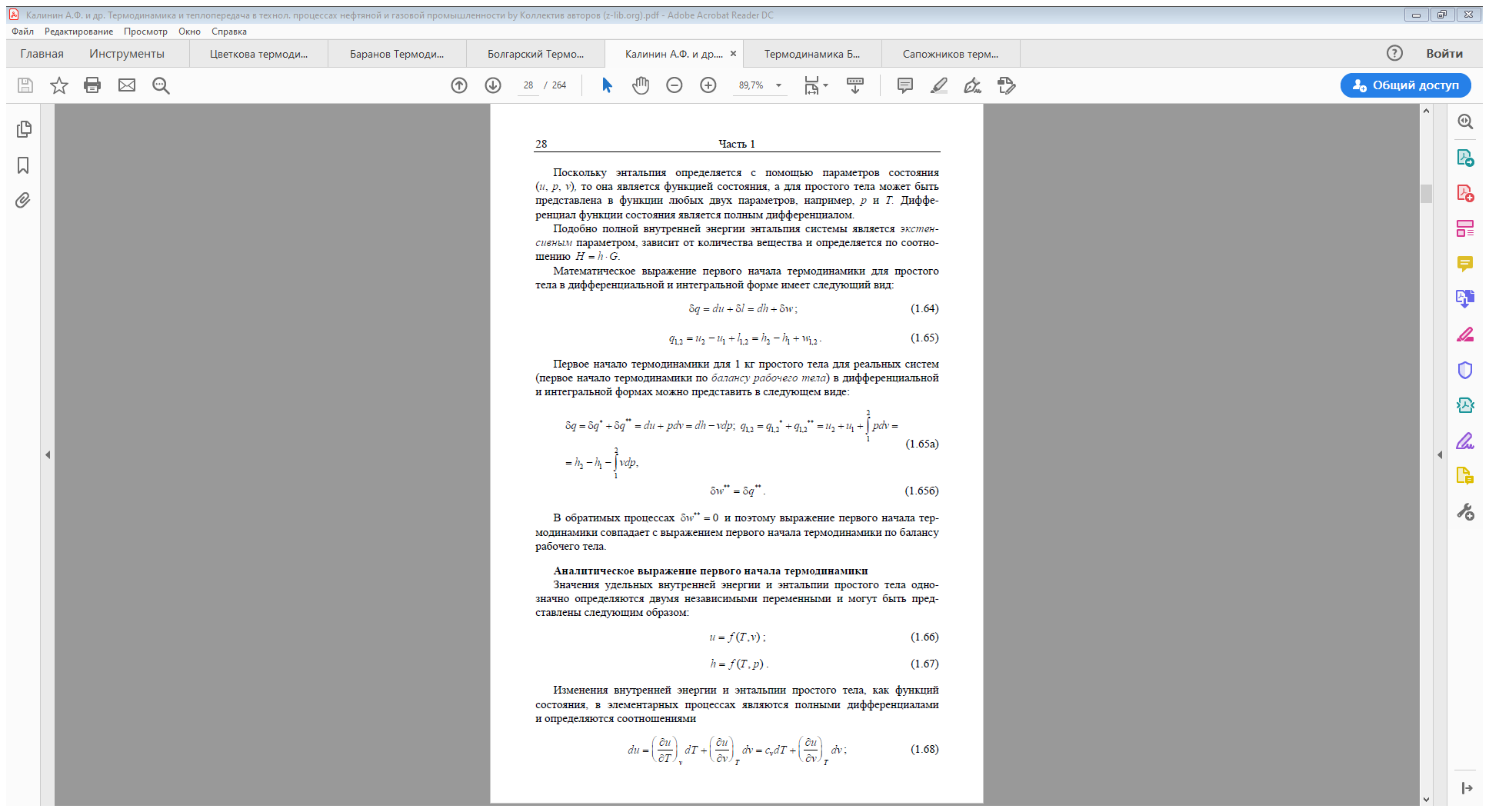
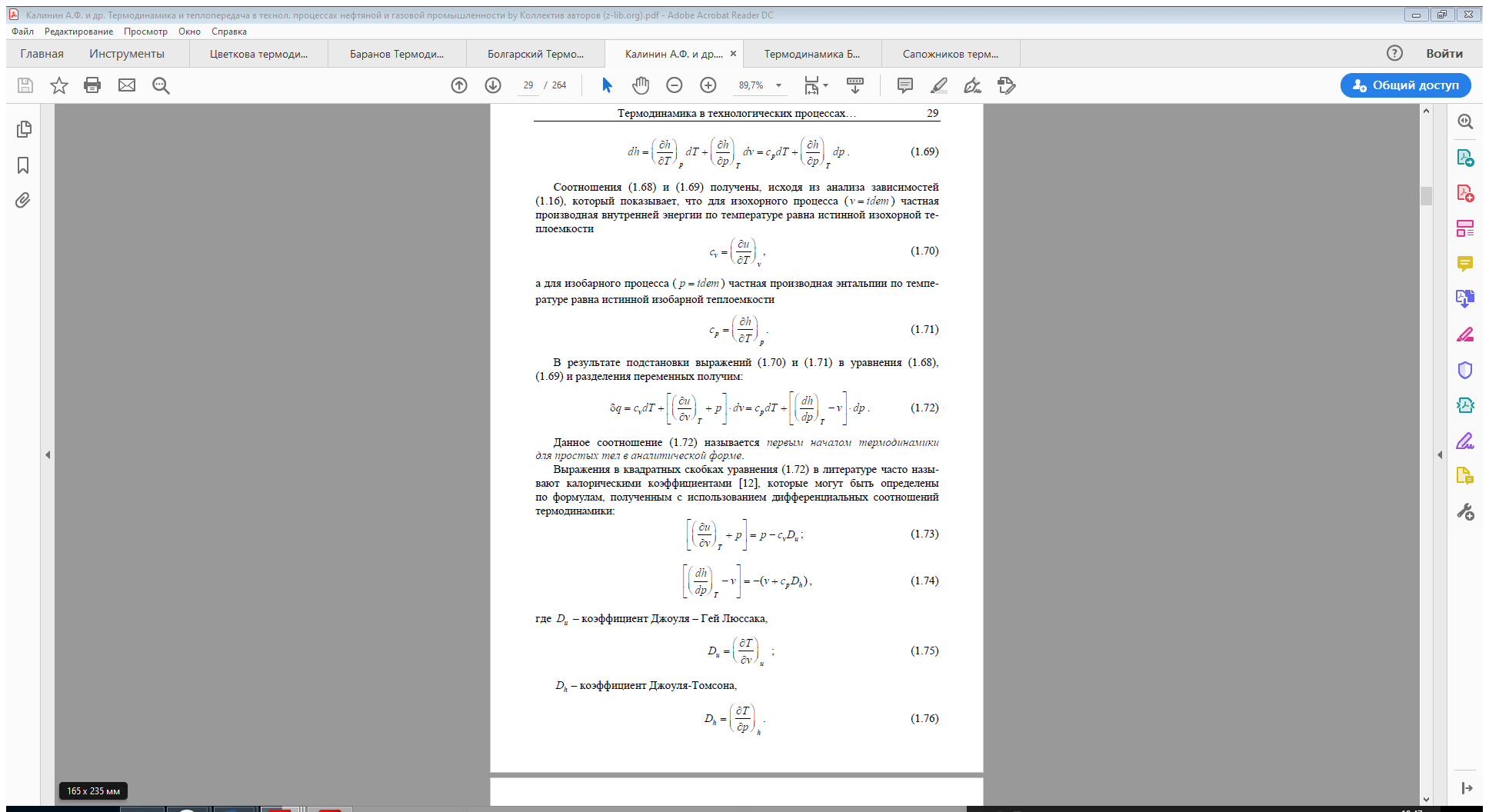
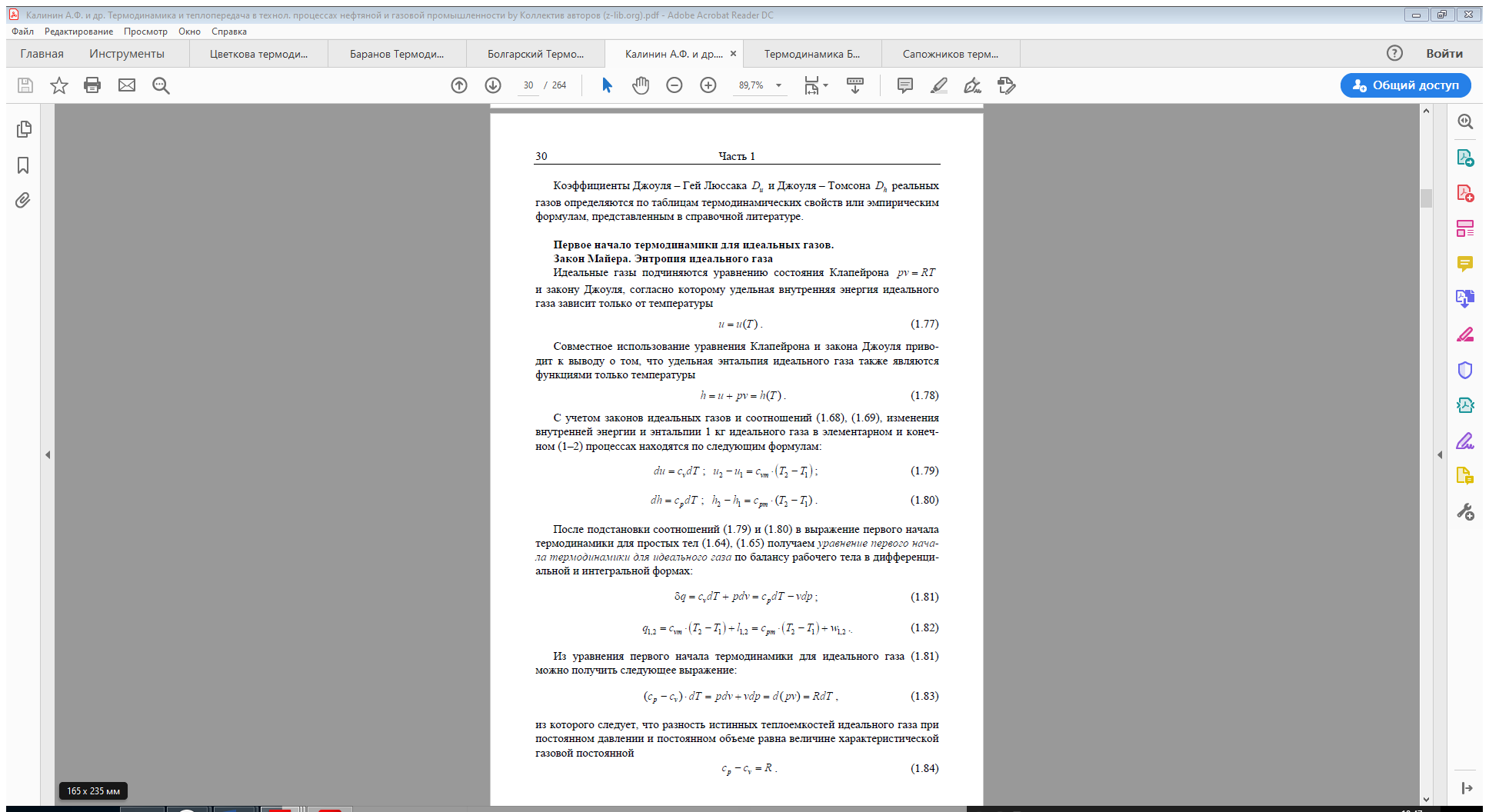
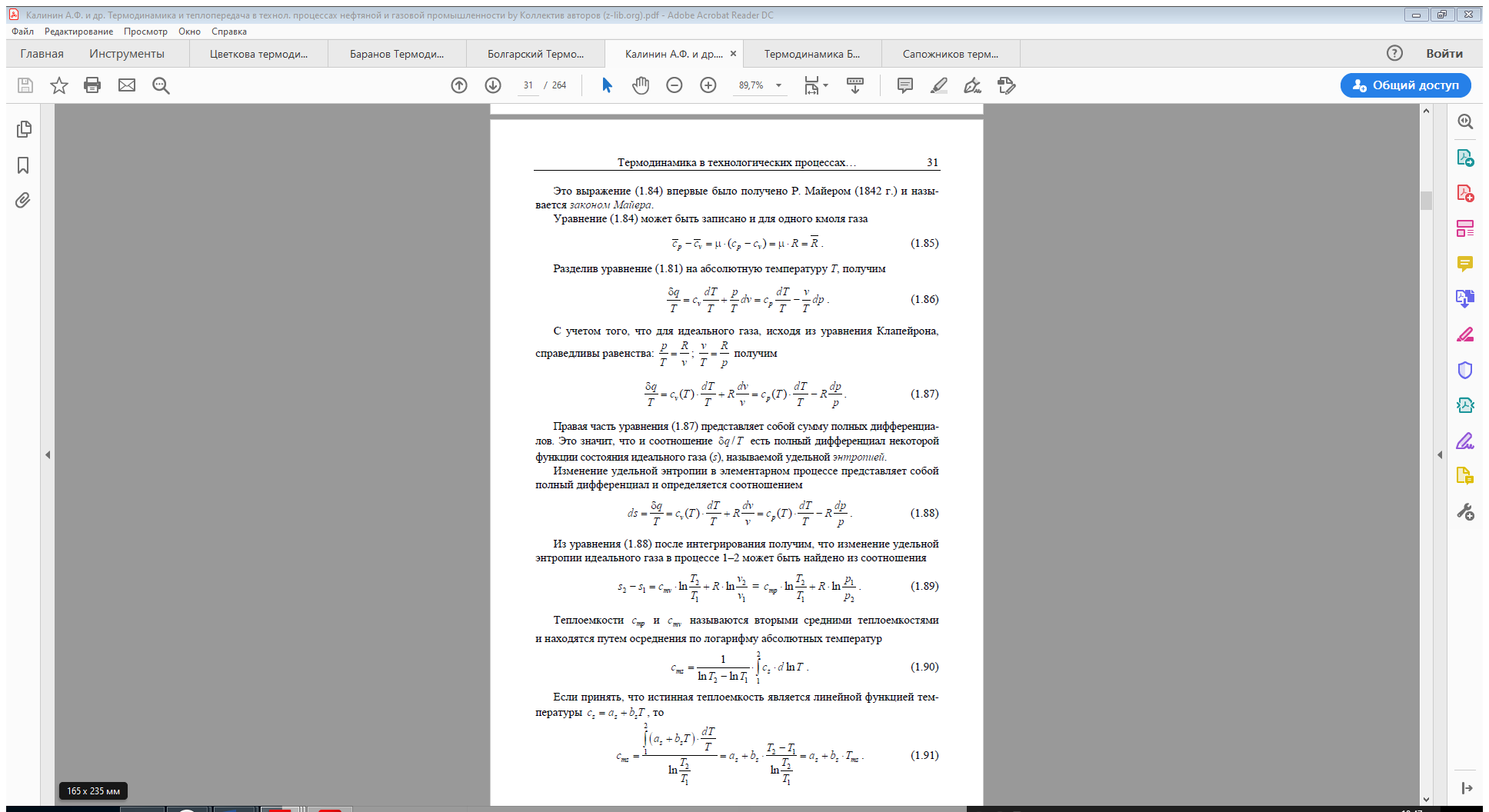
Таким образом, первая средняя теплоёмкость равна истинной теплоёмкости
при средней арифметической температуре процесса, а вторая – при сред
ней логарифмической температуре процесса. В случае, если bz > 0, то первая средняя теплоёмкость численно несколько больше второй.
Тема 4. Процессы изменения состояния. Классификация процессов изменения состояния любых термодинамических систем и простых тел. Политропические процессы, уравнение политропы с постоянным показателем, определение постоянного показателя политропы.



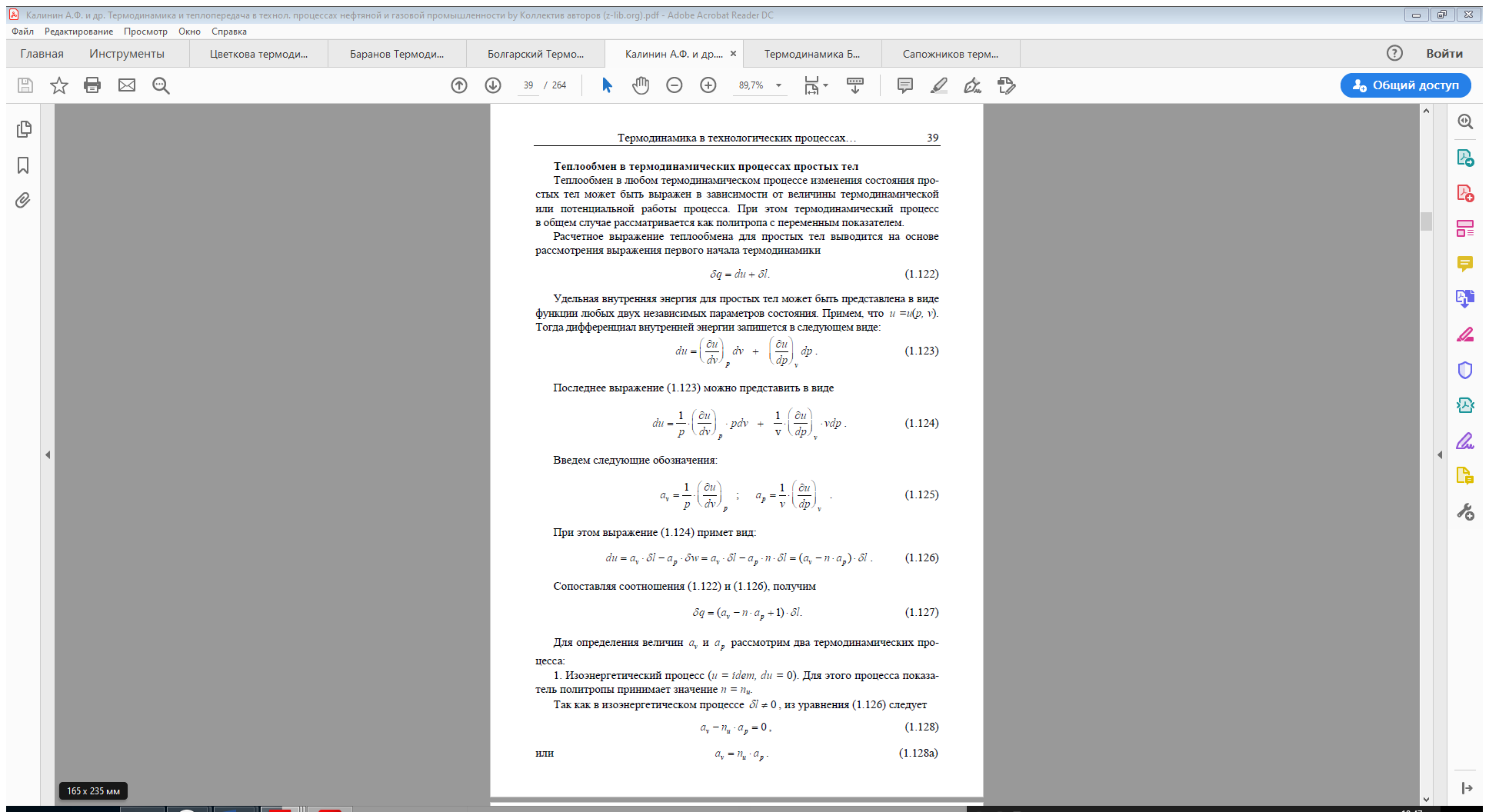
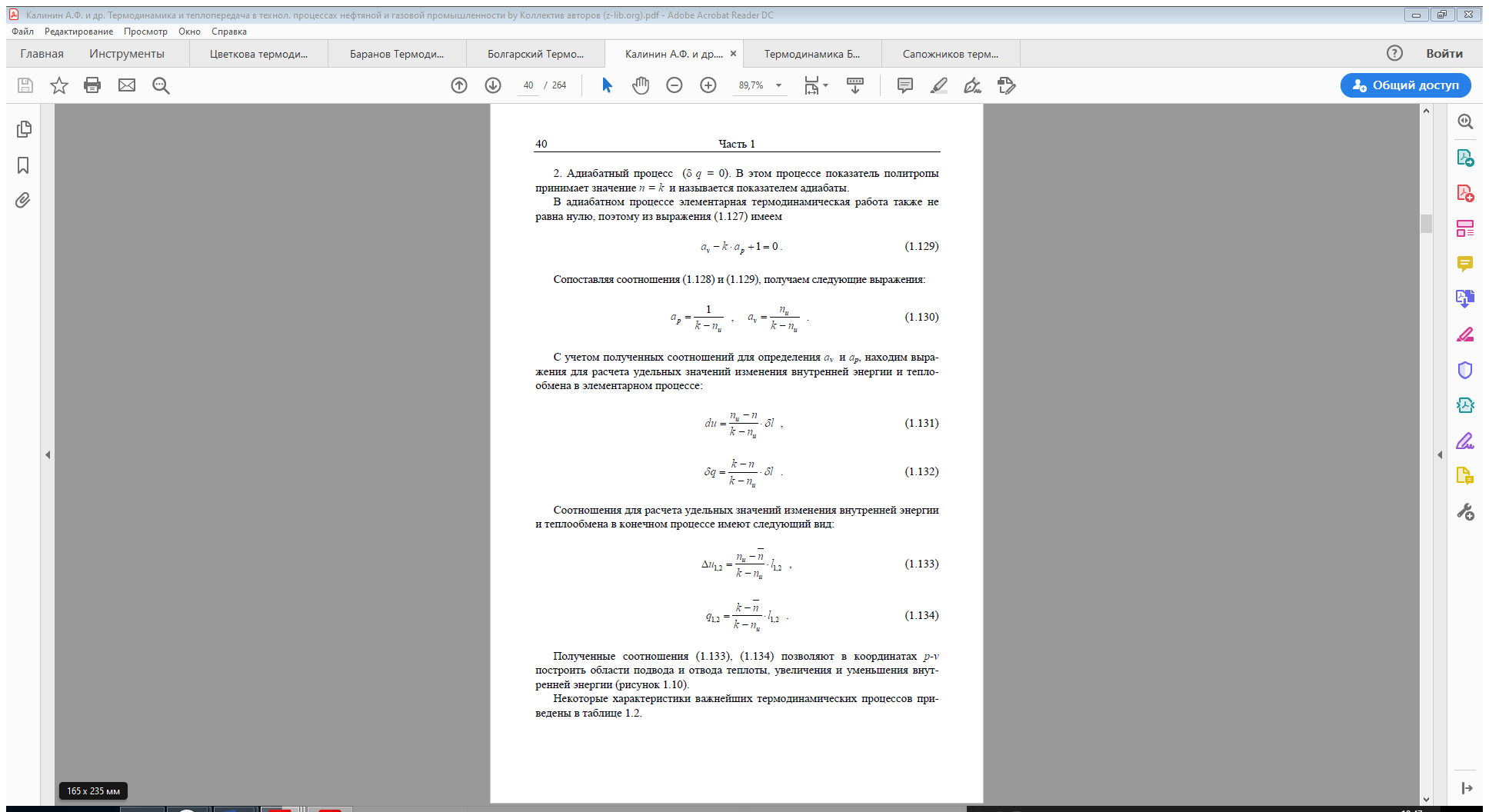
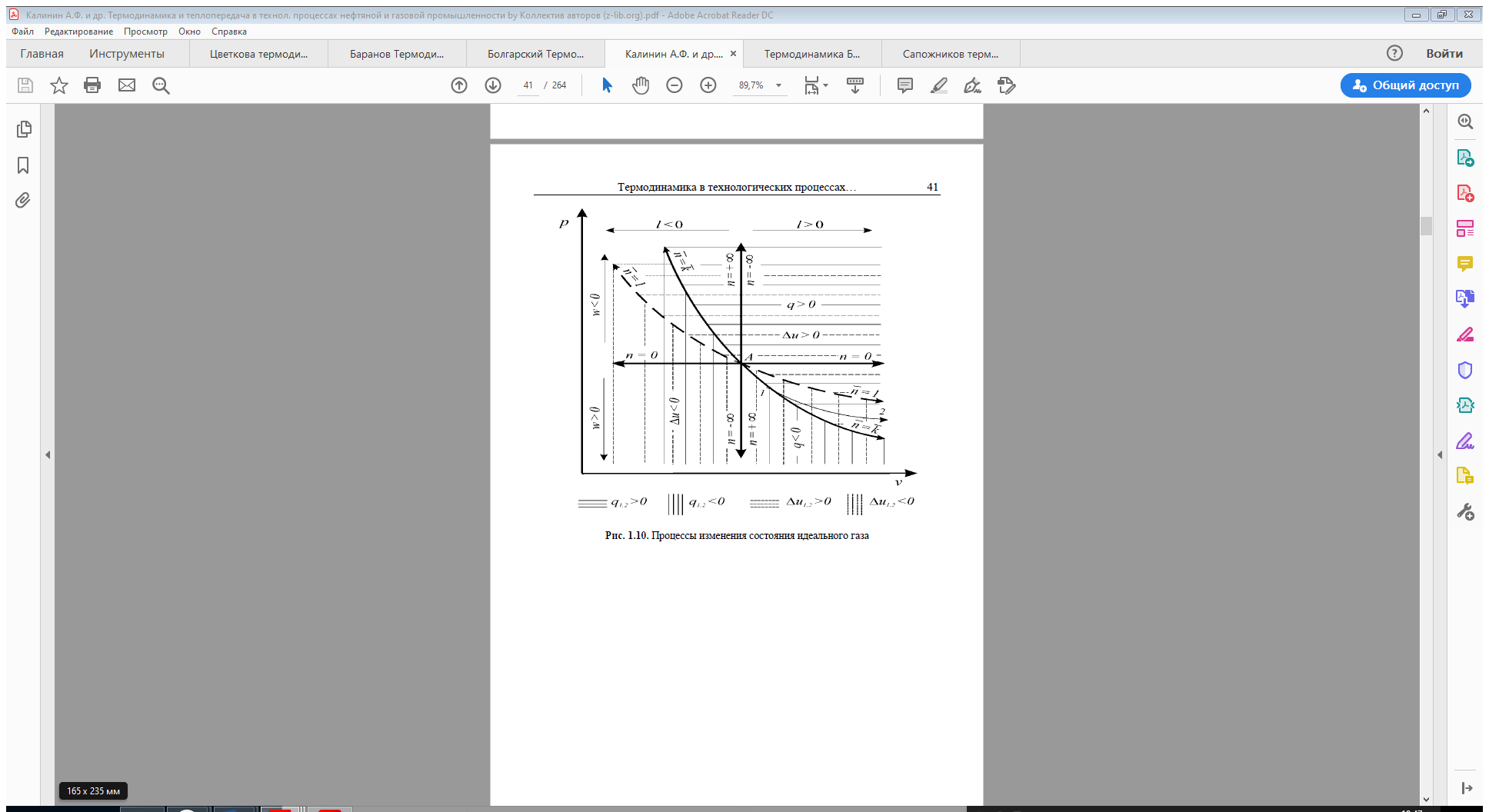


Тема 5. Круговые процессы - циклы. Первое начало термодинамики для круговых процессов. Цикл Карно. КПД цикла Карно.

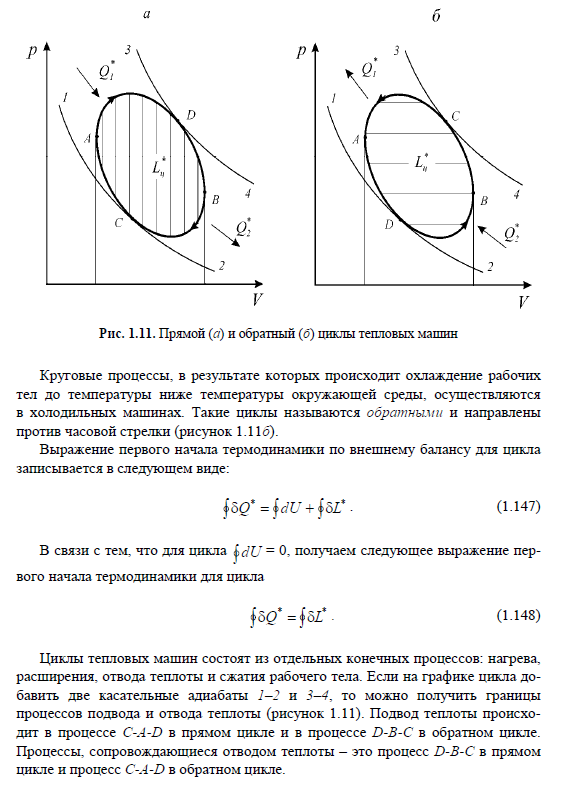




Тема 6. Второе начало термодинамики. Принцип существования энтропии. Математическое выражение. Основные следствия. Принцип возрастания энтропии. Математическое выражение. Основные следствия.










Тема 7. Парообразование, процессы изменения состояния паров.






Тема 8. Термодинамика потока. Истечение газов и паров, дросселирование. Уравнение первого начала термодинамики для потока, его анализ. Понятие истечения газа из сопел. Истечение несжимаемых жидкостей. Истечение паров и реальных газов.




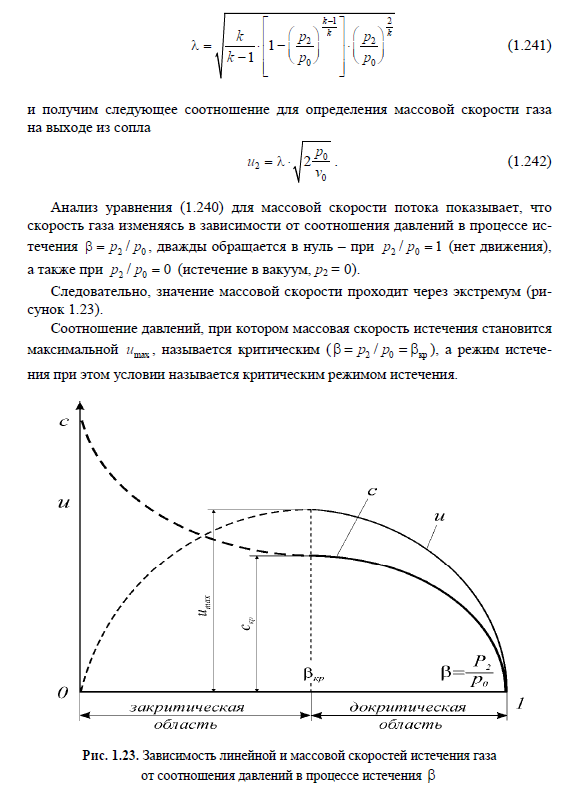




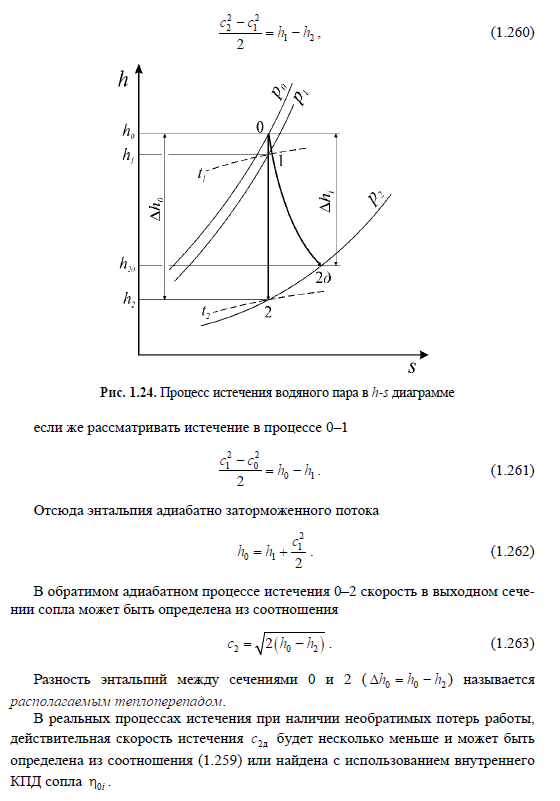



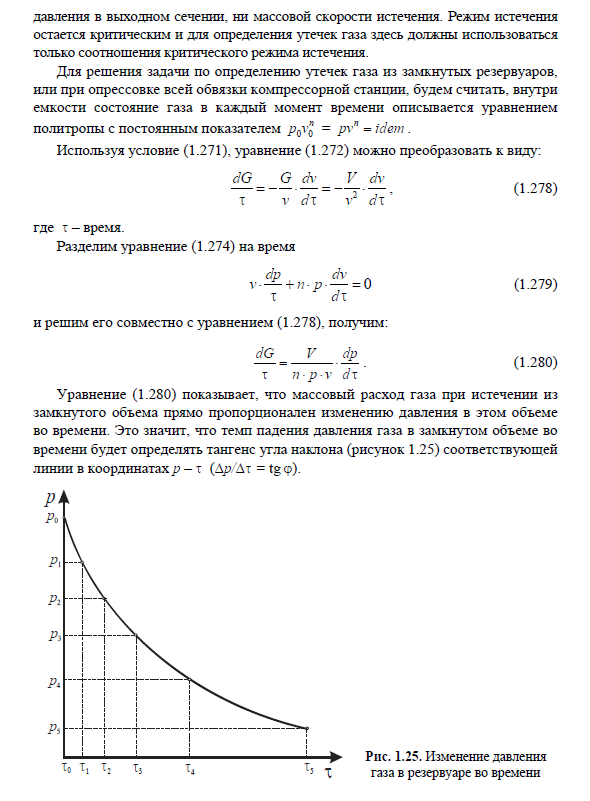




Тема 9. Термодинамический анализ процессов в компрессорах.
Тема 10. Циклы двигателей внутреннего сгорания и газотрубных установок. Циклы поршневых ДВС и ГТУ в «p-v» и «T-s» координатах.
