
Лабораторные работы / Лабораторная работа 1. Проверка применимости закона Бугера–Ламберта–Бера
.docxМИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ |
федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
Озерский технологический институт – филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (ОТИ НИЯУ МИФИ) |
|
Кафедра «Электроники и Автоматики»
ОТЧЁТ
ПО ЛАБОРАТОРНОЙ РАБОТЕ № 1
по дисциплине: «Физические основы получения информации»
«Проверка применимости закона Бугера–Ламберта–Бера к раствору комплексного соединения железа с сульфосалициловой кислотой»
Выполнили студенты группы 1ПС-38Д |
|
|
|
|
|
П.С. Сергеев |
|
|
|
|
В.С. Белканов |
|
|
|
А.И. Макаренко |
|
|
|
А.М. Артамонов |
Проверил преподаватель кафедры ЭиА |
|
|
В.Н. Сергеев |
2020
Цель работы: Проверить применимость закона Бугера–Ламберта–Бера к раствору комплексного соединения железа с сульфосалициловой кислотой.
Средства измерения и реактивы: фотоэлектроколориметр – КФО или КФК-3 с набором кювет; мерные колбы вместимостью 50 см3 – 6 шт.; пипетки вместимостью 1-10см3; стандартный раствор соли железа (III) с содержанием железа 0,1 мг/см3; 10% раствор сульфосалициловой кислоты C7H6O6S; серная кислота – 1 моль/л; 10% раствор аммиака.
Краткая теория.
Признаком применимости законов светопоглошения к поглощающей среде является пропорциональная зависимость оптической плотности этой среды от концентрации вещества и толщины поглощающего слоя.
Для проверки применимости законов светопоглощения к раствору комплексного соединения железа с сульфосалициловой кислотой необходимо определить оптические плотности одного и того же раствора, но при различной толщине поглощающего слоя, а затем – оптические плотности для различной концентрации комплексного соединения при постоянной величине поглощающего слоя раствора. Если при построении графиков в соответствующих координатах получаются прямые, проходящие через начало координат, то это является признаком выполнения закона Бугера–Ламберта–Бера.
При взаимодействии железа (III) с сульфосалициловой кислотой образуются комплексы, состав и окраска которых зависят от кислотности раствора. В кислой среде (pH=1,8 – 2,5) получают моносульфосалицилатный (соотношение железо (III): сульфосалицилат = 1:1) катионный комплекс краснофиолетового цвета (λmax = 510 нм и εmax = 1,8×103), в щелочной среде (pH=9 – 11,5) получают трисульфосалицилатный жёлтый комплекс (λmax = 416 нм и εmax = 5,8×103) с соотношением компонентов 1:3.
Определению железа (III) не мешают фосфаты, бораты, ацетаты. В присутствии ионов магния, алюминия, марганца реакцию проводят только в кислой среде.
Ход работы.
В мерную колбу вместимостью 50 см3 поместим 3 см3 стандартного раствора железа (III) с его содержанием 0,1 мг/см3.
Добавим 1 см3 раствора серной кислоты 1 моль/л.
Добавим 5 см3 10% раствора сульфосалициловой кислоты.
Доведём до метки дистиллированной водой и перемешаем.
Измерим оптическую плотность на фотоэлектроколориметре при длине волны 510 нм относительно воды в кюветах с размером между рабочими гранями 0,5; 1,0; 2,0; 3,0; 5,0 см.
Построим график в координатах оптическая плотность – толщина слоя раствора (A = f (L, см)).

Рассчитаем молярный коэффициент поглощения ε.
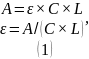
C – молярная концентрация вещества в растворе.
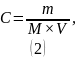
m – масса железа в растворе;
M – молярная масса железа;
V – объём раствора.
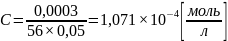 ;
;
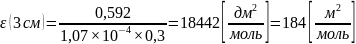 .
.
В мерные колбы вместимостью 50 см3 отберём по 10 см3 дистиллированной воды и соответствующие объёмы раствора железа (III), чтобы масса его в них составляла 0,05; 0,10, 0,15: 0,20; 0,30 мг.
В каждую колбу добавим 1 см3 раствора серной кислоты 1 моль/л.
В каждую колбу добавим 5 см3 10% раствора сульфосалициловой кислоты.
Доведём до метки дистиллированной водой и перемешаем.
Измерим оптическую плотность растворов на фотоэлектроколориметре при длине волны 510 нм относительно воды в кювете с толщиной слоя 5,0 см.
Построим график в координатах оптическая плотность – масса железа (III) (A = f (Q, мг)).

Рассчитаем молярный коэффициент поглощения ε и сделать заключение о выполнимости закона Бера.
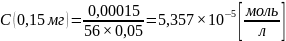 ;
;
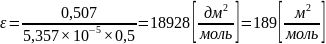 .
.
Вывод.
В ходе проведённой работы была установлена справедливость законов Бугера–Ламберта и Бера при их раздельном и совместном применении.
