ИЗ-1
.docx
|
|
|
|
МИНОБРНАУКИ РОССИИ
|
|||
Федеральное государственное бюджетное образовательное учреждение высшего образования «МИРЭА – Российский технологический университет» РТУ МИРЭА |
|||
Институт тонких химических технологий им. М.В. Ломоносова
Организация научно-исследовательской деятельности
Домашнее задание ИЗ-1
Вариант № 14
Выполнила: cтудентка группы ХБМО-02-20 Иванова Е.А.
Проверил: проф., д.х.н. Пестов С. М.
Москва 2020
Оглавление
Данные о веществе 3
Исходные данные 3
Расчеты 4
Результаты расчета 5
График зависимости мольной доли бифенила от обратной температуры 6
Выводы 7
Список литературы 8
Данные о веществе
Таблица 1. Данные о веществе [1]
Бифенил |
|
|
|
Формула |
C12H10 |
Молярная масса |
154.2 г/моль |
Агрегатное состояние |
твердое (кристаллы в форме белых игл) |
Температура плавления |
70.5°C |
Температура кипения |
255.0°C |
Плотность |
1.16 g/cm³ |
Исходные данные
Таблица 2. Растворимость бифенила в п-дихлорбензоле
-
Т, К
х1
300,9
0,425
307,3
0,496
314,4
0,575
323
0,692
330,6
0,802
334,6
0,859
338,2
0,923
Расчеты
Для расчета растворимости используем уравнение Шредера (в рамках модели идеальных растворов):
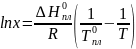
где x – мольная доля растворенного вещества в насыщенном растворе при температуре T,
R = 8,314 Дж/(моль*К) – универсальная газовая постоянная,
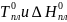 – температура
и энтальпия плавления чистого вещества.
– температура
и энтальпия плавления чистого вещества.
Для дальнейшего упрощения записи и расчетов проводим следующие замены:
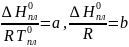
Данные значения можно вычислить из уравнения, описывающего прямую зависимости мольной доли бифенила от обратной температуры (рис.1).
Для расчета погрешности определения энтальпии плавления воспользовались следующими формулами:
Дисперсии адекватности модели:
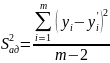
yi и yi’ – экспериментальные и расчетные данные соответственно, m- количество экспериментальных точек
Дисперсии для коэффициентов a и b:
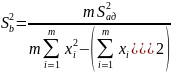
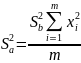
Погрешности для коэффициентов:
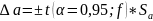
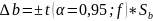
tα,f – критерий Стьюдента, f = m-1 – число степеней свободы.
Погрешности для энтальпии:
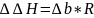
Ответ
представлен в виде
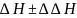
Результаты расчета
Таблица 3. Результаты расчета энтальпии растворения в п-дихлорбензоле
Т, К |
х1 |
1/T, 1/K |
Y=ln(x1) |
Ŷ |
(Y-Ŷ)2 |
Sад2 |
x2 |
Sb2 |
Sb |
Sa2 |
Sa |
∆a |
∆b |
300,9 |
0,425 |
0,00332 |
-0,856 |
-0,856 |
1,827E-10 |
0,00004 |
1,104E-05 |
376,825 |
19,412 |
0,004 |
0,061 |
0,148 |
47,482 |
307,3 |
0,496 |
0,00325 |
-0,701 |
-0,710 |
7,752E-05 |
1,059E-05 |
|||||||
314,4 |
0,575 |
0,00318 |
-0,553 |
-0,555 |
3,638E-06 |
1,012E-05 |
|||||||
323 |
0,692 |
0,00310 |
-0,368 |
-0,377 |
7,847E-05 |
9,585E-06 |
|||||||
330,6 |
0,802 |
0,00302 |
-0,221 |
-0,227 |
4,309E-05 |
9,149E-06 |
|||||||
334,6 |
0,859 |
0,00299 |
-0,152 |
-0,151 |
7,966E-07 |
8,932E-06 |
|||||||
338,2 |
0,923 |
0,00296 |
-0,080 |
-0,084 |
1,601E-05 |
8,743E-06 |
|||||||
∑ |
4,772 |
0,0218 |
-2,931 |
-2,960 |
2,195E-04 |
6,816E-05 |
В расчете использовались некоторые дополнительные значения. Они представлены в таблице 4.
Таблица 4. Некоторые значения, используемые при расчете
-
b=
-2105,000
a=
6,14
t=
2,446
∆Н=
17500,97
=
17,50
∆∆Н=
394,76
=
0,39
Доверительный
интервал энтальпии составляет: 17,50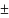 0,39
кДж/моль.
0,39
кДж/моль.
График зависимости мольной доли бифенила от обратной температуры
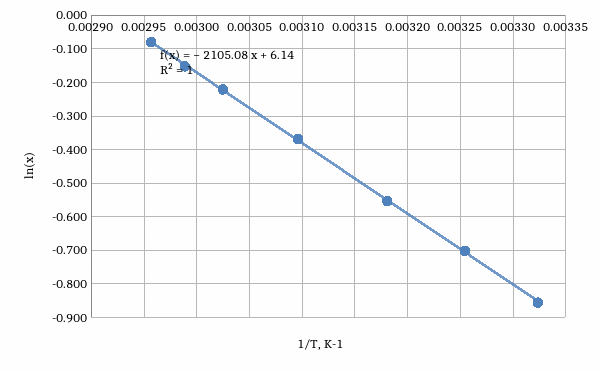
Рис. 1. Зависимость растворимости бифенила от обратной температуры в п-дихлорбензоле.
Выводы
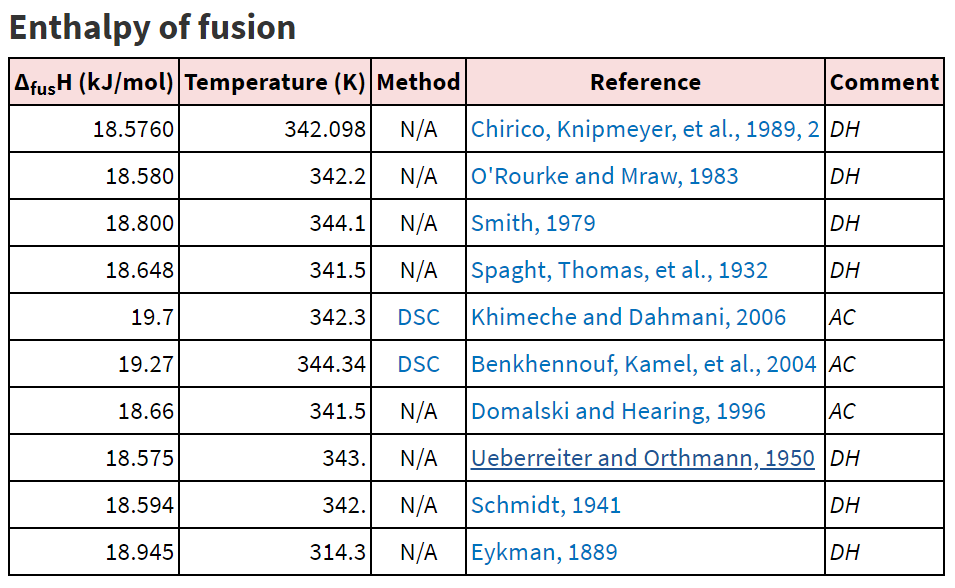
Расчетное значение энтальпии растворения бифенила в п-дихлорбензоле составило 17,50 0,39 кДж/моль, что практически совпадает с экспериментальным значением 18,66 кДж/моль, указанным в таблице 4 [2].
Таблица 4. Экспериментальная энтальпия растворения бифенила
Список литературы
Википедия: Свободная энциклопедия [Электронный ресурс]. – Электрон. данные. – Режим доступа: https://ru.wikipedia.org/wiki/Дифенил (дата обращения: 10.10.20).
National Institute of Standards and Technology [Электронный ресурс]. – Электрон. данные. – Режим доступа: https://webbook.nist.gov/cgi/cbook.cgi?ID=C92524&Units=SI&Mask=4#Thermo-Phase (дата обращения: 10.10.20).