
Пищевая Биохимия / Рогожин В.В., Рогожина Т.В. Биохимия сельскохозяйственной продукции
.pdf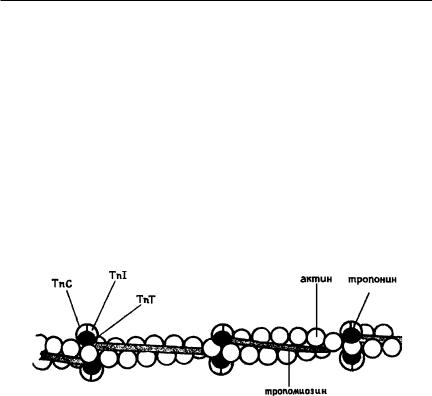
19.5. Сократительные белки мышц
с миозином, называемый актомиозином, который обладает АТФазной активностью, стимулируемой ионами магния. Концы F-актиновых молекул присоединяются к белковой молекуле (α-актинин), проявляя образование, которое называется Z-линией.
19.5.3. Тропомиозин
Тропомиозин — это белок (70 кДа), в составе которого две разные субъединицы, переплетающиеся между собой в α-спиралевидные фибриллярные структуры. Тропомиозин связывается в единый комплекс с F-акти- ном в области изгиба молекулы, обеспечивая его стабильность. По длине тропомиозин равен 7 субъединицам G-актина. При этом контактирует только с одной из нитевидных структур F-актина (рис. 19.11). Кроме того, тропомиозин совместно с тропонином участвует в регуляции взаимодействия актина с миозином.
Рис. 19.11. Строение тонкого филамента, в составе которого актин, тропомиозин и тропонин
19.5.4. Тропонин
Тропонин — белок поперечнополосатых мышц (76 кДа). Имеет вид вытянутого в длину белка (76 кДа). Состоит из трех разных по структуре и функциям субъединиц: тропомиозинсвязывающей ТnТ, ингибирующей TnI и кальцийсвязывающей TnC (см. рис. 19.11). Располагается на конце каждой молекулы тропомиозина. Тропонин способен связываться как с актином, так и с тропомиозином. Тропомиозинсвязывающая субъединица тропонина состоит из 259 аминокислотных остатков (37 кДа), обеспечивает связывание тропонина с тропомиозином. Ингибирующая субъединица тропонина состоит из 179 аминокислотных остатков и обеспечивает связывание белка с актином, предотвращая при этом взаимодействие миозина с актином, подавляя их АТФазную активность. Кальций-
473

Глава 19. Биохимия мышц и мяса
связывающая субъединица имеет в составе 159 аминокислотных остатков (18 кДа); функциональная активность субъединицы проявляется за счет того, что на поверхности белковой молекулы располагаются шесть центров связывания ионов. Причем в четырех центрах происходит специфичное связывание двух ионов Са2+ и двух ионов Mg2+, тогда как два других центра способны связывать оба иона. Активный актин-тропомиозин-тропонин- миозиновый комплекс проявляет Са2+/Mg2+-АТФазную активность.
19.5.5. Актинины
α-Актинин и β-актинин являются белками мышечной ткани, к которым присоединяются концы F-актиновых молекул тонких филаментов. Располагаются в зоне Z-линии. Состоят из двух субъединиц, каждая из которых имеет молекулярную массу по 90 кДа.
19.6. САРКОПЛАЗМАТИЧЕСКИЕ БЕЛКИ
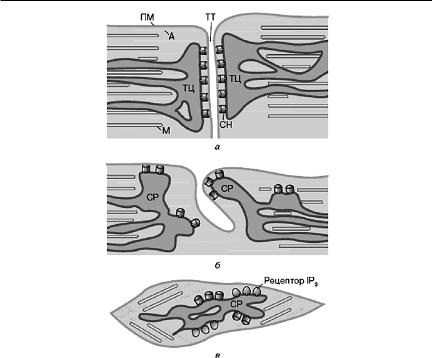
К группе саркоплазматических белков относятся гемсодержащие некаталитические и каталитические белки мембран, а также ферменты метаболических процессов. Кроме того, компонентами саркоплазмы являются антиоксиданты и другие функционально активные соединения, а также функциональные белки саркоплазматического ретикулума. Последний является высокоспециализированной мембранной структурой, представляющей собой хорошо развитую сеть мембранных цистерн и трубочек эндоплазматического ретикулума, проходящих через цитоплазму мышечных клеток вблизи миофибрилл (рис. 19.12).
Предназначен саркоплазматический ретикулум для выполнения роли регулятора в механизмах сокращения скелетных, сердечных и гладких мышц. Имеет для этой функции встроенные в мембраны Са2+ проводные каналы (рианодиновые рецепторы) и активно действующую Са2+-АТФазу, обеспечивающую быстрое освобождение необходимого для мышечного сокращения Са2+ из внутриретикулярного пространства в цитоплазму, а затем осуществляет обратный его транспорт. Са2+-АТФаза саркоплазматического ретикулума является представителем ионтранспортирующих АТФаз Ф-типа, к которому относятся Са2+-АТФаза плазматической мембраны, Na+,K+-АТФаза, H+,K+-АТФаза. Каталитические белки этой группы становятся функционально активными только после того, как терминальный остаток фосфорной кислоты от молекулы АТФ переносится на остаток аспарагиновой кислоты в активном центре АТФаз. Образованная в результате фосфорилирования форма фермента (Е-Ф) приобретает способность к действию, которому предшествуют значи-
474
19.6. Саркоплазматические белки
Рис. 19.12. Схематическое строение саркоплазматического ретикулума (СР)
вскелетных (а), сердечной (б) и гладких (в) мышцах (Рубцов, 2000) (А — актин,
М— миозин, ТЦ — терминальные цистерны, ТТ — трубочки Т-системы, ПМ — плазматическая мембрана, СН — соединительные ножки)
тельные изменения в структуре фермента и обуславливающие транспорт катионов через мембрану.
19.6.1. Гемсодержащие некаталитические белки
Гембелки представляют собой группу белков и ферментов. Эти белки обладают различными функциями и механизмом действия. Одни из них способны обратимо связывать кислород, транспортируя его к различным органам и тканям организма (гемоглобин, миоглобин), другие используют кислород в качестве субстрата. Последние катализируют окисление или переокисление различных соединений кислородом (цитохром Р450 и пероксидазы), участвуют в процессах переноса электронов (цитохромы b и с), катализируют разложение гидроперекисей (каталаза), восстановление кислорода до воды (цитохромоксидаза — комплекс цитохромов aa3). Приставки геми и гемо происходят от названий железопорфириновых
475

Глава 19. Биохимия мышц и мяса
группировок, при этом железо(II)порфириновый комплекс называют гемом, а железо(III)порфирин — гемином.
Строение функционально активных центров гемсодержащих белков, осуществляющих перенос и накопление кислорода, предопределяется уникальным расположением аминокислотных остатков в области связывания кислорода, что обеспечивает возможность выполнять присущие им функции. Гемоглобин, основного белок эритроцитов, и миоглобин, белок мышц, объединяет то, что функционально активной группой, содержащей Fe2+, является гем. Последний представлен протопорфирином IX, пирольные атомы азоты которого координируют с атомом железа(II).
Гемоглобин (Hb) и миоглобин (Мb) не являются ферментами, а осуществляют обратимое связывание кислорода и СО2. Отличительной особенностью Мb и Нb является то, что эти гембелки связывают кислород, не подвергая его химическому превращению, а образуя устойчивый комплекс, в котором О2 занимает шестое координационное положение.
Комплексы гемоглобина и миоглобина с кислородом достаточно нестабильны и присутствующий в них кислород способен инициировать реакции окисления:
Fe2+ + O2 → Fe2+O2 → Fe3+ + O2–
Скорость автоокисления гемоглобина и миоглобина зависит от природы белка, возрастает при повышении температуры, при подкислении или увеличении концентрации солей. Отмечается ускорение автоокисления у некоторых мутантных форм гемоглобинов, например, в случае замещения гистидина в активном центре гемоглобина на аргинин. Скорость автоокисления линейно зависит от концентрации протонов в интервале рН 5…7 и обратимо пропорциональна величине парциального давления.
Изменение окислительно-восстановительных потенциалов одно- и двухэлектронных реакций восстановления кислорода при рН 7,0 позволило выявить следующие их значения:
ē |
ē 2Н+ |
ē |
ē 2Н+ |
O2  O2–• Н2O2
O2–• Н2O2  НО• Н2O
НО• Н2O
—0,45 |
+0,98 |
+0,38 |
+2,33 |
+0,27 |
|
+1,35 |
|
Из этих данных видно, что, хотя кислород и является сильным окислителем, в процессах, в которых он принимает два электрона, он проявляет лишь слабые окислительные свойства в тех случаях, когда возможно присоединение только одного электрона.
Окислительно-восстановительный потенциал пары Fe2+/Fe3+ в гемоглобине и миоглобине имеет значения при рН 7,0 в водном растворе +0,2 и +0,1 В соответственно. Кроме того, кислород способен к окислительной
476

19.6. Саркоплазматические белки
модификации макромолекулы. Донорами электронов могут быть Fe2+, Cu+ и семихиноны.
Образующиеся в клетках активные формы кислорода вызывают образование органических гидропероксидов.
Fe2+ + O2 → Fe3+ + O2–
Н+ + O2– → НО2
НО2 + RH → Н2O2 + R
R + O2 → RO2
RO2 + RH → ROOH + R
Процесс образования ROOH называется перекисным окислением. В случае если RH липид, то весь процесс называется перекисное окисление липидов. Кроме того, перекисному окислению могут подвергаться ДНК, белки, а также другие органические молекулы.
Чрезмерное накопление АФК в клетках может способствовать возникновению патологических состояний, которые обуславливают развитие окислительного стресса у живого организма.
Факторами, вызывающими окислительный стресс, могут быть: повышенное содержание кислорода в среде, избыток гема, Fe2+, Cu+, ионизирующее и ультрафиолетовое излучение, большие дозы витамина А и некоторых ксенобиотиков. При развитии окислительного стресса повреждаются нуклеиновые кислоты, белки и липиды. Результатом повреждения ДНК служат окисления азотистых оснований, их модификация, разрыв полинуклеотидной цепочки и повреждение хромосом.
Таким образом, АФК являются мутагенами, а возникающие в результате их действия повреждения ДНК могут привести к гибели клеток или их злокачественному перерождению. Для предотвращения развития патологии от действия АФК в организме функционирует антиоксидантная система, предназначенная для подавления действия, вызванного присутствием в клетке избытка активных форм кислорода. Компонентами антиоксидантной системы (АОС) являются высоко- и низкомолекулярные антиоксиданты.
19.6.2. Каталитические белки саркоплазмы
Na+,K+-АТФаза. В клетках живых организмов всегда поддерживается асимметричное распределение ионов Na+ и K+, которое используется для генерации возбуждения в нервных и мышечных клетках, обеспечивая транспорт в клетку жизненно важных биогенных молекул (углеводов и аминокислот). Разная концентрация ионов Na+ и K+ внутри и снару-
477

Глава 19. Биохимия мышц и мяса
жи мембраны клетки обеспечивает протекание активного транспорта, который осуществляется с помощью специализированного фермента — Na+,K+-АТФазы. Причем поддерживается градиент ионов таким образом, что внутри клетки концентрация ионов K+ примерно в 30 раз выше, а ионов натрия в 10 раз ниже, чем в окружающей среде. Фермент располагается в структуре клеточной мембраны животных тканей. Основной деятельностью фермента является избирательный перенос ионов Na+ и K+ через мембрану с помощью энергии гидролиза АТФ. Возникающий в результате потенциал действия системы используется для генерации возбуждения, водно-солевого обмена, активизации клеточного метаболизма (синтез ацетилхолина, биосинтезы белка и липидов, ДНК- и РНКполимеразные реакции и др.),
В составе фермента две полипептидные цепочки, которые обозначаются α- и β-субъединицами и имеют в первичной структуре по 1016 и 302 аминокислотных остатка соответственно. Молекулярная масса α-субъ- единицы — 112, а β-субъединицы — 45 кДа. Причем малая субъединица гликозилирована, т. е. содержит на поверхности белковой молекулы несколько остатков углеводов. В структуре α-субъединицы располагается активный центр, осуществляющий гидролиз АТФ; имеются также участки связывания кардиостероидов, обращенные к наружной стороне мембраны. При этом большая субъединица погружена в мембрану, пронизывая ее насквозь. Центры связывания переносимых ионов располагаются в петле между второй и третьей спиралями, что обеспечивает работу α-субъедини- цы как транспортной системы мембран. β-Субъединица Na+,K+-АТФазы локализуется на наружной стороне мембраны, с обращенным в сторону цитоплазмы прикрепленных к ней остатков углеводов. Инициирующей молекулой Na+,K+-АТФазы служит АТФ, гидролиз которой обеспечивает энергией активный транспорт ионов, в котором участвуют ионы натрия, калия и магния. Активность фермента регулируется с помощью протеинкиназ, осуществляющих фосфорилирование Na+,K+-АТФазы, и фосфатаз, катализирующих отщепление остатка фосфорной кислоты. Кроме того, фермент находится под контролем гормональной системы. В частности, альдостерон способен активировать синтез фермента. Ингибитором фермента является строфантин G (уабаин), имеющий на поверхности белка участок связывания.
Са2+-АТФаза. Кальциевые АТФазы входят в состав цитоплазматических и внутриклеточных мембран. Фермент выполняет роль кальциевого насоса. Все Са2+-АТФазы являются мономерными белками, но различаются по молекулярной массе. При этом цитоплазматическая Са2+-АТФа- за имеет молекулярную массу 120 кДа, а саркоплазматического ретикулума — 108 кДа. Са2+-АТФаза обеспечивает обмен ионов Mg2+ на ионы Са2+, расходуя при этом АТФ. Перенос ионов Са2+ осуществляется против
478

19.6. Саркоплазматические белки
градиента его концентрации. Са2+-АТФаза выполняет роль насоса, осуществляя связывание, транспорт и высвобождение перенесенного кальция. Процесс осуществляется за счет энергии гидролиза одной молекулы АТФ Са2+-АТФазой, которая переносит два иона кальция через мембрану из окружающей среды вовнутрь везикул саркоплазматического ретикулума. Процесс имеет циклический характер, в результате осуществления которого последовательно реализуются стадии с участием Са2+ и АТФ.
Деятельность Са2+-АТФазы регулируется специализированным белком фосфоламбаном, который способен связываться на поверхности белковой глобулы неподалеку от места фосфорилирования и таким способом понижает активность фермента. Это происходит за счет того, что связывание фосфоламбана сопровождается уменьшением сродства участков связывания ионов Са2+ к этому иону. Ингибирующий эффект снимается путем фосфорилирования фосфоламбана протеинкиназами, фосфорилированная форма которого не способна связываться с Са2+-АТФазой. Другим регуляторным белком Са2+-АТФазы является кальмодулин, действие которого основано на том, что он препятствует реализации механизма самоингибирования Са2+-АТФазы, которое осуществляется путем отклонения фрагмента полипептидной цепи С-конца Са2+-АТФазы, закрывающего центры связывания ионов кальция. Кальмодулин связывается в участке вблизи С-конца, препятствуя его ингибирующему действию.
Н+-АТФаза. Представляет собой мультиферментный комплекс, который осуществляет перенос ионов водорода через клеточную мембрану, используя для этого освободившуюся при гидролизе АТФ энергию. Транспорт протонов происходит из клетки наружу, создавая при этом постоянство рН. В результате работы ферментативного комплекса образуется на мембране разность потенциалов. Кроме того, при понижении концентрации АТФ в среде фермент может работать и как АТФсинтетаза. В составе Н+-АТФазы можно выделить два фрагмента, один из которых погружен в мембрану и представляет собой гидрофобный белковый комплекс (мембранный фрагмент, F0). Другой фрагмент располагается над мембраной и обращен в водную среду (наружный фрагмент, F1). В состав мембранного фрагмента входят несколько (12…15) субъединиц, которые подразделяются на три типа — a, b и c. Так, количество субъединиц с в мембранном фрагменте может составлять 9…12, а b — 2. Субъединицы a и b имеют молекулярную массу 20…30 кДа, а субъединицы с — 6…11 кДа. Комплекс из субъединиц (a, b2, cn) формирует на мембране протонпроводящий канал, по которому ионы водорода попадают в наружный фрагмент Н+-АТФазы. Этот фрагмент состоит из девяти субъединиц пяти типов (α, β, γ, δ и ε), среди которых γ, δ и ε имеют по одной субъединице, тогда как α и β состоят из трех субъединиц. Наружный фрагмент имеет форму шара. При этом α и β субъединицы располагаются попеременно
479

Глава 19. Биохимия мышц и мяса
вокруг γ субъединицы, которая занимает центральное положение в наружном фрагменте и имеет вид слегка изогнутого стержня длиной око-
° γ ° α β
ло 90А. Нижняя часть субъединицы на 30А длиннее и субъединиц
ипогружена в мембранный фрагмент. В центре наружного фрагмента располагаются субъединицы δ и ε. Последняя выполняет функцию регулятора активности фермента. Кроме того, субъединицы δ и ε обеспечивают связывание мембранного фрагмента с наружным фрагментом Н+-АТФазы.
Вкаталитическом действии Н+-АТФазы принимают участие субъединицы α и β, которые обеспечивают избирательное связывание по одной молекуле АТФ или АДФ. Субъединицы α и β похожи по строению, так как их аминокислотный состав различается всего на 20 %. Участок свя-
зывания нуклеозидфосфатов располагается на стыке между этими субъединицами. Причем α субъединицы способны прочно связывать АТФ
иАДФ, тогда как β субъединицы слабо удерживают нуклеозидфосфаты, что способствует их обмену с аналогичными нуклеотидфосфатами из ок-
ружающей среды. Синтез АТФ Н+-АТФазой осуществляется во время вращения комплекса субъединиц α3β3 вокруг γ субъединицы. При повороте субъединиц одновременно происходит и связывание одними субъединицами по одной молекуле АДФ и фосфата, и в то же время синтез АТФ на других субъединицах. В работе субъединиц отмечается положительная кооперация. Реакция синтеза АТФ, катализируемая Н+-АТФазой, является обратимой. При этом обратная реакция идет при участии молекулы воды и протекает при наличии в среде достаточного количества АТФ
иэлектрохимического потенциала ионов водорода по сторонам мембраны. Гидролиз АТФ сопряжен с активным переносом протонов. Процесс инициируется комплексом Mg2+-АТФ.
На 1 мкм2 поверхности мембраны могут находиться до 104 молекул фермента. При этом каждая молекула Н+-АТФазы переносит от 105 до 106 протонов в секунду. Работа фермента осуществляется таким образом, что при переносе одного протона через мембрану расходуется одна молекула АТФ.
Для нормального функционирования Н+-АТФазы в мембране необходимо присутствие некоторых фосфолипидов. Оптимум каталитической активности фермента приходится на рН 6,3…6,5. Осуществляя перенос протонов, Н+-АТФаза участвует в создании трансмембранного потенциала клетки. Кроме того, деятельность Н+-АТФазы обеспечивает функционирование вторичных систем активного транспорта.
Фермент играет ключевую роль в адаптации животных к низким температурам. При понижении температуры в клетках высвобождаются ионы K+, которые активируют работу Н+-АТФазы. В результате активации фермента показатели трансмембранного потенциала выходят на нормальный уровень, что сопровождается восстановлением работы мембранных систем.
480

19.6. Саркоплазматические белки
Кальмодулин. Белок был впервые обнаружен в тканях мозга американским исследователем В.Ченгом. Кальмодулин определяется практически во всех растительных и животных тканях. В молекуле кальмодулина имеются центры связывания четырех ионов Са2+, которые обладают высоким сродством к белкам (Кд = 10–9).
Кальмодулин — мономерный белок, в составе полипептидной цепочки которого около 150 аминокислотных остатков с молекулярной массой 17 кДа. В первичной структуре кальмодулина преобладают остатки аспарагиновой и глутаминовой кислот, составляющие до 30% от общего числа аминокислотных остатков белка. Аллостерическая активация кальмодулина аналогична активации киназ циклическим АМФ.
Взаимодействие Са2+ с кальмодулином изменяет активность около 100 ферментов. К их числу относятся Са2+-кальмодулинзависимые протеинкиназы. Связывание ионов Са2+ с кальмодулином инициирует конформационные изменения в глобулярной структуре белка, приводящие к экспонированию гидрофобных участков терминальных и центральных спиралей с разматыванием фрагментов α-спиралей, которые образуют петлю, позволяющую молекуле кальмодулина обернуться вокруг белкамишени. При этом N- и C-терминальные области полипептидной цепочки кальмодулина сближаются друг с другом и их гидрофобные участки связываются с белком-мишенью. Это способствует тому, что спиральная последовательность белка-мишени попадает в центр гидрофобного туннеля, проявляя сильные изменения в конформации белка-мишени. При снижении концентрации Са2+ комплекс кальмодулина с белком-мишенью диссоциирует.
Кальсеквестрин и Са2+-связывающий белок. Оба белка локализуются во внутреннем объеме саркоплазматического ретикулума. Кальсеквестрин имеет молекулярную массу в 45, а Са2+-связывающий белок — 55 кДа. Кальсеквестрин служит основным белком внутри терминальных цистерн саркоплазматического ретикулума и поэтому связывает большую часть ионов Са2+, поступающих в цистерны при работе Са2+-АТФазы. Кальсеквестрин является кислым гликопротеином, полипептидная цепочка которого на 40 % состоит из остатков аспарагиновой и глутаминовой кислот. Причем содержание кальсеквестрина в терминальных цистернах скелетных мышц может составлять до 20% от общего количества белков. Одна молекула кальсеквестрина способна связывать до 43 молей ионов Са2+ на моль белка, располагаясь непосредственно вблизи к рианодинчувствительному Са2+-каналу. Кальсеквестрин выполняет функцию по резервированию ионов Са2+ внутри терминальных цистерн и обеспечивает его концентрирование около Са2+-каналов, создавая условия для его направленного транспорта за счет пассивной диффузии в саркоплазму. Вторым белком является Са2+-связывающий белок, способный связывать
481

Глава 19. Биохимия мышц и мяса
25 молей ионов Са2+ на моль белка, выполняя аналогичную кальсеквестрину роль в саркоплазматическом ретикулуме.
Кроме того, в составе мембран саркоплазматического ретикулума содержатся аденилаткиназа, аденилатциклаза, цАМФ-зависимая киназа, дезаминазы и ферменты основных метаболических процессов гликогенеза, гликогенолиза, гликолиза, ПДК и окислительного фосфорилирования.
Аденилаткиназа. Аденилаткиназа катализирует реакцию образования АТФ. В реакции участвуют две молекулы АДФ. В ходе реакции осуществляется перенос остатка фосфорной кислоты с одной из молекул АДФ на другую.
2АДФ → АТФ + АМФ
Аденилатциклаза. Фермент катализирует реакции превращения АТФ в циклическое АМФ:
АТФ → цАМФ + ФФн
Впервые фермент и его механизм действия были изучены американским ученым Э.Сазерлендом. Аденилатциклаза относится к мембранным ферментам; активность его регулируется гормонами (адреналин, глюкагон, паратгормон, тиротропин, лютропин, фоллитропин, кальцитонин, кортикотропин, β-меланотропин, серотонин, вазопрессин и др.). В составе ферментативного комплекса три компонента: рецептор, каталитический и регуляторный белки. При взаимодействии гормона с рецептором запускаются механизмы, регулирующие активность аденилатциклазы. Циклический АМФ предназначен для выполнения роли универсального внутриклеточного мессенджера, индуцирующего в клетке цикл превращения, активируя работу цАМФ-зависимой протеинкиназы. Эти ферменты переносят терминальный остаток фосфорной кислоты с АТФ на остатки серина и треонина субстратных белков. Протеинкиназы осуществляют фосфорилирование гистонов, белков рибосом, ферментов гликогенолиза.
Оксидазы. Ферменты, катализирующие реакции окисления, одним из субстратов которых является кислород, восстанавливающийся в ходе протекания реакции до Н2О2 или Н2О, называются оксидазами.
Кислород используется многочисленными ферментами, катализирующими реакции его двухэлектронного восстановления до перекиси водорода с различными органическими субстратами
АН2 + О2 → А + Н2О2
или в реакциях четырехэлектронного восстановления до молекулы воды:
О2 + 4Н |
+ |
– |
→ Н2О |
|
+ 4e |
Общая схема реакций кислорода и его активных форм в биогенных системах может быть представлена в следующем виде:
482
