
Пищевая Биохимия / Рогожин В.В., Рогожина Т.В. Биохимия сельскохозяйственной продукции
.pdf
10.3. Процесс окисления глюкозы
тозу-1,6-дифосфат. Реакция практически необратима, протекает в присутствии ионов магния и является лимитирующей реакцией анаэробного процесса. Кроме АТФ, донорами остатков фосфорной кислоты могут быть УТФ и ЦТФ. Ингибиторами фосфофруктокиназы могут быть АТФ и цитрат, а АДФ, АМФ и фруктозо-2,6-дифосфат — активаторы фермента. Действие эффекторов позволяет регулировать скорость протекания анаэробного процесса, активируя его при недостатке АТФ в клетке, с накоплением АДФ и АМФ. Последние активируют анаэробный процесс, ускоряя его протекание и обеспечивая накопление АТФ.
Четвертая реакция анаэробного процесса катализируется ферментом альдолазой (4), которая расщепляет фруктозу-1,6-дифосфат на две фосфотриозы — фосфодиоксиацетон и 3-фосфоглицериновый альдегид. Реакция легко обратима при изменении температуры, повышение которой сдвигает равновесие в сторону образования триозофосфатов. Молекула фермента состоит из четырех субъединиц (150 кДа). В активном центре фермента имеются SH-группы. Пятую реакцию анаэробного процесса катализирует триозофосфатизомераза (5), осуществляющая превращение фосфодиоксиацетона в 3-фосфоглицериновый альдегид. На этом заканчивается этап расщепления глюкозы до двух фосфотриоз, которые в дальнейшем превращаются с участием окислительно-восстановитель- ных ферментов, обеспечивающих протекание реакций фосфорилирования АДФ, образование и накопление АТФ.
Вшестой реакции анаэробного процесса 3-фосфоглицериновый альдегид подвергается фосфорилированию и дегидрированию с участием 3-фосфоглицеральдегиддегидрогеназы (6). В реакции принимает участие НАД и неорганический фосфат. Уникальность реакции состоит в том, что в данной реакции происходит субстратное фосфорилирование, инициирующее образование макроэргической связи и включение в состав органических веществ неорганического фосфата. В ходе каталитического процесса на НАД переносятся атомы водорода, отщепляемые от 3-фос- фоглицеринового альдегида, при этом образуется тиоэфир, в образовании которого принимает участие сульфгидрильная группа фермента и карбоксильная группа субстрата, с образованием производного, которое называется ацилферментом. Затем ацильная группа переносится на неорганический фосфат с образованием 1,3-дифосфоглицерата.
Вседьмой реакции, катализируемой фосфоглицераткиназой (7), остаток фосфорной кислоты в положении 1 от 1,3-дифосфоглицерата переносится на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты. Таким образом, последовательное действие двух ферментов (3-фосфо- глицеральдегиддегидрогеназы и фосфоглицераткиназы) позволяет высвободившуюся энергию при окислении 3-фосфоглицеринового альдегида трансформировать в АТФ.
153

Глава 10. Метаболизм углеводов
В восьмой реакции, катализируемой фосфоглицератмутазой (8), осуществляется перенос остатка фосфорной кислоты из положения 3 в положение 2. При этом 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Реакция протекает в присутствии Мg2+
и2,3-дифосфоглицериновой кислоты. Девятая реакция катализируется енолазой (9). При этом от 2-фосфоглицериновой кислоты отщепляется молекула воды и образуется 2-фосфоенолпировиноградная кислота. Активаторами фермента могут быть ионы Мg2+ и Мn2+, а ингибитором — фторид.
Десятая реакция катализируется ферментом пируваткиназой (10)
исопровождается разрывом высокоэнергетической связи в 2-фосфо- енолпировиноградной кислоте и переносом остатка фосфорной кислоты на АДФ с образованием АТФ и пировиноградной кислоты. Реакция является практически необратимой. Для ее протекания требуются ионы Мg2+
иMn2+, а ион K+ активирует фермент. Суммарная реакция превращения глюкозы до пировиноградной кислоты имеет следующий вид:
ГЛЮКОЗА (С6Н12О6) + 2Фн + 2АДФ + 2НАД+ →
→ 2СН3—С(О)–СООН + 2АТФ + 2НАДН + 2Н+ + 2Н2О
Таким образом, анаэробный процесс является направленным процессом, в котором происходит расщепление молекулы глюкозы до двух молекул пировиноградной кислоты. Реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой, являются практически необратимыми. Лимитирующей реакцией анаэробного процесса является реакция, катализируемая фосфофруктокиназой. Для инициирования начальных стадий гликолиза расходуется две молекулы АТФ, обеспечивающие фосфорилирование глюкозы и фруктозо-6-фосфата. Положительным балансом анаэробного процесса расщепления глюкозы является синтез четырех молекул АТФ в реакциях, катализируемых фосфоглицераткиназой и пируваткиназой. Энергетическая эффективность процесса составляет 2 молекулы АТФ при расщеплении одной молекулы глюкозы.
10.4.МЕХАНИЗМЫ ПРЕВРАЩЕНИЯ ПИРОВИНОГРАДНОЙ КИСЛОТЫ
В аэробных условиях пировиноградная кислота может окисляться при участии пируватоксидазы (КФ 1.2.3.3) с образованием ацетилфосфата, СО2 и перекиси водорода:
СН3—СО—СООН + Н3РО4 + О2 + Н2О → СН3—СО—Р(О)–(ОН)2 + СО2 + Н2О2
Пировиноградная кислота |
Ацетилфосфат |
154

10.4. Механизмы превращения пировиноградной кислоты
Кроме того, пировиноградная кислота может окисляться до уксусной кислоты, в реакции, катализируемой пируватдегидрогеназой (КФ 1.2.2.2), протекающей в присутствии феррицитохрома b1. В реакции феррицитохром b1 восстанавливается до ферроцитохрома b1:
СН3—СО—СООН + феррицитохром b1 + Н2О →
→ СН3—СООН + СО2 + ферроцитохром b1
При участии пируватдекарбоксилазы (КФ 6.4.1.1) пировиноградная кислота расщепляется на СО2 и уксусный альдегид. Последний при участии алкогольдегидрогеназы (АДГ) восстанавливается до этилового спирта или в реакции, катализируемой альдегиддегидрогеназой (АльДГ), альдегид окисляется до уксусной кислоты. В реакции восстановления участвует НАДН, а в реакции окисления — НАД+.
СН3—СО—СООН → СН3—СНО + СО2 Уксусный альдегид
АДГ СН3СНО + НАДН + Н+ → СН3СН2ОН + НАД+
Этиловый спирт
АльДГ СН3СНО + НАД+ + Н2О → СН3СООН + НАДН + Н+
Уксусная кислота
В анаэробных условиях в некоторых частях растений (плоды, луковицы), покрытых плотной оболочкой, куда доступ кислорода затруднен, может происходить накопление этилового спирта.
Пировиноградная кислота восстанавливается до молочной кислоты в реакции, катализируемой лактатдегидрогеназой (КФ 1.1.1.27):
СН3—СО—СООН + НАДН + Н+ → СН3—СН(ОН)–СООН + НАД+
Пировиноградная кислота |
Молочная кислота |
Из пировиноградной кислоты могут образовываться углеводы — глюкоза и крахмал. В этом принимают участие ферменты анаэробного процесса распада углеводов.
При участии пируваткарбоксилазы (КФ 6.4.1.1) к пировиноградной кислоте присоединяется СО2. Реакция протекает в присутствии АТФ:
СН3—СО—СООН + СО2 + АТФ + Н2О → НООС—СН2—С(О)–СООН + АДФ + Н3РО4 Оксалоацетат
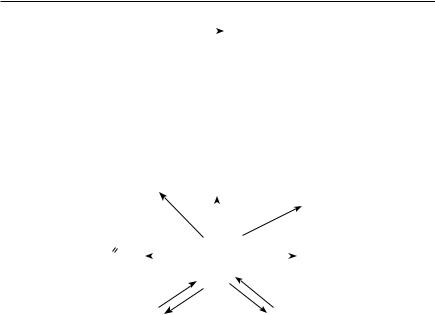
В реакциях трансаминирования из пировиноградной кислоты образуется аланин, который в дальнейшем используется в реакциях синтеза различных аминокислот и в биосинтезе белков.
155
Глава 10. Метаболизм углеводов
COOH |
|
|
|
|
|
|
|
|
|
|
C=O + HOOC–CH2–CH2 |
–CH–COOH |
|
CH3 |
–CH–COOH + HOOC–CH2–CH2 |
|
–C–COOH |
||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
CH3 |
NH2 |
|
NH2 |
O |
|||||
Пировиноградная |
Глутаминовая |
|
Аланин |
Кетоглутаровая |
|||||
|
кислота |
кислота |
|
|
|
кислота |
|||
Таким образом, пировиноградная кислота играет важную роль в метаболических процессах, протекающих в тканях растений. Основные метаболиты пировиноградной кислоты показаны на рис. 10.5.
|
|
OH |
|
|
|
|
|
|
|
||
CH3 |
|
|
|
|
|
|
|
|
|
||
|
–С–O–P–OH |
CH3–С–H |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3СH2OH |
O O |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
O |
COOH |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3СOOH |
CH3–C~SKoA |
|
C |
|
O |
|
||||||
|
|
|
|||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||||
CH3 |
CH3 |
–СH–COOH |
|
|
|
|
|
H–С–OH |
NH2 |
||
|
|
|
|
COOH |
|
|
|
Рис. 10.5. Пировиноградная кислота и ее метаболиты
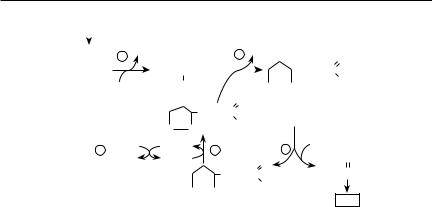
Пируватдегидрогеназный комплекс (ПДК). Пировиноградная кислота может также превращаться в реакциях окислительного декарбоксилирования под действием пируватдегидрогеназного комплекса, в состав которого входят три фермента и пять коферментов. Ферменты ПДК катализируют реакции окисления пировиноградной кислоты до ацетил-КоА (рис. 10.6). В составе мультиферментного комплекса пируватдегидрогеназа (1) катализирует реакцию декарбоксилирования пирувата. В этой реакции из пирувата образуется оксиэтильное (СН3–СНОН–) производное, связанное
стиаминпирофосфатом (ТПФ), который в виде оксиэтил-ТПФ связывается в активном центре фермента. На втором этапе оксиэтильная группа переносится на один из атомов серы циклической дисульфидной группы липоевой кислоты, которая ковалентно связана в активном центре дигидролипоилтрансацетилазы (2). Перенос оксиэтильной группы от ТПФ на липоевую кислоту сопровождается восстановлением липоевой кислоты. При этом оксиэтильная группа превращается в ацетильную (СН3СО–)
свосстановлением одного из атомов серы липоевой кислоты в дитиоловую форму. На третьем этапе ацетильная группа переносится с липоиловой группы дигидролипоилтрансацетилазы (3) к тиоловой группе SНКоА. При
156
10.4. Механизмы превращения пировиноградной кислоты
Гликолиз |
|
|
|
|
|
|
|
|
||
|
|
|
CO2 |
2 ТПФ |
|
|
|
|||
COOH |
1 |
|
|
O |
||||||
|
|
|
H3C–CH–ТПФ |
|
|
|
|
|
||
|
C=O |
|
|
|
|
|
|
(CH2)4–C |
||
|
|
|
|
|
|
|
||||
|
|
|
|
OH |
|
|
|
|
O–E |
|
CH3 ТПФ |
|
|
||||||||
|
SH |
S |
||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
(CH2)4–C |
C=O |
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O–E |
CH3 |
|||||
|
|
|
|
|
|
|||||
SS
3 НАД+ |
ФАДН2 |
3 |
3 |
HSKoA |
НАДН2 |
ФАД |
O |
|
O |
|
|
(CH2)4–C |
|
H3C–C–SKoA |
|
SH |
O–E |
|
|
|
SH |
|
ЦТК |
|
|
|
|
|
Рис. 10.6. Механизм действия ферментов пируватдегидрогеназного комплекса (1 — пируватдегидрогеназа, 2 — дигидролипоилацетилтрансфераза,
3 — дигидролипоилдегидрогеназа)
этом, образовавшийся ацетил-КоА (СН3–СО–SКоА) отделяется от ферментативного комплекса. На четвертом этапе происходит регенерация окисленной формы липоамина, катализируемая дигидролипоилдегидрогеназой, содержащей в активном центре ковалентно связанный ФАД, выполняющий роль акцептора атомов водорода (с переходом в восстановленную форму ФАДН2). Процесс завершается окислением ФАДН2 за счет НАД+, который восстанавливается в НАДН, регенерируя ФАД. Суммарное уравнение реакций ПДК следующее:
СН3—СО—СООН + НАД+ + НSКоА →
→ СН3—СО—SКоА + НАДН + Н+ + СО2
Таким образом, в действии ПДК принимают участие три фермента (пируватдегидрогеназа, дигидролипоилтрансацетилаза и дигидролипоилдегидрогеназа). Ферменты ПДК собраны в единый мультиферментный комплекс; в механизме их действия принимают участие пять коферментов (ТПФ, липоевая кислота, HSКоА, ФАД, НАД), в составе которых определяются остатки шести витаминов (В1, В2, В3, РР, В5, N). Три кофермента (ТПФ, липоевая кислота, ФАД) ковалентно связаны в активных центрах ферментов, выполняя роль простетических групп в каталитических процессах. Дигидролипоилтрансацетилаза состоит из 24 субъединиц, каждая субъединица по 36 кДа; в активном центре фермента имеется ковалентно-связанный остаток липоевой кислоты. Дигидролипоилдегидрогеназа состоит из 12 субъединиц, каждая субъединица по 55 кДа. В активный центр входит ФАД. Ингибиторами ферментов ПДК являются молекулы АТФ. Превращение пирувата до ацетил-КоА позволяет
157
Глава 10. Метаболизм углеводов
обеспечить синтез трех молекул АТФ (при окислении одной молекулы НАДН2 в процессе окислительного фосфорилирования образуется три молекулы АТФ).
10.5. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
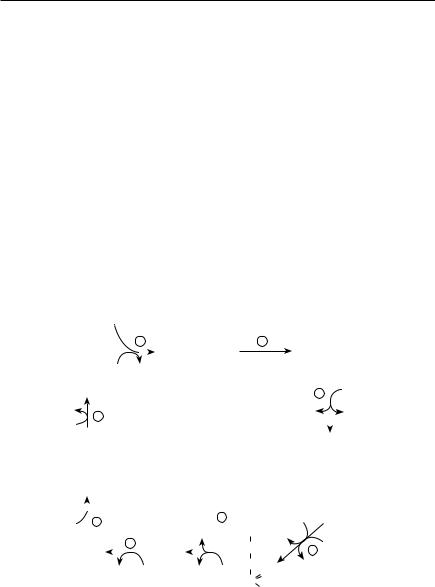
Ферменты ЦТК локализуются в матриксе митохондрий (рис. 10.7). Инициирование процесса начинается с реакции, катализируемой цитратсинтазой (1), которая осуществляет перенос ацильного радикала с ацетила КоА на оксалоацетат; в результате образуется лимонная кислота (цитрат).
При участии аконитазы (2) осуществляется последовательное превращение цитрата вначале в цис-аконитовую кислоту, а затем — в изолимонную (изоцитрат). В третьей реакции изоцитрат превращается в α-кето- глутаровую кислоту. Реакция катализируется изоцитратдегидрогеназой (3), коферментом которой служит НАД+. Для каталитического процесса необходимы ионы Mg2+ или Mn2+. Активность фермента возрастает в при-
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
H3C–C–SKoA |
|
|
|
|
|
|
|
|
|
|
H2 |
C–COOH |
|
||||||||||
|
COOH |
|
|
|
|
|
1 |
|
|
|
|
|
H2C–COOH |
|
|
|
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
C=O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC–COOH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
HO–C–COOH |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO–CH–COOH |
|
|||
|
CH2 |
|
|
|
H |
O |
HSKoA |
|
H2C–COOH |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
Изоцитрат |
|
||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
COOH |
|
|
|
|
|
|
|
|
Цитрат |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НАД+ |
|
||||||
Оксалоацетат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
||||||||
НАДН2 |
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2 |
|
|
НАДН |
2 |
||
НАД+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HO–CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C=O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|||||
|
Малат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H2O |
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
HSKoA |
α-Кетоглутарат |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
COOH |
|
|
|
|
6 |
|
|
COOH HS–KoA |
|
|
|
COOH CO2 |
|
НАД |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
4 |
+ |
|
||||
|
CH |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
НАДН2 |
|
|
||
|
CH |
ФАДН2 |
ФАД |
CH |
|
ГТФ ГДФ+Ф |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
2 |
н |
O |
|
|
|
|
|
|||||||||||||
|
COOH |
|
|
|
|
|
|
|
|
COOH |
|
|
C |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
SKoA |
|
|
|
|
|
|||||||||
Фумарат |
|
|
|
|
|
|
|
Сукцинат |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
Сукцинил-S-КоА |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рис. 10.7. Превращение ацетил-КоА в матриксе митохондрий (цикл трикарбоновых кислот)
(1 — цитратсинтаза, 2 — аконитаза, 3 — изоцитратдегидрогеназа, 4 — α-кето- глутаратдегидрогеназный комплекс, 5 — сукцинил-КоА-синтетаза, 6 — сукцинатдегидрогеназа, 7 — фумаратгидратаза, 8 — малатдегидрогеназа)
158

10.5. Цикл трикарбоновых кислот
сутствии АДФ и понижается при накоплении АТФ и НАДН. Четвертую реакцию катализируют ферменты α-кетоглутаратдегидрогеназного комплекса (4), осуществляющие окислительное декарбоксилирование α-ке- тоглутаровой кислоты до янтарной кислоты (сукцинат). α-Кетоглутаратде- гидрогеназный комплекс имеет структуру, аналогичную ПДК. Конечным продуктом реакции является сукцинил-КоА, представляющий высокоэнергетический тиоэфир, у которого в образовании сложноэфирной связи принимает участие одна из СООН-групп янтарной кислоты. В действии комплекса принимают участие 5 коферментов (тиаминпирофосфат, липоевая кислота, НSКоА, НАД+ и ФАД). В пятой реакции сукцинил-КоА утрачивает свою КоА-группу, при этом освобождающаяся энергия запасается в фосфатной связи нуклеозидтрифосфата. Реакция катализируется ферментом сукцинил-КоА-синтетазой (5).
Энергия, запасенная в сукцинил-КоА, переносится на ГТФ, который отдает фосфорильную группу АДФ; в результате синтезируется АТФ. Реакцию катализирует нуклеозиддифосфаткиназа.
ГТФ + АДФ ←→ ГДФ + АТФ
Сукцинатдегидрогеназа (6) катализирует шестую реакцию, в которой осуществляется окисление янтарной кислоты до фумаровой (фумарат). Фермент активен в присутствии ФАД, который выступает в качестве акцептора атомов водорода. Сукцинатдегидрогеназа располагается в структуре внутренней мембраны митохондрий, участвуя в работе дыхательной цепи, в переносе протонов и электронов от ФАДН2 к кислороду. В седьмой реакции фумаровая кислота подвергается обратимой гидратации, превращаясь в яблочную (малат). Реакция катализируется фумаратгидратазой (7); в составе молекулы фермента четыре субъединицы с молекулярной массой по 50 кДа, каждая из которых в отдельности каталитической активностью не обладает. В восьмой реакции при участии НАД-зависимой малатдегидрогеназы (8) яблочная кислота подвергается дегидрированию, превращаясь в щавелевоуксусную кислоту (оксалоацетат), которая может вступать в новый цикл реакций. Суммарная реакция цикла трикарбоновых кислот имеет следующий вид:
СН3СО-КоА + 3НАД+ + ФАД + ГДФ + Фн + Н2О →
→ 2СО2 + 3НАДН + ФАДН2 + ГТФ + 2Н+ + КоА
Таким образом, превращение ацетил-КоА в ЦТК начинается с переноса остатка ацетила с ацетил-КоА на оксалоацетат с образованием лимонной кислоты, последовательное превращение которой сопровождается дегидрированием и декарбоксилированием. В результате двухуглеродное производное (ацетил) расщепляется до СО2 и Н2О. Цикл завершается образованием четырехуглеродного соединения (оксалоацетата), которое
159

Глава 10. Метаболизм углеводов
способно участвовать в новом циклическом процессе. ЦТК выполняет роль основного процесса, в котором происходит окисление производных ацетил-КоА, конечного продукта окисления углеводов, жирных кислот
иаминокислот. Ферменты ЦТК располагаются в матриксе митохондрий
икатализируют протекание восьми последовательных энзиматических
реакций. Реакции дегидрирования катализируются четырьмя ферментами ЦТК (ИЦДГ, α-КГДГ, СДГ, МДГ); в результате протекания этих реакций образуются три молекулы НАДН и одна молекула ФАДН2. Цитрат-синтаза
иизоцитратдегидрогеназа катализируют лимитирующие реакции ЦТК. За один цикл Кребса возможен синтез 12 молекул АТФ. Одна молекула АТФ синтезируется непосредственно в цикле Кребса (субстратное фосфо-
рилирование), а окисление трех молекул НАДН и одной молекулы ФАДН2 в дыхательной цепи обеспечивает синтез дополнительно 11 молекул АТФ. Аллостерическим ингибитором цитрат-синтазы служит АТФ, тогда как АДФ может являться активатором НАД-зависимой изоцитратдегидрогеназы. Через действие нуклеозидфосфатов на ферменты лимитирующих реакций осуществляется регуляция в целом активности ферментов ЦТК. При этом накопление АТФ понижает, а увеличение содержания АДФ активирует ферменты ЦТК.
10.6. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Все живые организмы для активного функционирования нуждаются в энергии, которая накапливается в клетках в виде макроэргических (богатых энергией) соединений. К числу таких соединений относится молекула аденозинтрифосфорной кислоты. Молекулы АТФ необходимы для протекания в клетках анаболических и катаболических процессов. Основным местом синтеза АТФ являются митохондрии. Процессу синтеза АТФ предшествуют процессы окисления органических соединений. Энергия, высвобождающаяся в результате химических реакций окисления, преобразуется в электрохимическую и в дальнейшем используется для синтеза АТФ.
Процесс образования АТФ сопряжен с транспортом электронов по цепи переносчиков от НАДН или ФАДН к О2. При этом вначале происходит окисление восстановленных коферментов и создание трансмембранного потенциала, обусловленного зарядом биомембраны протонами (Н+), перенесенными из матрикса в межмембранное пространство митохондрий. Затем электроны и протоны переносятся на молекулу кислорода, восстанавливая ее до молекулы воды. Эти окислительно-восстановительные процессы обуславливают протекание процесса фосфорилирования АДФ с образованием АТФ.
160
10.6.Окислительное фосфорилирование
Вреакциях окисления участвуют ферменты, располагающиеся во внутренней мембране митохондрий, использующие в качестве носителя заряда ион водорода. В результате окислительной реакции происходит перенос электронов от молекулы-донора к молекуле-акцептору. При этом совокупность оксидоредуктаз, катализирующих процесс внутриклеточного дыхания, называют дыхательной цепью.
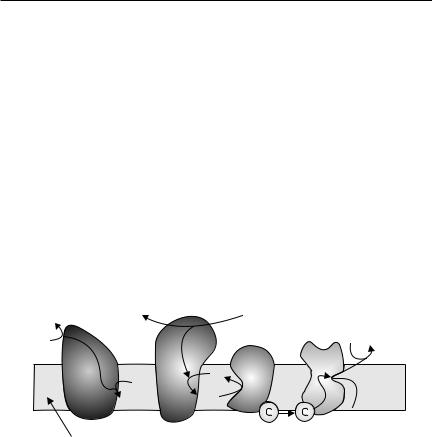
Окислительное фосфорилирование катализируется четырьмя ферментативными комплексами, расположенными на внутренней мембране митохондрий (рис 10.8), структура и механизм действия которых еще недостаточно изучены. Комплекс I — НАДН: убихинон-оксидоредуктаза (ФМН, FeS), комплекс II — сукцинат: убихинон-оксидоредуктаза (ФАД, FeS), комплекс III — убихинон: феррицитохром с-оксидоредуктаза (цит b и c, FeS), комп-
лекс IV — ферроцитохром с-кислород-оксидоредуктаза (цит а и а3, Cu2+). Цитохромы располагаются в порядке возрастания окислительно-восстано-
вительного потенциала. Терминальный цитохром аа3 (цитохромоксидаза) осуществляет конечную стадию процесса — перенос восстановительных эквивалентов на молекулярный кислород.
Фумарат |
Сукцинат |
Матрикс |
NAD++H+ |
|
|
NADH |
2e– |
4H+ 2H2O |
|
2e– |
Q |
|
Q |
III |
IV |
|
|
|
|
||
I |
|
|
|
|
|
QH2 |
II |
QH2 |
e– |
|
|
|
|
O2
Межмембранное пространство
Внутренняя мембрана
Рис. 10.8. Компоненты дыхательной цепи
В состав комплекса I могут входить от 13 до 46 субъединиц с общей молекулярной массой 700…980 кДа. Располагается комплекс I в окружении фосфолипидов мембраны. Содержит в своем составе флавин (ФМН)
иболее 20 атомов железа, связанных с атомами серы в виде железосерных кластеров.
Комплекс II содержит убихинон, гидрофобный хвост которого погружен в липидный слой мембраны, полярная головка располагается на поверхности мембраны. Убихинон осуществляет ступенчатое присоединение электронов и протонов, его полувосстановленная форма называется убисемихинон. Комплекс III содержит железо, связанное с атомами серы
ипротопорфирина. В составе комплекса IV два различных гема и несколько атомов меди, прочно связанных с белком.
161
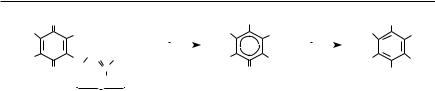
Глава 10. Метаболизм углеводов
O |
|
|
|
|
|
·OH |
|
|
OH |
|
H3C–O |
CH3 |
|
|
|
H3C–O |
CH3 |
|
H3C–O |
|
CH3 |
|
CH |
CH2 |
+ H+ + e |
|
|
+ H+ + e |
|
|
|
|
|
|
|
|
|
|
|
||||
H3C–O |
–Н |
|
H3C–O |
R |
|
H3C–O |
R |
|||
O |
(CH2 |
C |
)n |
|
|
O |
|
|
OH |
|
Убихинон (Q) |
|
CH3 |
|
|
Убисемихинон (·QH) |
|
Убихинол (QH |
) |
||
|
|
|
|
|
||||||
(окисленная форма) |
R |
|
(«полувосстановленная» форма) |
|
|
2 |
|
|||
|
|
(восстановленная форма) |
||||||||
Процесс окислительного фосфорилирования начинается с присоединения НАДН к комплексу I. Два электрона отщепляются от кофермента и переносятся на убихинон, который связывается с другим активным центром, расположенным внутри мембраны. При этом протоны остаются
вводной среде межмембранного пространства митохондрий, а электроны возвращаются на другую молекулу окислителя. В результате на мембране возникает трансмембранный потенциал. При этом комплекс I осуществляет постоянную регенерацию окисленной формы НАД+, которая необходима для протекания катаболических процессов углеводов, липидов, аминокислот и других соединений.
Восстановленный убихинон отдает электроны на атом железа гема цитохрома с. Процесс катализируется комплексом III. В свою очередь восстановленный цитохром с связывается с комплексом IV. В завершающей стадии процесса участвует кислород, который акцептирует электроны и протоны, восстанавливаясь до молекулы воды. При окислении ФАДН кофермент связывается с комплексом II, компоненты которого передают далее электроны по электронтранспортному пути на кислород.
Некоторые белки комплексов могут выполнять роль протонных насосов, приводимых в действие потоком электронов дыхательной цепи. Энергия, выделяющаяся при переносе электронов, расходуется на функционирование протонных насосов, обеспечивающих транспорт протонов из матрикса в межмембранное пространство. В результате наблюдается избыток протонов на наружной стороне мембраны, которая приобретает положительный заряд. При этом в матриксе образуется избыток ОН–;
врезультате этого внутренняя сторона мембраны заряжается отрицательно. Такое распределение зарядов обусловливает возникновение градиента электрического потенциала. При этом обратный поток протонов по градиенту их концентрации в сторону матрикса осуществляется АТФ-син- тетазным комплексом, инициируя процесс синтеза АТФ.
По цепи переноса электронов располагаются три протонных насоса, инициирующих три реакции фосфорилирования, в результате которых синтезируются три молекулы АТФ. Поэтому в результате окисления одной молекулы НАДН синтезируется 3 молекулы АТФ, а одной молекулы ФАДН — 2 молекулы АТФ. Уравнения реакций окислительного фосфорилирования имеют следующий вид:
162
