
Пищевая Биохимия / Рогожин В.В., Рогожина Т.В. Биохимия сельскохозяйственной продукции
.pdf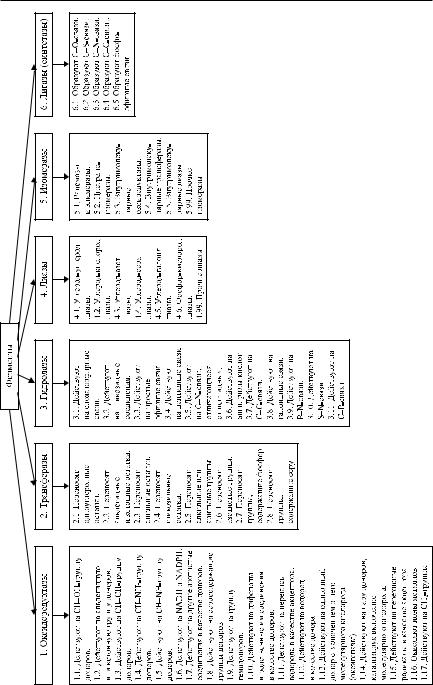
8.3. Классификация и номенклатура ферментов
Рис. 8.3. Основные классы и подклассы ферментов
123

Глава 8. Ферменты
роксипируватредуктаза и др.). Коферментами оксидоредуктаз могут быть НАД+, НАДФ+, ФАД, ФМН. К классу оксидоредуктаз принадлежат и оксидазы, в реакциях которых участвует кислород (альдегидоксидаза, ксантиноксидаза, пируватоксидаза, оксалатоксидаза, оксидаза L-аминокислот, аминооксидаза и др.).
2 класс. Трансферазы — это ферменты, катализирующие реакции переноса различных групп (метильных, гидроксиметильных, формильных, карбоксильных, карбамоильных, альдегидных, ацильных, алкильных, аминных и др.) от одного субстрата (донор) к другому (акцептор). В реакциях, катализируемых трансферазами, принимают участие S-аденозил-L-метио- нин, S-метилметионин, пиридоксальфосфат, биотин, тиаминпирофосфат, 2-аминоаденозин, SH-КoA. Название фермента формируется по принципу: акцептор-группа-трансфераза или донор-группа-трансфераза (метио- нин-метил-трансфераза, тиол-метил-трансфераза, серин-гидроксиметил- трансфераза, глутамат-формил-трансфераза, холин-ацил-трансфераза, транскетолаза, трансальдолаза и др.). К этому классу принадлежат ферменты, переносящие гликозильные группы (фосфорилаза, амилосахараза, декстрансахараза и др.). Трансферазы представлены 8 подклассами.
3 класс. Гидролазы — это ферменты, катализирующие разрыв связи в молекуле субстрата, осуществляемый с участием молекулы воды. В название фермента включается слово «гидролаза» (S-аденозилметионин-гидролаза, формил-КоА-гидролаза, ацилфосфоаденозин-гидролаза, ацетил-КоА-гид- ролаза и др.) или название фермента формируется из названия субстрата присоединением суффикса «-аза» (целлюлаза, фосфолипаза, ацетилэстераза, тиаминаза, глутатионтиолэстераза и др.), или ферменты имеют тривиальное название (химотрипсин, пепсин, химозин, трипсин, субтилизин, тромбин, плазмин и др). Гидролазы подразделяются на 11 подклассов.
4 класс. Лиазы — это ферменты, катализирующие реакции разрыва С–С, С–О, С–N и других связей в субстрате без присоединения молекулы воды или окисления. Лиазы отличаются от других ферментов тем, что в катализируемых реакциях в одном направлении участвуют два субстрата, а в обратной реакции — только один. В названии фермента присутствуют слова «декарбоксилаза», или «альдолаза», или «лиаза» (пируват-декарбоксилаза, оксалат-декарбоксилаза, оксалоацетат-декарбоксилаза, треонин-альдолаза, фенилсерин-альдолаза, изоцитрат-лиаза, аланин-лиаза, АТФ-цитрат-ли- аза и др.), а для ферментов, катализирующих реакции отщепления воды от субстрата, — «дегидратаза» (карбонат-дегидратаза, цитрат-дегидратаза, серин-дегидратаза и др.). В тех случаях, когда обнаружена только обратная реакция или это направление в реакции более существенно, в названии ферментов присутствует слово «синтаза» (малат-синтаза, 2-изопропилма- лат-синтаза, цитрат-синтаза, гидроксиметилглутарил-КоА-синтаза и др.). Лиазы подразделяются на 6 подклассов.
124

8.4. Кинетика ферментативных реакций
5 класс. Изомеразы — это ферменты, катализирующие внутримолекулярные превращения (рацемизация или эпимеризация). В названии фермента присутствуют слова «рацемаза» (аланин-рацемаза, метионин-рацемаза, гидроксипролин-рацемаза, лактат-рацемаза и др.), или «эпимераза» (альдо- за-1-эпимераза, рибулозофосфат-4-эпимераза, УДФ-глюкуронат-4-эпиме- раза и др.), или «изомераза» (рибозофосфат-изомераза, ксилозоизомераза, глюкозаминфосфат-изомераза и др.), «таутомераза» (фенилпируват-тау- томераза, оксалоацетат-таутомераза), «мутаза» (фосфоглицерат-мутаза, метиласпартат-мутаза и др.). Подразделяются на 5 подклассов.
6 класс. Лигазы, или синтетазы, — это ферменты, катализирующие реакции соединения двух и более молекул, используя АТФ. В названии фермента присутствуют слова «синтетаза» (тирозил-тРНК-синтетаза, треонин-тРНК- синтетаза, ацетил-КоА-синтетаза, аспарагинсинтетаза, карбамоилфосфатсинтетаза, аргениносукцинат-синтетаза и др.) или «карбоксилаза» (пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза и др.). Подразделяются на 5 подклассов.
Ферменты, входящие в один класс, в соответствии с особенностями катализируемых реакций группируются в подкласс и подподкласс. При этом приобретают систематическое название и кодовую нумерацию (шифр). Первое число шифра означает класс, второе и третье — подкласс и подподкласс соответственно, а четвертое число — порядковый номер фермента в подподклассе. Например, алкогольдегидрогеназа имеет шифр (КФ 1.1.1.1), значит она относится к классу оксидоредуктаз (КФ 1.), подклассу ферментов, действующих на СН–ОН группу доноров (КФ 1.1.), к подподклассу ферментов, акцепторами которых служат НАД и НАДФ (КФ 1.1.1.), с порядковым номером в подподклассе — 1; глюкозо-6-фос- фатаза (КФ 3.1.3.9) относится к классу гидролаз (КФ 3.), подклассу ферментов, действующих на сложноэфирные связи (КФ 3.1.), к подподклассу ферментов, гидролизующих моноэфиры фосфорной кислоты (КФ 3.1.3.), с порядковым номером фермента в подподклассе — 9; пируваткарбоксилаза (КФ 6.4.1.1) относится к классу лигаз (синтетаз) (КФ 6.), подклассу ферментов, образующих С–С-связи (КФ 6.4.), к подподклассу ферментов, присоединяющих СО2 к различным соединениям (КФ 6.4.1.), с порядковым номером фермента в подподклассе — 1 и т. д.
8.4. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
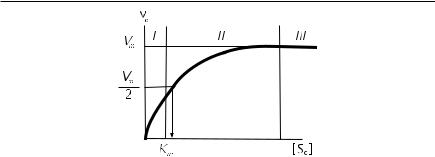
Химические реакции, катализируемые ферментами, протекают через образование фермент-субстратного комплекса. При этом график изменения начальной скорости (v0) от концентрации субстрата принимает вид гиперболической зависимости (рис. 8.4).
125
Глава 8. Ферменты
Рис. 8.4. График зависимости начальной скорости ферментативной реакции от концентрации субстрата в координатах Михаэлиса — Ментен
На кинетической кривой можно выделить три участка. На начальном этапе (участок I), который проявляется при инициировании каталитического процесса, скорость реакции возрастает пропорционально концентрации субстрата (So). При этом должны соблюдаться условия стационарности, т. е. концентрация фермент-субстратного комплекса остается постоянной (стационарной) в ходе ферментативной реакции. По мере возрастания концентрации субстрата отмечаются отклонения от линейности (участок II). Дальнейшее увеличение концентрации субстрата приводит к тому, что скорость реакции становится не зависящей от концентрации субстрата (участок III), т. е. достигается состояние насыщения фермента субстратом. Однако в этих условиях начальная скорость зависит от концентрации фермента. Наблюдаемые изменения можно описать следующей простейшей схемой:
k1 |
k2 |
→ |
[ES] → E + P |
Е + S ← |
|
k–1 |
|
Здесь E — фермент, S — субстрат, P — продукт, ES — фермент-субстратный комплекс, k1, k2, k–1 — константы скоростей.
При этом Eo = E + [ES] — общая концентрация фермента, а So = S + + [ES] — общая концентрация субстрата. Реакция протекает в условиях, когда концентрация субстрата во много раз превышает концентрацию фермента (So >> Eo). То есть число молекул субстрата, связанных с ферментом, пренебрежительно мало по сравнению с общим числом молекул субстрата. Таким образом, S ≈ So.
Протекание ферментативного процесса определяется соотношением показателей скоростей образования и распада фермент-субстратного комплекса. При этом скорость образования [ES] выражается уравнением второго порядка
v1 = k1[E][S].
126

8.4.Кинетика ферментативных реакций
Аскорость распада [ES] можно записать в виде уравнений первого порядка
v2 = k–1[ES]; v0 = k2[ES].
Лимитирующей стадией ферментативного процесса, является стадия продуктивного распада фермент-субстратного комплекса
–d [ES]/dt = k2[ES].
В условиях стационарности скорость образования фермент-субстрат- ного комплекса равна скорости его распада
k1[E][S] = k–1[ES] + k2[ES].
Решая это уравнение, можно найти выражение для концентрации фер- мент-субстратного комплекса в стационарном состоянии
[ES] = EоSо/[(k–1 + k2)/k1 + Sо],
где комбинация констант (k–1 + k2)/k1 есть константа Михаэлиса (Km).
Таким образом, начальная скорость (v0) ферментативной реакции при k2 = kкат определяется следующим уравнением
v0 = kкатEоSо/(Km + Sо).
Полученное уравнение называется уравнением Михаэлиса — Ментен. При этом произведение kкатEo называется максимальной скоростью ферментативной реакции (Vmах).
v0 = VmахSо /(Km + Sо).
В случае, если k2 << k–1, то
Km ≈ k–1/k1 ≈ Ks,
где Ks — константа диссоциации фермент-субстратного комплекса.
Значение Ks можно определить, если принять концентрацию субстрата, при которой начальная скорость ферментативной реакции (v0) составляет половину от максимальной скорости (Vmах), то есть
v0 = Vmах/2 = VmахSо/(Km + Sо).
Решая это уравнение, можно получить:
Vmах (Km + So) = 2Vmах So; Km = So.
Таким образом, константа Михаэлиса есть величина, численно равная концентрации субстрата при скорости ферментативной реакции, составляющей половину максимальной.
127
Глава 8. Ферменты
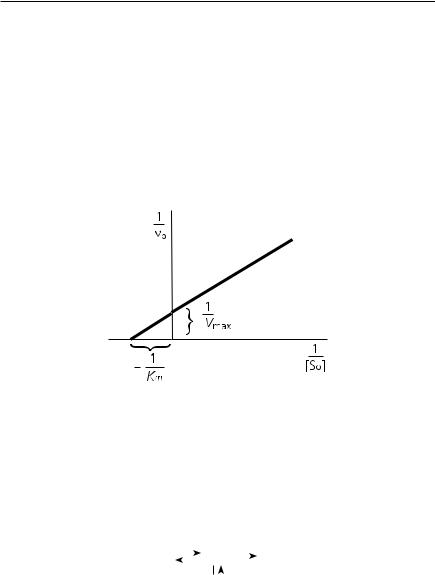
Для нахождения кинетических констант уравнение Михаэлиса — Ментен преобразуют в уравнение двойных обратных величин (метод Лайнуивера — Берка)
1/v0 = (1/Vmах) + (Km /Vmах)(1/Sо)
или уравнение Иди — Хофсти
v0 = Vmах — Km(v0/Sо).
Если построить график в координатах (1/v0, 1/So), то получим прямую линию, пересекающую оси абсцисс и ординат в точках –1/Km и 1/Vmах соответственно. При этом тангенс угла будет равен величине Km /Vmах (рис. 8.5).
Рис. 8.5. График Лайнуивера — Берка
Для определения константы ингибирования непосредственно из графика можно использовать метод Диксона, откладывая экспериментальные данные в координатах (1/v0, [Iо]).
В каталитическом действии фермента заложен сложный регуляторный механизм, который может реализоваться при участии субстрата по следующей схеме:
|
|
Ks |
|
|
k |
кат |
|
Е + S |
|
|
|
[ES] |
|
|
E + P |
|
|
|
|||||
|
|
|
|
|
|||
Ks′ 
 βkкат
βkкат
[ES2] 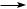 E + P
E + P
Ks′′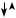

[ESn+2]
При этом реализуется следующий регуляторный механизм. Низкие концентрации субстрата инициируют каталитическую активность фер-
128

8.5. Регуляторное действие эффекторов ферментативных реакций
мента, тогда как при связывании двух молекул субстрата наблюдается активирование фермента (β > 1). Связывание нескольких молекул субстрата ингибирует фермент.
8.5.РЕГУЛЯТОРНОЕ ДЕЙСТВИЕ ЭФФЕКТОРОВ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
8.5.1. Ингибирование и активирование ферментов
Активность фермента регулируется с помощью различных соединений, которые способны связываться в области активного центра или регуляторного участка, расположенных на поверхности белковой глобулы. При этом проявляется эффект понижения или возрастания каталитической активности фермента. Эффекторы, вызывающие снижение или полное подавление активности фермента, называются ингибиторами, а повышающие активность энзима — активаторами. При этом механизмы ингибирования и активирования изучаются индивидуально для каждого фермента. Действие эффекторов является одним из элементов регуляторных процессов, осуществляющихся в биогенных системах.
Ферменты, синтез которых в клетке инициируется субстратом, называются индуцибельными. К этой группе ферментов относятся алькогольдегидрогеназа, нитратредуктаза, гексокиназа и др. Гены, ответственные за синтез индуцибельных ферментов, в основном находятся в репрессированном состоянии и активизируются только в присутствии субстрата. Ферменты, присутствующие постоянно в клетке в стационарных концентрациях, называются конститутивные.
Подробный анализ различных случаев ингибирования и активирования приводится в монографиях [Березин, Клесов, 1976; Березин, Мартинек, 1977]. Единой классификации эффекторов в настоящее время не существует. Однако наиболее часто встречающиеся типы ингибирования и активирования приведены ниже.
Конкурентный тип ингибирования проявляется в случае, если субстрат и ингибитор конкурируют за область связывания в активном центре фермента. При этом связывание ингибитора препятствует связыванию субстрата, замедляя протекание ферментативного процесса. Это наблюдается в том случае, когда ингибитор имеет схожее строение с субстратом или является субстратом с меньшим сродством к месту связывания. При этом график в координатах Лайнуивера–Берка имеет вид пучка прямых, пересекающихся на оси ординат (рис. 8.6).
Неконкурентный тип ингибирования проявляется в том случае, когда ингибитор и субстрат связываются в разных участках активного центра
129
Глава 8. Ферменты
[ ]
]
Рис. 8.6. График зависимости обратных начальных скоростей ферментативных реакций от концентрации субстрата в отсутствие (1) и в присутствии (2) конкурентного ингибитора
фермента. Однако при связывании ингибитора образуется фермент-суб- стратный комплекс, превращение в котором субстрата становится невозможным. График в координатах Лайнуивера–Берка имеет вид пучка прямых, пересекающихся на оси абсцисс (рис. 8.7).
[ ]
Рис. 8.7. График зависимости обратных начальных скоростей ферментативных реакций от концентрации субстрата в отсутствие (1) и в присутствии (2) неконкурентного ингибитора
При бесконкурентном типе ингибирования субстрат и ингибитор способны связываться в активном центре фермента, имея разные участки связывания. В присутствии ингибитора превращение субстрата несколько затрудняется, хотя его связывание несколько улучшается, т. е. ингибитор улучшает связывание субстрата, но ухудшает его превращение.
Антиконкурентный тип ингибирования проявляется при связывании ингибитора только с фермент-субстратным комплексом. При связывании
130

8.5. Регуляторное действие эффекторов ферментативных реакций
в активном центре фермента ингибитора останавливается каталитический процесс.
Смешанные типы ингибирования проявляются в случае взаимного влияния субстрата и ингибитора как при их связывании, так и при превращении субстрата. При этом графики в координатах Лайнуивера — Берка принимают вид семейства прямых с общей точкой пересечения в правом верхнем, левом верхнем или левом нижнем квадранте. Постоянные α и β характеризуют степень влияния ингибитора на каталитический процесс. Возрастание значения α(α>1) свидетельствует об ухудшении связывания субстрата в активном центре фермента, проявляемом в возрастании вели-
чин Km(каж) и Ki, тогда как понижение α (α < 1) может означать улучшение сродства субстрата у ферменту, сопровождаемое понижением значений
Km(каж) и Ki. Возрастание величины каталитической константы возможно при β > 1, а понижение — при значении β < 1.
Синергическая активация наблюдается в том случае, если связывание активатора в активном центре фермента, увеличивает сродство фермента к субстрату, проявляемое в понижении величины константы связывания.
Неконкурентная активация проявляется в случае, если субстрат и активатор связываются независимо в различных участках активного центра фермента. При этом образуется тройной комплекс, в составе которого фермент-субстрат-активатор. Связывание активатора ускоряет протекание каталитического процесса.
8.5.2. Аллостерические ферменты
На поверхности белковой глобулы фермента, помимо активного центра, может дополнительно присутствовать регуляторный участок, называемый аллостерическим центром. В этом центре могут связываться различные низкомолекулярные вещества (эффекторы), отличающиеся по строению от субстратов.
Связывание эффекторов в аллостерическом центре обусловливает конформационные перестройки белковой глобулы, что приводит к изменению активности фермента. При этом активность фермента может повышаться или понижаться. Ферменты, имеющие такой механизм регулирования активности, называются аллостерическими ферментами.
Аллостерический тип взаимодействия проявляется в S-образном характере кривой зависимости начальной скорости реакции от концентрации субстрата или эффектора. Такая зависимость обусловлена кооперативным механизмом, который проявляется в том, что связывание одной молекулы субстрата облегчает связывание второй молекулы субстрата, ускоряя протекание каталитической реакции.
131

Глава 8. Ферменты
8.5.3. Мультиферментные системы (метаболоны)
Интегрированность ферментов в ассоциативные комплексы обусловлена необходимостью проявления согласованного их действия в едином метаболическом процессе, протекающем в клетках живого организма. Образование мультиферментных комплексов происходит на поверхности или в структуре клеточных мембран. При этом обратимая адсорбция ферментов может выполнять роль регулятора каталитической активности, обеспечивая компартментализацию метаболитов.
Мультиферментные комплексы, адсорбированные на мембранах, обычно проявляют большую стабильность к действию денатурирующих факторов (температура, кислоты, щелочи, модификаторы и др.), чем индивидуальные формы ферментов.
В действии ферментов ассоциированных комплексов обычно проявляется эстафетный механизм, который осуществляется за счет того, что метаболиты остаются вблизи поверхности комплекса, обеспечивая последовательность протекания каталитических реакций. Такой механизм реализуется в действии ферментов гликолиза, пируват- и α-кетоглутарат- дегидрогеназных комплексов, цикла трикарбоновых кислот и др.
Упорядоченная сборка ферментов единого метаболического процесса создает условия для согласованного действия всех ферментов. В образовании комплекса принимает участие инициирующий формирование метаболона фермент. Так, для ферментов цикла трикарбоновых кислот таким ферментом служит сукцинатдегидрогеназа.
Образование сложных ферментных комплексов, участвующих в формировании пор мембран, обусловливает их участие в активном транспорте метаболитов через мембраны. Примером таких систем могут быть Na+,K+-АТФаза, Са2+-АТФаза, Н+-АТФаза и др.
Основной функцией мультиферментных комплексов является повышение эффективности ферментов, обусловливая их взаимную зависимость и кооперативность действия при минимуме энергетических затрат, при этом увеличивается каталитическая активность и термостабильность ферментативного комплекса, сочетающаяся с возможностью реализации регуляторных механизмов в ассоциированном комплексе.
8.6. ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ
Ферменты как биокатализаторы ускоряют протекание химических реакций в клетках живых организмов. Кроме того, они широко используются в биотехнологической, пищевой, кожевенной промышленностях, а также в медицине, сельском хозяйстве, фармацевтике и аналитических
132
