
Пищевая Биохимия / Казаков Е.Д., Карпиленко Г.П. - Биохимия зерна и хлебопродуктов
.pdf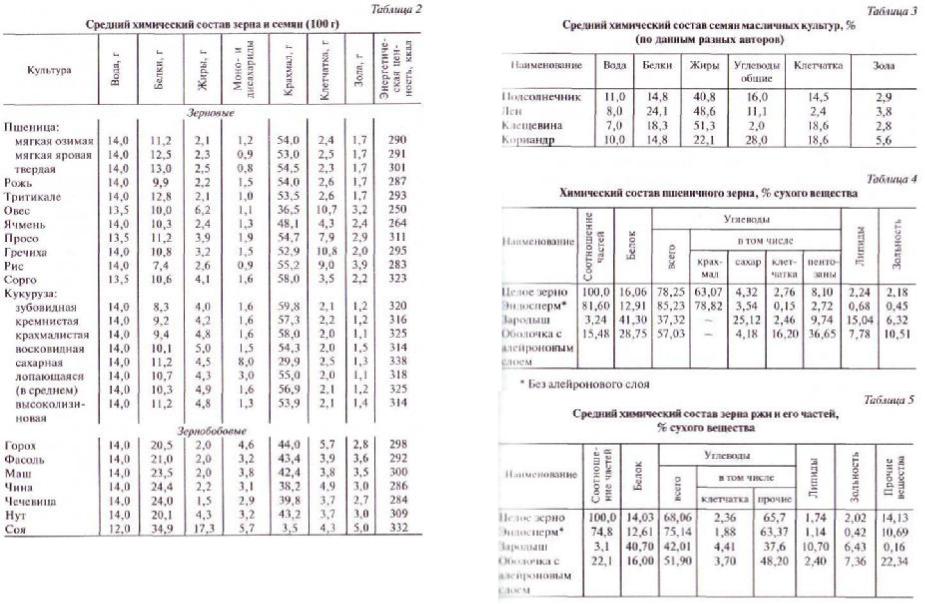
ГЛАВА 1 ____________________________________________________________ |
__________________________ВВОДНЫЕ БИОЛОГИЧЕСКИЕ ПОНЯТИЯ |
менты, витамины, пигменты, золообразующие соединения, влагу и др. В таблицах 2 и 3 приведены средний химический состав зерна и семян различных культур, а также семян мас- личных культур (по справочным таблицам содержания основ-
ных пищевых веществ и энергетической ценности пищевых
Без алейронового слоя
43
42
ГЛАВА I ____________________________________________ _______________
продуктов, одобренных Минздравом СССР). Содержание от- дельных химических веществ в плодах, зерне и семенах может
колебаться в значительных пределах в зависимости от сорта и природно-климатических условий выращивания растений.
Все зерновые культуры по химическому составу семян раз- деляют на четыре группы: богатые крахмалом (хлебные зла- ки); богатые белком (бобовые культуры); богатые маслом (мас- личные культуры), содержащие наряду со значительным количеством жирного масла эфирные масла (эфиромасличные культуры). Типичный представитель первой группы — пше- ница — важнейшая в нашей стране продовольственная куль- тура. В посевах, занятых зерновыми, на ее долю приходится около половины. Хлебопекарная мука в основном получается из зерна пшеницы, макаронная — только из зерна пшеницы. Распределение химических веществ по частям зерновки пше- ницы показано в таблице 4. Рожь — вторая по важности про- довольственная культура (табл. 5).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что такое биологический обмен веществ?
2.Как определяются катаболизм и анаболизм?
3.Каковы источники пищи и энергии живых организмов?
4.Каково строение клетки?
5.Какое строение имеет зерно пшеницы?
6.Какое строение имеют семена бобовых культур?
7.Каково строение семян масличных?
44
Глава 2
БЕЛКОВЫЕ ВЕЩЕСТВА
§ 1. ОБЩАЯ ХАРАКТЕРИСТИКА БЕЛКОВ
Белки, или протеины (греч. protos — первый, главный) — высокомолекулярные органические вещества со строго опре- деленным элементарным составом, распадающиеся при гид- ролизе до аминокислот. Они содержат (%): углерода — 51—53;
кислорода— 21,7-23,0; азота— 16,8-18,4; водорода— 6,9; серы — 0,7-1,3.
Белки — важнейшие вещества, входящие в состав живой клет-ки. В растениях белковые вещества содержатся в меньшем ко-личестве, чем углеводы, но в построении живой
материи и в осуществлении процессов жизнедеятельности они играют гла-венствующую роль. Почти все реакции в организме происходят с участием белков. Белки обладают многими свойствами, кото-рис отсутствуют у других органических соединений. Эти осо-бые свойства выражаются в бесконечном разнообразии струк-туры белков и их физических и химических превращений.
Разнообразны и важны функции белков. Белки образуют основу протоплазмы любой живой клетки, вместе с
липидами создают структуру всех клеточных мембран и органелл. Вы-полняют транспортные функции. Лежат в основе иммуните-та - невосприимчивости или малой
реактивности организма к инфекционным агентам и чужеродным веществам, его спо-собность защитить свою целостность и биологическую инди-видуальность. У
растений иммунитет обеспечивается защитными свойствами покровных и оболочечных клеток, изменением химизма пораженного места. Семена большин- ства растений образуют запасные отложения белков. Все фер- менты являются белками. Содержание белков и их качество
45

ГЛАВА 2
определяют технологическое достоинство зерна прежде всего хлебопекарное и макаронное. Количество белков и их амино- кислотный состав имеют важнейшее значение для био- логической, пищевой и кормовой ценности любого продукта.
Белки представляют собой важнейшие составные части пищи человека и кормов сельскохозяйственных животных. Белки — важнейший фактор биологической и пищевой цен- ности хлеба, крупы, макаронных изделий. От содержания бел- ков и их качества в кормах зависит продуктивность сельскохо- зяйственных животных. Наиболее характерный показатель белков — процентное содержание азота, например, в белке зер- на пшеницы 17,54%. По содержанию азота вычисляют содержание белка в продуктах питания и кормах, используя коэффициент пересчета (для пшеницы 100/17,54 = 5,7). Най-
денное количество азота в продукте в процентах умножают на коэффициент пересчета и таким образом определяют в нем процентное содержание белка. Коэффициент пересчета для пшеницы, ржи, овса, ячменя и продуктов из них— 5,70; гре- чихи, риса и продуктов из них— соответственно 6,09 и 5,95; остальных культур — 6,25.
Например, в навеске зерна пшеницы определили содержа- ние азота 2,3%, значит, в исследуемой пробе зерна содержится белка 2,3 х 5,7 = 13,11%.
Для белков характерны некоторые специфические реакции, совокупность которых используют для распознавания белко- вых веществ. К таким реакциям относят: свертывание и выпа- дение в виде сгустков при кипячении белковых растворов;
осаждение из растворов под влиянием белковых осадителей (растворов таннита, уксуснокислого свинца, вольфрамата на- трия, гидрата окиси меди, трихлоруксусной кислоты); окра- шивание, зависящее от наличия в белковой молекуле той или другой химической группировки. При ксантопротеиновой ре- акции появляется желтое окрашивание, указывающее на со- держание бензольного кольца; вишнево-красное — при реак- ции Миллона на фенольные группировки; фиолетовое или красно-фиолетовое — при биуретовой реакции на содержание пептидных связей СО — NH; фиолетовое — при реакции Адам- кевича на содержание индольной группировки.
БЕЛКОВЫЕ ВЕЩЕСТВА
§ 2. АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные соедине- нии, построенные из остатков аминокислот.
При кипячении с крепкими кислотами и щелочами, а так- же под действием ферментов белки гидролизуются до а-ами- нокислот. Большинство а-аминокислот представляет собой жирные кислоты, у которых один атом водорода в а-положе-
нии замещен аминогруппой NH2.
Большинство аминокислот растворимо в воде. Тирозин и лейцин плохо растворяются в воде, а цистин практически не- растворим. Многие аминокислоты можно идентифицировать по образуемым ими характерным солям.
В водных растворах все а-аминокислоты ионизируют и существуют преимущественно в виде биполярных ионов с дис-
социированной карбоксильной группой и протонированной аминогруппой.
46 |
47 |

ГЛАВА 2______________________________________________________________
В зависимости от рН среды аминокислоты могут быть в форме анионов, катионов, электронейтральных биполярных ионов или в виде смесей этих форм, одна из которых обычно доминирует. Аминокислоты — амфотерные соединения: в
сильнокислых растворах они становятся положительными ионами, в щелочных — отрицательными.
Вследствие амфотерности аминокислоты в зависимости от состава водного раствора могут реагировать с кислотами и с основаниями, образуя соответствующие соли. Гликокол несет заряды на а-аминной и карбоксильной группах. Большинство аминокислот обладает только этими двумя группами, но ряд аминокислот имеет и другие способные к ионизации группы. Диаминокарбоновая аминокислота — лизин имеет вторую аминную группу, а цистеин — сульфгидрильную группу — SH.
В зависимости от состава раствора они могут образовывать соли, реагируя с кислотами и щелочами. Благодаря амфотер- ности аминокислоты являются буферными веществами, вы- полняющими важную функцию регулирования рН в организ- ме. Аминогруппа может реагировать с азотистой кислотой, и
48
БЕЛКОВЫЕ ВЕЩЕСТВА
при этом аминокислота превращается в соответствующую ок- сикислоту, выделяя азот
Измерение количества выделяющегося при этой реакции азота лежит в основе количественного метода определения аминокислот по Ван—Сляйку.
Аминная группа способна взаимодействовать с формаль- дегидом, и, связав таким образом аминные группы, можно щелочью оттитровать свободные карбоксильные группы. Эта реакция лежит в основе так называемого формольного титро- вания при количественном определении аминокислот по Сё- ренсену. Очень важная реакция, используемая при определе- нии аминокислот методом хроматографии — взаимодействие аминокислот с нингидрином (трикетогидринденгидратом). Идентификацию и количественное определение аминокис- лот производят по интенсивности образующейся с нингид- рином окраски. Широко применяют автоматические анали- заторы аминокислот, в которых используется реакция с нингидрином.
§3. СТЕРЕОХИМИЯ АМИНОКИСЛОТ
Увсех аминокислот, за исключением глицина, атом угле-
рода, у которого водород замещен на группу NH2, является асимметрическим (все его валентности заняты четырьмя раз- личными заместителями) и обладает свойствами хирального центра. Вследствие такой особенности асимметрического ато- ма углерода аминокислоты оптически активны, причем они способны вращать плоскость поляризованного луча в проти- воположные стороны, существовать в виде пары энантиоме- ров — D и L. Заглавные буквы D и L указывают на конфигура- цию молекулы, а не направление плоскости поляризации света. Направление плоскости поляризации обозначают зна- ком «+» или «—». Так, различают D(+)-аланин и L(-)-аланин.
Знак и величина оптического вращения зависят от природы
49

ГЛАВА 2
растворителя, реакции среды, наличия в растворе солей и от природы боковой цепи (R-группы).
Большинство D-изомеров обладает сладким вкусом, а L-формы безвкусные или горькие. В состав белков входят толь- ко L-аминокислоты. При гидролизе белков в мягких условиях аминокислоты сохраняют свою оптическую активность. При кипячении белков в присутствии сильных оснований проис- ходит рацемизация (смесь эквимолекулярных количеств энан- тиомеров), образуется D- и L-смесь аминокислот, не облада- ющая оптической активностью.
D- и L-формы различают по пространственному располо- жению водорода радикала и аминогруппы у а-углеродного ато- ма серина, принятого за эталонное соединение
§ 4. АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКА
Известно свыше 200 аминокислот. Но в состав белков вхо- дят только 20 постоянно встречающихся аминокислот; они служат важнейшими мономерными блоками-звеньями, из ко- торых построены все белки. Порядок включения аминокислот в состав белка определяется генетическим кодом. В зависи- мости от характера боковых цепей (R) аминокислоты делят на алифатические и циклические.
По числу аминных и карбоксильных групп различают амино- кислоты: моноаминомонокарбоновые (глицин, аланин, валин, лейцин, изолейцин, серии, тренин, цистеин, метионин, триптофан, тирозин, фенилаланин); диаминомонокарбоновые (лизин, аргинин); моноаминодикарбоновые (аспарагиновая и глютаминовая кислоты); диаминодикарбоновые (цистин). Аминокислоты группируют по заряженности боковых радика-
_________________________________________БЕЛКОВЫЕ ВЕЩЕСТВА
лов, их полярности: неполярные гидрофобные (глицин, ала- нин, валин, лейцин, изолейцин, пролин, фенилаланин, трип- тофан, метионин); полярные, но незаряженные (серии, трео- нин, аспарагин, глутамин); полярные с отрицательным (аспарагиновая и глютаминовая кислоты, цистеин, тирозин) пли положительным (лизин, аргинин, гистидин) зарядом.
Моноамино-монокарбоновые аминокислоты. Гликокол или глицин (аминоуксусная кислота):
Гликокол не имеет асимметрического атома углерода, по- этому оптически неактивен.
L-Аланин (а-аминопропионовая кислота)
Очень распространен в природе. Играет большую роль в обмене веществ растений и животных.
L-Валин (а-аминоизовалериановая кислота)
В белках содержится в небольших количествах. L- Лейцин (ос-аминоизокапроновая кислота)
Содержится в большом количестве в проросшем зерне. При спиртовом брожении — источник образования сивушного масла.
L - Изолейцин (а-амино-б-этил-б-метилпропионовая кис- лота)
50
51

ГЛАВА 2_________________________ |
_____________________________ |
В белках встречается в незначительных количествах. Вме-
сте с валином и лейцином служит источником образования сивушных масел при брожении.
L-Серин (а-амино-б-оксипропионовая кислота)
Принадлежит к оксиаминокислотам. L-Треонин (а-амино-б-оксимасляная кислота)
Также является оксиаминокислотом. L-Цистеин (а-амино-б-тиопропионовая кислота)
Цистеин содержит сульфгидрильную группу (—SH), игра-
ет большую роль в обмене веществ как восстанавливающий агент, легко превращается в цистин.
БЕЛКОВЫЕ ВЕЩЕСТВА
Служит дозатором (источником) метильных групп. L- Триптофан (а-амино-б-индолилпропионовая кислота):
Имеет большое значение в обмене веществ. Связан с образованием в живом организме витамина РР (ниацина). L- Гистидин (а-амино-б-имидазолилпропионовая кислота):
L-Фенилаланин (а-амино-б-фенилпропионовая кислота):
Входит в состав белка и обусловливает желтую окраску при ксантопротеиновой реакции.
L-Тирозин (а-амино-б-оксифенилпропионовая кислота):
Одна из наиболее распространенных в природе аминокис- лот. Содержится во всех белках. От ее присутствия в белке зави- сит реакция Миллона, дает также ксантопротеиновую реакцию.
52 |
53 |

ГЛАВА 2 |
___________________________________________________ |
Тирозин относится к веществам, от которых зависит цвет пшеничного теста и изделий из него. Под действием фермента тирозиназы (монофенол—монооксигеназы) он окисляется и дает темноокрашенные продукты — меланины.
L-Пролин (пирролидин-а-карбоновая кислота):
Много пролина содержится в спирторастворимых белках злаков.
Моноамино-дикарбоновые аминокислоты. L-Аспарагиновая кислота (аминоянтарная)
Благодаря двум карбоксильным группам в водных раство- рах обладает кислой реакцией. В воде растворяется плохо. Иг- рает важную роль в обмене веществ у растений. В раститель-
ных белках содержится в больших количествах в виде своего моноамида — аспарагина.
L-Глютаминовая кислота (а-аминоглютаровая):
Эта кислота дает в растворах кислую реакцию. В белках растений содержится обычно в наибольшем количестве. В ра-
стениях и в растительных белках присутствует в виде своего моноамида — глутамина:
_________________________________________БЕЛКОВЫЕ ВЕЩЕСТВА
L - а-Аминоадипиновая кислота
Входит в состав водорастворимого белка зерна кукурузы. Диаминомонокарбоновые кислоты. L-Аргинин (L-амино-б-
гуанидин-Н-валериановая кислота):
Аргинин вместе с лизином и гистидином относят к группе основных аминокислот. В водных растворах дает щелочную реакцию.
L-Лизин (а, е -диаминокапроновая кислота):
Кроме а-аминокислот в зерне найдена у-
аминомасляная кислота
которая образуется из глютаминовой кислоты в результате де- карбоксилирования под действием фермента глютаматдекар- боксилазы. В отличие от растений человек и животные синте- зируют не все аминокислоты входящие в состав белков.
54 |
55 |
|

ГЛАВА 2
В связи с этим аминокислоты делят на две группы: синте- зируемые организмом человека и животных, или заменимые, и несинтезируемые, или незаменимые (их также называют обязательными).
§ 5. ФОРМЫ СВЯЗЕЙ В БЕЛКЕ
Большая и сложная молекула белка образуется в результате возникновения связей различной прочности. Наиболее проч- ны ковалентные связи. Основную химическую, наиболее проч- ную химическую связь — ковалентную образуют атомы (или группы атомов), на валентных орбиталях которых имеются неспаренные электроны. Обобществление этих электронов ведет к формированию общей для связывающихся атомов элек- тронной пары. К ним относят пептидные, дисульфидные и сложно-эфирные.
Пептидной связью (—СО—NH—) соединяются между со- бой остатки аминокислот. Дисульфидная связь (—S—S—) об- разуется за счет двух сульфгидрильных групп (—SH) остатков цистеина. Для фосфопротеинов характерно образование эфи- ров фосфорной кислоты и серина.
Важна также ионная связь (солевая), характерная для со-
лей и обусловленная притяжением между противоположно заряженными ионами. В белках существуют также водород- ные связи. Водородная связь проявляется между атомами во-
дорода с атомами наиболее электроотрицательных элементов
Гликозидная связь |
3,5-фосфодиэфирная связь |
56
_________________________________________БЕЛКОВЫЕ ВЕЩЕСТВА
(О, N, Fe и др.). Водородная связь образуется, когда протон водорода, ковалентно связанный с одним из этих атомов, рас- полагается между ними. Атом водорода содержит единст- веннный электрон, и когда этот электрон уходит на
образование ковалентной связи, ядро (протон) остается без электронных
слоев. Такой водород (протон) не отталкивается электронны- ми облаками соседних атомов, а наоборот притягивается ими, образуя водородную связь, которая слабее, чем ковалентная или ионная связь, но сильнее, чем слабые силы межмолеку- лярного притяжения.
Водородные связи могут быть внутримолекулярными и межмолекулярными. Многие жидкости (вода, органические кислоты, спирты и др.) являются ассоциированными благо- даря образованию межмолекулярных водородных связей, уг- лерод не способен к образованию водородных связей, пото- му что его электроотрицательность значительно меньше, чем у О или N, она довольно близка к Н. Поэтому углеводородные цепи гидрофобны, они с трудом проникают в воду, так как не могут разорвать ее водородные связи. У соединений с группа-
ми ОН, — NH2, — СООН, —С =ОН хорошо
выражена
способность к образованию водородных связей, они гид- рофильны. Молекулы воды образуют водородные связи не только между собой, но и с полярными группами растворен- н ы х соединений. Полярность молекулы воды, способность
образовывать водородные связи очень важны в ее роли биологического растворителя — основной среды живых кле- ток. Единичные водородные связи, образованные в водном растворе, очень слабы. Если в макромолекуле существует большое число водородных связей, возникает большая их сум- марная прочность. Это явление называют кооперативностью водородных связей. Белковая молекула имеет два вида водо- родных связей: между группами пептидных связей и между боковыми радикалами аминокислот. Не менее важны в ста- билизации белков и других биополимеров и их функциони- рования гидрофобные взаимодействия, они еще слабее во- дородных связей. Это— особый вид межмолекулярных сил,
57

ГЛАВА 2_______________________________________________________________
Рис. 6. Схема гидрофобного взаимодействия между двумя неполярными груп- пами аланина и лейцина (изображены темным цветом; молекулы воды изобра- жены светлыми кружками)
действующих только между неполярными молекулами (ра- дикалами) и только в водной среде (рис. 6).
Гидрофобное взаимодействие возникает в результате того, что молекулы воды, стремясь образовывать между собой во- дородные связи, выталкивают гидрофобные группы; они сближаются до тех пор, пока не соприкоснутся; скручивают- ся, создавая ассоциаты. Молекулы воды при этом выдвига- ются из той сферы, в которой возникает гидрофобное взаи- модействие. Сближение неполярных групп, их тесный
контакт сопровождается уменьшением числа окружающих их молекул воды.
При этом никаких связей между гидрофобными группами или молекулами не образуется. Возможно только возникно- вение ван-дер-ваальсовых сил притяжения. Ван-дер-вааль- совые силы — более слабое по сравнению с химическими свя-
зями межмолекулярное взаимодействие под влиянием электростатического притяжения, регулируемое условиями взаиморасположения групп или молекул, вступивших во вза- имодействие (расстояние между их центрами и другие пара- метры), связанное с перемещением и деформацией этих групп или молекул.
Способностью к гидрофобным взаимодействиям обладают остатки валина, лейцина, изолейцина, фенилаланина, а так- же, возможно, пролина, аланина, триптофана, метионина и цистина.
БЕЛКОВЫЕ ВЕЩЕСТВА
Единичные гидрофобные взаимодействия, слабые каждое и отдельности, благодаря кооперативности многих таких вза- имодействий, образуют очень прочные ассоциации, стабили- зирующие структуру белковой молекулы.
§ 6. ПРОСТРАНСТВЕННАЯ СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ
Белки — это линейные сополимеры, построенные из остат- ков аминокислот. Они имеют несколько последовательно воз- никающих уровней пространственной структуры (организа- ции). Различают четыре уровня структуры белковой молекулы: первичную, вторичную, третичную и четвертичную.
Первичная структура. Возникает благодаря пептидным свя- зям между а-карбоксильной и а-аминогруппой.
Благодаря соединению по этому принципу десятков и со-
тен аминокислотных остатков образуется полипептидная цепь. Полипептидная теория строения белковой молекулы, предложенная Эмилем Фишером, оказалась основополагаю- щей, вокруг которой развиваются современные представления о структуре белка. Первичной структурой белка называют пос-
ледовательность расположения аминокислотных остатков в полипептидной цепи.
Вторичная структура — это упорядоченное пространствен-
ное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокис- лот. Она образуется за счет замыкания водородных связей меж- ду пептидными группами. Вторичная структура представлена в основном регулярными структурами: а-спираль, складчатые слои (б-структура), б-изгиб. Часть полипептидной цепи не
58 |
59 |

ГЛАВА 2
имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями. Без подробно- стей, в общем виде, вторичную структуру можно охарактери- зовать так: в а-спиральных участках и участках с б-складчатой
структурой все последовательно расположенные пептидные звенья полипептидной цепи имеют идентичные взаимные ориентации. Такой участок полипептидной цепи имеет линей- ную структуру, формируется из линейных групп. В а-структу- ре между отдельными участками всей длинной полипеп- тидной части возникают водородные связи. В результате полипептидная цепь закручивается. Спиралевидная а-струк- тура схематически представлена на рис. 7. Один полный виток спирали включает 3,6-аминокислотных остатка, а «шаг» спи- рали, соответствующий одному аминокислотному остатку имеет длину 0,15 нм.
Складчатые участки полипептидной цепи образуются за счет водородных связей между полипептидными цепями. От- личительная особенность (б-структуры в том, что полипептид- ные цепи в ней вытянуты, расположены параллельно, их пеп- тидные группы (С=О и —NH) лежат в одной плоскости и ориентированы так, что могут образовывать водородные свя- зи с соответствующими группами соседних цепей. Складча-
Рис. 7. Схема а-структуры полипептидной цепочки
______________________________________________БЕЛКОВЫЕ ВЕЩЕСТВА
Рис. 8. Схема б-структуры полипептидных цепочек
тыe участки полипептидной цепи проявляют кооперативные свойства, т. е. стремятся расположиться рядом в белковой мо- лекуле, и формируют параллельные и антипараллельные складчатые слои или листы, которые укрепляются благодаря
водородным связям между складчатыми участками цепи
(рис. 8).
Антипараллельная б-структура образуется в том случае, если складчатая цепь делает поворот назад и идет в обратном на- правлении; в месте поворота образуется б-изгиб, в который вхо-
дят четыре последовательно расположенных аминокислотных остатка. Параллельная б-структура складывается участками из полипептидной цепи, направления которых совпадают. Ан- типараллельность цепей создает наиболее благоприятные ус-
ловия для возникновения водородных связей между ними при участии пептидных групп. В случае параллельного располо- жения цепей в структуре складчатого б-слоя водородные свя- зи между цепями менее прочны. Боковые радикалы амино-
кислотных остатков приблизительно перпендикулярны плоскости б-складчатых слоев, причем боковые цепи аминокислот ориентированы поочередно то по одну, то по другую сторону этой плоскости.
Третичная структура. Представляет собой расположение в пространстве полипептидной цепи, отдельные участки кото- рой имеют вторичную структуру. По форме белковой молеку- лы, сложившейся на третьем уровне пространственной ее орга- низации, различают белки глобулярные и фибриллярные.
60 |
61 |
