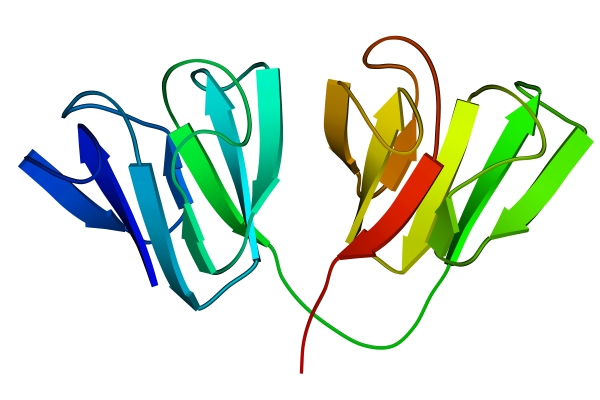- •Федеральное агентство по образованию
- •СОдержАние
- •I. Теоретическая часть предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •1.4. Структурная организация белков
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2. Контроль активности фермента.
- •2.2. Химическая модификация фермента
- •2.3. Аллостерическая регуляция
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •3.2. Водорастворимые витамины
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •1. Фосфолипиды (до 90%) – глицерофосфолипиды и сфингофосфолипиды: фосфатидилхолин
- •Церамид
- •Галактозилцерамид
- •4.2. Транспорт веществ через мембрану
- •2. Облегченная диффузия
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Генерация свободных радикалов в клетке
- •6.6. Реакции общего пути катаболизма
- •6.6.1. Окислительное декарбоксилирование пвк
- •6.6.2. Цикл трикарбоновых кислот
- •Регуляция общего пути катаболизма
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •Глюкоза → глюкозо-6-фосфат.
- •Пируват → оксалоацетат → фосфоенолпируват
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов.
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Анализ аминокислот и белков
- •1. Качественный анализ аминокислотных смесей методом бумажной хроматографии.
- •2. Цветные реакции на белки.
- •3. Реакции осаждения белков.
- •3. 1. Осаждение белков при нагревании.
- •3.2. Осаждение белков солями тяжелых металлов.
- •3.3. Осаждение белков концентрированными минеральными кислотами.
- •3.5. Осаждение белков органическими кислотами.
- •Контрольные вопросы
- •Работа 2. Сложные белки – фосфопротеины и гликопротеины
- •2. Гликопротеины.
- •1.2. Реакция с дифениламином.
- •2.Хромопротеины.
- •2.1. Бензидиновая проба на геминовую группировку гемоглобина.
- •Контрольные вопросы
- •4. Специфичность действия ферментов амилазы и сахаразы.
- •Контрольные вопросы
- •Работа 5. Определение активности ферментов
- •1. Действие активаторов и ингибиторов на α-амилазу слюны.
- •2. Определение активности α-амилазы слюны по Вольгемуту.
- •Контрольные вопросы
- •Работа 6. Витамины
- •9.1. Взаимодействие витамина с с к3[Fe(cn)6].
- •9.2. Реакция с метиленовой синью.
- •Контрольные вопросы
- •Работа 7. Оксидоредуктазы
- •1. Обнаружение дегидрогеназы (ксантиноксидаза, альдегиддегидрогеназа, кф 1.1.3.22) в молоке (реакция Шардингера).
- •2. Сопоставление редокс-потенциалов рибовлавина и метиленового синего.
- •3. Определение каталазы по а.Н. Баху и а.И. Опарину.
- •Контрольные вопросы
- •Работа 8. Обмен углеводов
- •3.1. Реакция Троммера с гидроксидом меди.
- •3.2. Выявление фруктозурии пробой Селиванова.
- •3.3. Энзиматический метод полуколичественного определения глюкозы в моче с помощью тест-полоски "glucophan".
- •Контрольные вопросы
- •Литература
1.4. Структурная организация белков
Доказано существование 4 уровней структурной организации белковой молекулы.
Первичная структура белка – последовательность расположения аминокислотных остатков в полипептидной цепи. В белках отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии -карбоксильных и -аминогрупп аминокислот.

К настоящему времени расшифрована первичная структура десятков тысяч разных белков. Для определения первичной структуры белка методами гидролиза выясняют аминокислотный состав. Затем определяют химическую природу концевых аминокислот. Следующий этап - определение последовательности аминокислот в полипептидной цепи. Для этого используют избирательный частичный (химический и ферментативный) гидролиз. Возможно применение рентгеноструктурного анализа, а также данных о комплементарной нуклеотидной последовательности ДНК.
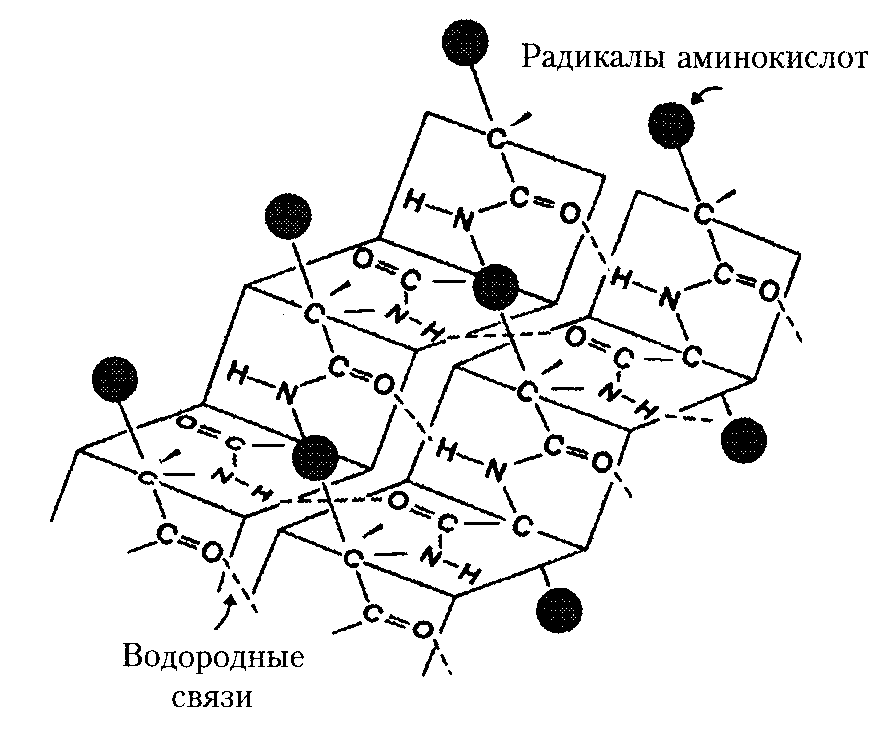
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ упаковки полипептидной цепи в определенную конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре.
Стабильность вторичной структуры обеспечивается в основном водородными связями, однако определенный вклад вносят ковалентные связи – пептидные и дисульфидные.
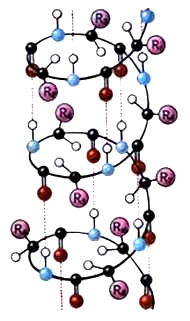
Наиболее вероятным типом строения глобулярных белков считают -спираль. Закручивание полипептидной цепи происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Если цепи гемоглобина спирализованы на 75%, то пепсина-всего на 30%.
Тип конфигурации полипептидных цепей, обнаруженных в белках волос, шелка, мышц, получил название -структуры. Сегменты пептидной цепи располагаются в один слой, образуя фигуру, подобную листу, сложенному в гармошку. Слой может быть образован двумя или большим количеством пептидных цепей.
|
а |
б |
|
Рис. 1. Вторичная структура белка: а - -спираль, б - -структура. | |
В природе существуют белки, строение которых не соответствует ни β-, ни -структуре, например, коллаген - фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, третичная структура которого была выяснена рентгеноструктурным анализом - миоглобин кашалота (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основную роль играют нековалентные связи (водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, гидрофобные взаимодействия и т.д.).
По современным представлениям, третичная структура белка после завершения его синтеза формируется самопроизвольно. Основной движущей силой является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот погружаются внутрь белковой молекулы, а полярные радикалы ориентируются в сторону воды. Процесс формирование нативной пространственной структуры полипептидной цепи называют фолдингом. Из клеток выделены белки, названные шаперонами. Они участвуют в фолдинге. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций процесса фолдинга (пигментозы, фиброзы и др.).
Методами рентгеноструктурного анализа доказано существование уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
|
|
|
|
Рис. 2. Третичная структура миоглобина |
Рис. 3. Глобулярные домены в g-кристаллине (белке хрусталика глаза человека)
|
Все биологические свойства белков связаны с сохранностью их третичной структуры, которую называют нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения частей пептидной цепи. Эти изменения не нарушают общей конформации молекулы. На конформацию молекулы белка оказывают влияние рН среды, ионная сила раствора, взаимодействие с другими веществами. Любые воздействия, приводящие к нарушению нативной конформации молекулы, сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка - способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой или разной первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Белковую молекулу, состоящую из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него цепь - протомером. Олигомерные белки чаще построены из четного числа протомеров, например, молекула гемоглобина состоит из двух - и двух -полипептидных цепей (рис. 4).
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулины. Субъединичное строение свойственно многим ферментам.
-
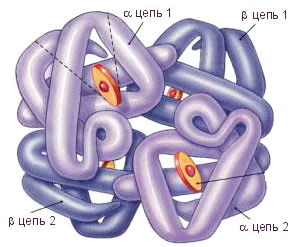
Рис. 4. Молекула гемоглобина
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. Биологическую активность белок приобретает только при объединении входящих в его состав протомеров. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Некоторые исследователи признают существование пятого уровня структурной организации белков. Это метаболоны - полифункциональные макромолекулярные комплексы разных ферментов, катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).