
- •Федеральное агентство по образованию
- •СОдержАние
- •I. Теоретическая часть предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •1.4. Структурная организация белков
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2. Контроль активности фермента.
- •2.2. Химическая модификация фермента
- •2.3. Аллостерическая регуляция
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •3.2. Водорастворимые витамины
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •1. Фосфолипиды (до 90%) – глицерофосфолипиды и сфингофосфолипиды: фосфатидилхолин
- •Церамид
- •Галактозилцерамид
- •4.2. Транспорт веществ через мембрану
- •2. Облегченная диффузия
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Генерация свободных радикалов в клетке
- •6.6. Реакции общего пути катаболизма
- •6.6.1. Окислительное декарбоксилирование пвк
- •6.6.2. Цикл трикарбоновых кислот
- •Регуляция общего пути катаболизма
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •Глюкоза → глюкозо-6-фосфат.
- •Пируват → оксалоацетат → фосфоенолпируват
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов.
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Анализ аминокислот и белков
- •1. Качественный анализ аминокислотных смесей методом бумажной хроматографии.
- •2. Цветные реакции на белки.
- •3. Реакции осаждения белков.
- •3. 1. Осаждение белков при нагревании.
- •3.2. Осаждение белков солями тяжелых металлов.
- •3.3. Осаждение белков концентрированными минеральными кислотами.
- •3.5. Осаждение белков органическими кислотами.
- •Контрольные вопросы
- •Работа 2. Сложные белки – фосфопротеины и гликопротеины
- •2. Гликопротеины.
- •1.2. Реакция с дифениламином.
- •2.Хромопротеины.
- •2.1. Бензидиновая проба на геминовую группировку гемоглобина.
- •Контрольные вопросы
- •4. Специфичность действия ферментов амилазы и сахаразы.
- •Контрольные вопросы
- •Работа 5. Определение активности ферментов
- •1. Действие активаторов и ингибиторов на α-амилазу слюны.
- •2. Определение активности α-амилазы слюны по Вольгемуту.
- •Контрольные вопросы
- •Работа 6. Витамины
- •9.1. Взаимодействие витамина с с к3[Fe(cn)6].
- •9.2. Реакция с метиленовой синью.
- •Контрольные вопросы
- •Работа 7. Оксидоредуктазы
- •1. Обнаружение дегидрогеназы (ксантиноксидаза, альдегиддегидрогеназа, кф 1.1.3.22) в молоке (реакция Шардингера).
- •2. Сопоставление редокс-потенциалов рибовлавина и метиленового синего.
- •3. Определение каталазы по а.Н. Баху и а.И. Опарину.
- •Контрольные вопросы
- •Работа 8. Обмен углеводов
- •3.1. Реакция Троммера с гидроксидом меди.
- •3.2. Выявление фруктозурии пробой Селиванова.
- •3.3. Энзиматический метод полуколичественного определения глюкозы в моче с помощью тест-полоски "glucophan".
- •Контрольные вопросы
- •Литература
1.2. Реакция с дифениламином.
Дезоксирибонуклеиновую кислоту обнаруживают по ее реакции с дифениламином. В пробирку переносят немного осадка ДНК и растворяют его в 1-2 мл 0,4%-ного раствора гидроксида натрия. К раствору добавляют равный объем раствора дифениламина и смесь нагревают в кипящей водяной бане около 10-15 мин. Появляется синее окрашивание раствора.
2.Хромопротеины.
Представителем хромопротеинов является белок эритроцитов крови млекопитающих гемоглобин. Его белковой частью глобин, а небелковой – гем (протопорфирин, пиррольные кольца которого связаны с атомом железа).
2.1. Бензидиновая проба на геминовую группировку гемоглобина.
В пробирку наливают 0,5 мл сильно разведенной крови и кипятят несколько минут, затем охлаждют. Добавляют 0,5 мл раствора бензидина и несколько капель 3% раствора пероксида водорода. Появляется зеленая, переходящая в синюю окраска. При действии на гемоглобин концентрированной уксусной кислоты гем переходит в гемин, который и катализирует окисление бензидина пероксидом водорода.
Бензидиновая проба применяется при клинических и судебно-медицинских исследованиях для обнаружения минимальных количеств крови в биологических объектах.
Контрольные вопросы
1. Перечислите функции хромопротеинов в организме.
2. Укажите строение белковой части гемоглобина.
3. Почему гемоглобин зародыша и ребенка обладает разным сродством к кислороду?
4. После пожара обнаружен труп. Каким простым способом можно определить, погиб ли человек во время пожара или он умер до пожара?
5. Охарактеризуйте химический состав нуклеопротеинов и их функции в организме.
6. Что лучше растворяется в воде: нуклеиновые кислоты или нуклеопротеины? Почему?
Работа 4. Ферменты
1. Открытие пероксидазы в картофеле.
Картофель натирают на терке. Небольшое его количество переносят в пробирку, добавляют 1 мл 1%-ного раствора пирогаллола и 2 капли 2%-ного раствора пероксида водорода. При стоянии выпадает желто-бурый осадок пурпурогаллина:

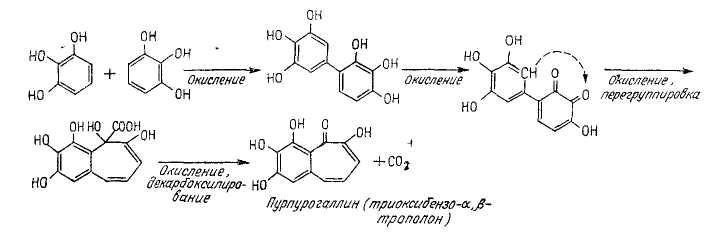
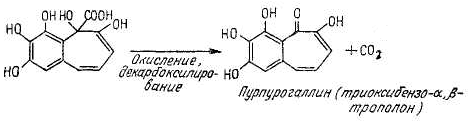
Многократное дегидрирование (окисление) пирогаллола и ряда промежуточных продуктов до образования пурпурогаллина происходит с участием пероксидазы, передающей атомы водорода с субстрата на пероксид водорода.
2. Открытие пепсина в желудочном соке.
В пробирку наливают 5 мл молочноацетатной смеси и помещают ее в термостат при температуре 25°С. После того как пробирка прогреется до указанной температуры, в нее добавляют 0,1 мл желудочного сока и перемешивают. Следят за моментом появления на стенке пробирки первых сгустков казеина. Этот момент свидетельствует о завершении реакции перехода растворимого казеиногена в нерастворимый казеин под действием протеолитического фермента — пепсина.
3. Гидролиз крахмала α-амилазой слюны
Рот ополаскивают 2—3 раза водой для удаления остатков пищи. Отмеряют 50 мл дистиллированной воды и ополаскивают ею рот в течение 3-5 мин в несколько приемов. Собранную жидкость фильтруют через вату и фильтрат используют для работы.
Готовят 2 водяные бани с температурой 37-40 и 100°С. В пробирки наливают растворы в соответствии с таблицей. Помещают пронумерованные пробирки в бани. Через каждые 2 минуты наносят на стеклянную пластинку стеклянной палочкой каплю раствора Люголя, а затем чистой палочкой - каплю раствора из пробирки. Отмечают окрашивание, возникшее при смешивании двух капель. Опыт продолжают 10-15 минут. Результаты опыта и выводы о протекании гидролиза (полный, частичный, не протекает) заносят таблицу (таблица 1).
Таблица 1. Результаты гидролиза крахмала.
|
№ |
Содержимое пробирки |
Температура, °С |
Время, мин. |
Цвет в реакции с йодом |
Наличие гидролиза |
|
1 |
3 мл р-ра крахмала + 2 мл 10% H2SO4 |
37 |
2 4 … |
|
|
|
2 |
3 мл р-ра крахмала + 2 мл 10% H2SO4 |
100 |
2 4 … |
|
|
|
3 |
3 мл р-ра крахмала + 3 мл р-ра амилазы |
37 |
2 4 … |
|
|
|
4 |
3 мл р-ра крахмала + 3 мл р-ра амилазы + 1 мл 2 н НС1 |
37 |
2 4 … |
|
|
|
5 |
3 мл р-ра крахмала + 3 мл прокипяченного р-ра амилазы |
37 |
2 4 … |
|
|
Схема гидролиза крахмала α-амилазой слюны:
|
(С6Н10О5)n крахмал |
|
(С6Н10О5)m амилодекстрины |
|
|
(С6Н10О5)k эритродекстрины |
|
|
(С6Н10О5)l ахродекстрины |
|
(С6Н10О5)x мальтодекстрины |
|
|
С12Н22О22 мальтоза |
|
